Viili乳制品中干酪乳杆菌的分离鉴定
2012-01-12张书光张云娟代卫东荀绍雄刘旭川柴俊张以芳
张书光,张云娟,代卫东,荀绍雄,刘旭川,柴俊,张以芳*
(1.云南农业大学动物科学技术学院,云南昆明650201;2.云南农业大学教务处,云南昆明650201;3.富源县大河镇农业综合服务中心畜牧办,云南曲靖655505)
Viili是芬兰传统的乳制品,具有极其宜人的口味和较好的双乙酰风味。Viili酸奶发酵与传统的酸奶发酵原理基本相同,是以糖为底物在细菌、酵母菌和丝状真菌等多种微生物[1-2]的作用下发酵形成。Viili乳品在菌种构成上与我国的酸奶有许多不同的地方。我国的现有市售酸奶中主要的菌种是嗜热链球菌和保加利亚乳杆菌,某些乳制品中也含有乳酸乳球菌乳酸亚种和乳酸乳球菌乳脂亚种,但却极少含有乳酸乳球菌二乙酰乳酸亚种、肠膜明串球菌乳脂亚种[3]、白地霉[4]和干酪乳杆菌的菌株。干酪乳杆菌在以乳为基质的环境中生长时,通过胞外蛋白酶的作用将乳蛋白中特定的蛋白组分分解(主要是β-酪蛋白),能产生多种对血管紧张素I(ACE)转化具有抑制作用的小肽和短肽。其中以Val-Pro-Pro(缬氨酸-脯氨酸-脯氨酸)和Ile-Pro-Pro(异亮氨酸-脯氨酸-脯氨酸)在体内的抗血压作用最为显著。本研究从Viili乳制品中分离出干酪乳杆菌,并进行了种属鉴定。
1 材料与方法
1.1 材料
1.1.1 材料Viili样品由芬兰Turku大学罗成博士提供;MRS培养基购自北京陆桥技术有限责任公司;pMD18-T载体、BamHⅠ、HindⅢ、细菌基因组DNA提取试剂盒(DP2001)和多功能DNA纯化回收试剂盒均购自大连宝生物技术有限公司。
1.1.2 引物参考GenBank已发表的乳酸菌16S rRNA序列,设计乳酸菌16S rRNA通用引物,上游引物Viili PF:5'-AGA GTT TGA TCC TGG CTC AG-3',下游引物Viili PR:5'-AAG GAG GTG ATC CAG CC-3',扩增目的片段大小为1 500 bp左右,由大连宝生物技术有限公司合成。
1.2 方法
1.2.1 菌株的分离与纯化将Viili样品依次进行梯度稀释(10-1~10-6),取1 mL各稀释度的稀释液倾注培养于加碳酸钙MRS培养基内,37℃厌氧培养48 h。挑取单个有典型溶钙圈的菌落,进行纯培养及菌种保存。
1.2.2 表型鉴定①形态特征及生理学特性试验:革兰染色观察菌体形态。MRS培养基观察菌落形态,半固体培养基穿刺培养观察菌株的运动性。35℃生长试验、pH 4.5培养基生长试验观察菌株的生理特征;②生理生化试验:分离菌株进行接触酶试验、硫化氢试验、糖发酵试验、明胶液化试验、精氨酸产氨试验、硝酸盐还原试验及各种糖发酵试验等,观察菌株的生化特征。
1.2.3 16SrRNA鉴定①16S rRNA测序:将分离菌株接种于MRS培养基上,25℃厌氧培养24 h,用试剂盒按说明书方法提取基因组DNA。用Viili PF及Viili PR引物扩增16S rRNA,PCR扩增体系为50 μL,反应条件为95℃5 min,94℃30 s,55℃1 min,72℃1.5 min,30个循环;72℃10 min。扩增产物用试剂盒按说明书方法进行纯化,纯化产物与pMD18-T载体连接构建重组质粒,将重组质粒转化到DH5α大肠埃希菌中,经氨苄抗性筛选、蓝白斑筛选及BamHⅠ和HindⅢ双酶切鉴定,阳性克隆送大连TaKaRa公司测序;②16S rRNA参考比较序列来源:根据文献[5],从GenBank中下载16S rRNA参比序列。用于7个分支群鉴定的代表菌株16S rRNA参比序列见表1,用于分支群中种鉴定的代表菌株16S rRNA参比序列见表2。

表1 乳杆菌7个分支群代表菌株参比序列Table 1 Seven reference sequences of lactobacillus branch

表2 干酪乳杆菌分支群中干酪乳杆菌种的鉴定代表菌株参比序列Table 2 Reference sequences of lactobacillus casei branch

续表
1.2.4 16S rRNA同源性分析和系统发育分析根据文献[6]、[7]及伯杰氏细菌鉴定手册(第8版、第9版)[8-9]乳酸菌的表型特征,结合乳酸菌16S rRNA特性,将分离菌株鉴定到种。首先将得到的序列与GenBank数据库中的7个类群中的代表序列用本地软件DNAMAN进行同源性比对,鉴定到属中的分支群。然后再与鉴定的分支群中的种和亚种的序列进行比对,鉴定到种和亚种。最后利用本地软件Cluster X和Mega 4.0构建2个系统进化发育树,进行系统进化亲缘关系研究。
2 结果与分析
从样品中分离到3株乳酸菌,分别命名为LV-1、LV-4和LV-5。
2.1 表型特征
2.1.1 菌落特征在加钙MRS培养基上37℃、24 h厌氧培养后,菌落呈乳白色、圆形隆起,表面湿润、光滑,边缘整齐,直径2 mm。单个菌落能形成8~12 mm溶CaCO3圈。其菌落形态特征见图1。

图1 菌落特征Fig.1 Colonies characteristics
2.1.2 形态特征革兰染色后光镜下检查,3株乳酸菌均为紫红色、杆状、两端顿圆、无鞭毛、无荚膜、无芽胞、革兰阳性细菌。其镜检特性见图2。
2.1.3 生理生化实验结果①分离菌生理特性和运动性鉴定:3株分离菌在35℃和pH 4.5条件下均可以生长;分离菌只生长于半固体培养基穿刺线上,边缘清晰,表明无运动性;②生化试验结果:3株分离菌的生化实验结果相同:接触酶、硫化氢产生、明胶液化、精氨酸产氨及硝酸盐还原实验均呈阴性;③糖发酵实验结果:不能发酵阿拉伯糖、七叶灵、葡萄糖酸盐、棉籽糖、鼠李糖、水杨苷、木糖发酵;能发酵半乳糖、葡萄糖、乳糖、麦芽糖、甘露醇、甘露糖、果糖、山梨醇和蔗糖。

图2 革兰染色形态Fig.2 Gram staining characteristics

表3 生理特性和运动性试验Table 3 Physiological characteristics and athletic test
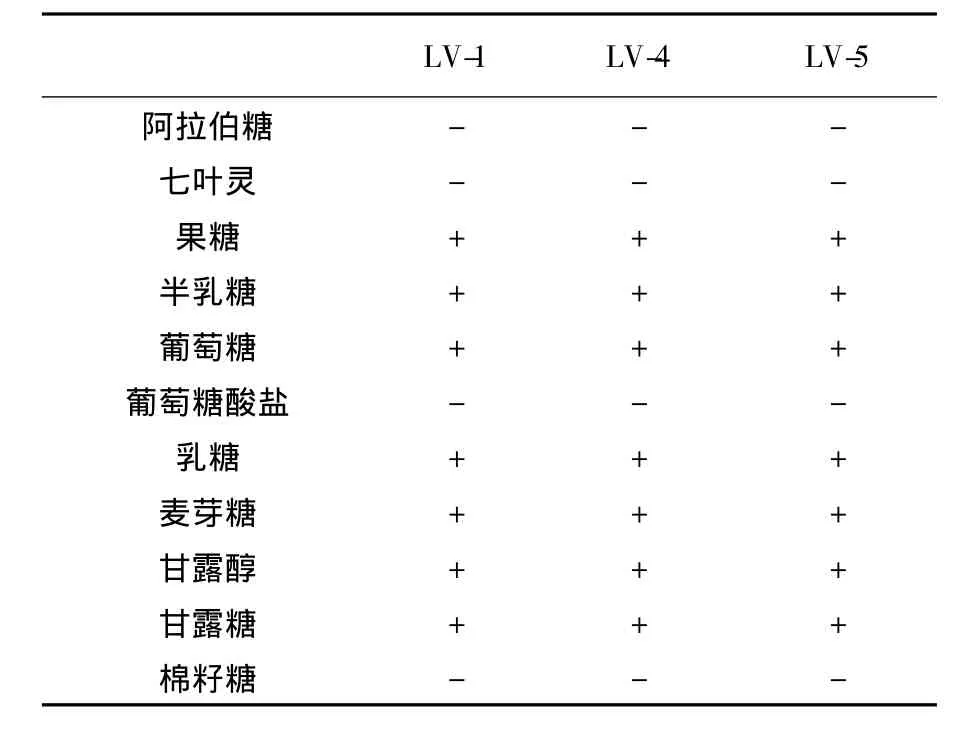
表4 生化试验结果Table 4 Result of biochemical identification of baculiform lactic acid bacteria
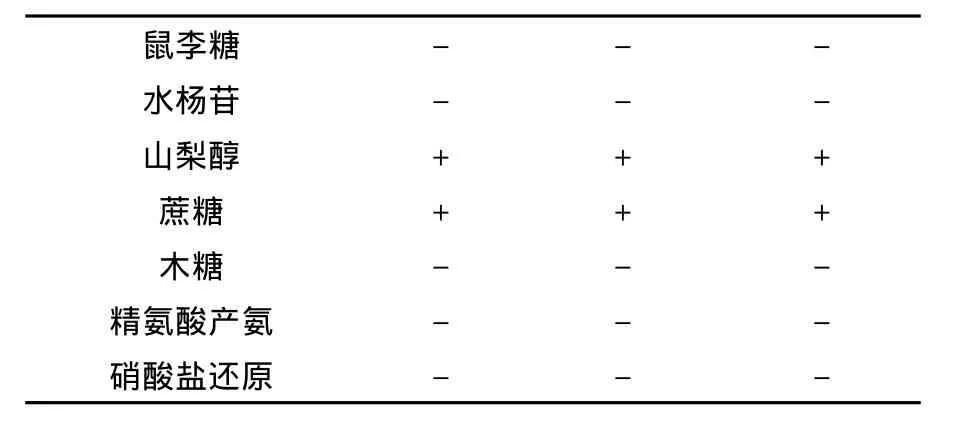
续表
2.2 16 S rRNA鉴定
2.2.1 分离乳酸菌的16S rRNA基因3株乳酸菌菌株提取DNA,利用乳酸菌16S rRNA通用引物PCR扩增,得到约1.5 kb大小的目的片段,扩增产物凝胶电泳结果见图3。

图3 乳酸菌16S rRNA基因扩增电泳图Fig.3 Electrophoretogram of lactic acid bacteria 16S rRNA gene
2.2.2 重组质粒电泳及PCR鉴定结果乳酸菌16S rRNA的扩增产物构建的重组质粒,在1%琼脂糖凝胶电泳检测,可见重组质粒大小为4.2 kb左右,以重组质粒为模板进行PCR鉴定,可见到1.5 kb的片段,重组质粒电泳及PCR鉴定结果见图4。
2.2.3 重组阳性质粒双酶切鉴定结果重组质粒用Bam HⅠ、HindⅢ进行双酶切,1%琼脂糖凝胶电泳,可见酶切后2条带大小与预期的2 692 bp和1 500 bp相符的片段,见图5。


图6 3个分离株16S rRNA与7个亚类代表序列构建的进化树Fig.6 16 S rRNA evolutionary tree of seven lactobacillus branch reference sequences and three isolated

图7 3个分离株16S rRNA与干酪乳杆菌类群8个代表序列构建的进化树Fig.7 16 S rRNA evolutionary tree of nine lactobacillus casei branch reference sequences and three isolated
2.3 16SrRNA序列同源性分析
根据LV-1、LV-4、LV-5的16S rRNA的测序结果,进行BLAST序列比对分析和系统进化树分析。采用MEGA4.0软件,分析3株分离菌和参比序列,绘制系统进化树(见图6、7)。3株分离菌与系统进化树远端的短乳杆菌分支群和德式乳杆菌分支群(见图6)的代表序列的同源性分别为89.64%、90.95%、90.77%和85.86%、86.33%、86.16%,表明分离菌与其遗传距离较远。3株菌与干酪乳杆菌类群L.casei ATCC 334的同源性分别为99.93%、100.00%、99.78%,均在99%以上,且处于同一分支,表明3株乳酸菌均属于干酪乳杆菌类群;3株分离菌与进化树远端的草乳杆菌(见图7)同源性分别为92.18%、92.16%、91.96%,表明分离菌与其遗传距离较远;与干酪乳杆菌的类干酪乳杆菌干酪亚种JCM 8130和类干酪乳杆菌坚韧亚种NBRC 15906处于同一分支,表明3株乳酸菌均为干酪乳杆菌的亚种。与类干酪乳杆菌干酪亚种JCM 8130的同源性为99.93%、100.00%、99.78%,均在99%以上,表明分离菌为干酪乳杆菌类群类干酪乳杆菌干酪亚种。
3 讨论
1986年,Kandier和Weiss提出根据葡萄糖发酵类型将乳杆菌属分为3个类群,即专性同型发酵群、兼性异型发酵群和专性异型发酵群。然而由于乳杆菌属对人和动物健康有多方面的益生作用,所以颇受人们关注,从不同生境分离到的菌株的多样性极其丰富。2007年6月之前报道的除去基原异名和同种异名之外,至少有130余个,其中马凯等[10]2007年将乳杆菌属分为12个分支群,具有特异性标签的有7个类群。根据最新的分类标准,3株分离菌属于干酪乳杆菌类群,类干酪乳杆菌干酪亚种。
Viili乳制品中含有乳酸乳球菌乳酸亚种、乳酸乳球菌乳脂亚种、乳酸乳球菌二乙酰乳酸亚种、肠膜明串球菌乳脂亚种和白地霉。这3株干酪乳杆菌的分离鉴定表明芬兰的Viili乳品在菌种构成上与我国的酸奶菌种组成有较大差异。干酪乳杆菌具有良好的耐酸及胆汁抗性,可降低血浆胆固醇,增强宿主对微生物病原体的非特异性抵抗力,加快清除肠道内病原体,治疗肠道菌群紊乱和增强肠道透性,从而防止食物过敏和急性腹泻。此外,干酪乳杆菌还可使抗低密度氧化脂抗体和淋巴细胞增加,使粒细胞的噬菌作用明显增强,对宿主进行免疫调节,防止肿瘤的产生。由于能够在人体肠道内稳定存活并具有众多的医疗保健功能,干酪乳杆菌作为益生菌被广泛应用于功能性食品,特别是乳制品的开发中,并逐渐为人们所关注。目前我国对干酪乳杆菌的研究还不多,因此可以将Viili中含有的某些菌株,应用到我国乳制品的开发中来,从而丰富我国的发酵乳制品菌种。
[1] Ruas-Madiedo P,Gueimonde M,de los Reyes-Gavilán CG,et al.Short communication:effect of exopolysaccharide isolated from"Viili"on the adhesion of probiotics and pathogens to intestinal mucus[J].Dairy Sci,2006,7(89):2355-2358.
[2]Kitazawa H,Yamaguchi T,Miura M,et al.B-cell mitogen produced by slime-forming,encapsulated Lactococcus lactis ssp.cremoris isolated from ropy sour milk,Viili[J].Dairy Sci,1993,6(76):1514-1519.
[3] 王勇,孙兴南,刘旭川,等.Viili中乳酸菌的初步分离和鉴定[J].安徽农业科学,2010,38(6):2831-2832,2853.
[4] 刘旭川,王勇,罗成,等.Viili中霉菌的分离纯化与鉴定[J].食品科学,2010,31(3):207-208.
[5] 郭兴华.益生乳酸细菌—分子生物学及生物技术[M].北京:科学出版社,2007:409-412.
[6] 凌代文.乳酸细菌分离鉴定及实验方法[M].北京:中国工业出版社,1999:3-15.
[7] 张以芳,夏凤毅,刘旭川.乳饼制品中乳杆菌分离鉴定及其发酵性能试验[J].中国乳品工业,1999,27(3):22-24.
[8] 布坎南RE,吉本斯RE.伯杰细菌鉴定手册(第8版)[M].北京:科学出版社,1986:797-820.
[9] Holt J.G.Manual of Determinative Bacteriology,9thED[M].Baltimore,williams&wilkins company,1994:980-1020.
[10] 马凯,李春玲,程池.Lactobacillus的系统发育分析及分群[J].食品与发酵工业,2007,33(2):27-35.
