超声斑点追踪成像技术对心内膜弹力纤维增生症患儿左心室短轴二维应变的研究
2012-01-12曲冉
曲 冉
任卫东1REN Weidong
刘 爽2LIU Shuang
肖杨杰1XIAO Yangjie
孙菲菲1SUN Feifei
超声斑点追踪成像技术对心内膜弹力纤维增生症患儿左心室短轴二维应变的研究
曲 冉1QU Ran
任卫东1REN Weidong
刘 爽2LIU Shuang
肖杨杰1XIAO Yangjie
孙菲菲1SUN Feifei
目的应用超声斑点追踪成像技术(STI)定量研究心内膜弹力纤维增生症(EFE)患儿左心室短轴各节段心肌的二维应变,探讨其变化规律。资料与方法23例EFE患儿取胸骨旁左心室短轴基底段、中间段和心尖段连续5个心动周期图像(3个平面显示左心室16节段)。应用QLab 8.1软件分析各短轴平面的整体应变峰值和各节段收缩期应变峰值。选择20例性别、年龄相匹配的健康体检者作为对照组。结果①EFE组心内膜增厚的部位集中在下壁(100%)、后壁(100%)、侧壁(87%),少数累及前壁(4%);②与对照组比较,EFE组左心室所有节段圆周应变峰值降低(P<0.01),11节段径向应变减低(P<0.05、P<0.01);EFE组左心室短轴3个平面整体应变明显降低(P<0.01);③EFE组内各平面下、后、侧壁心肌较其余各壁径向及圆周应变减低程度无显著差异。结论EFE患儿心内膜增厚呈非均匀性,EFE患儿左心室短轴整体及各节段收缩期圆周应变和多数节段的径向应变明显低于正常人,提示其左心室短轴收缩功能严重受损,且心肌的收缩功能呈非均匀弥漫性减低。
心内膜弹力纤维增生症;超声心动描记术,多普勒,彩色;斑点追踪成像;心室功能,左
心内膜弹力纤维增生症(endocardial fi broelastosis,EFE)是指心内膜出现弥漫性胶原和弹力纤维增生、心内膜增厚、心肌变性,造成心脏扩大和心力衰竭的病变。EFE多发生于婴幼儿,且发病越早,病情越重,预后越差。因此,全面评价EFE患者心脏整体与局部功能具有重要的临床意义。二维斑点追踪成像技术(speckle tracking imaging, STI)由于不受心脏整体运动及邻近节段的影响,可以准确评价整体及节段的功能[1],目前对EFE患者心脏整体及局部的研究较少,且对出现及未出现弹力增生节段的局部功能研究少见。因此,本研究旨在应用STI对EFE患者的左心室心肌短轴各平面整体及各节段收缩期峰值应变进行研究,评价其各节段心肌功能,为临床治疗及预后评价提供有价值的信息。
1 资料与方法
1.1 研究对象 2011-04~10于中国医科大学附属盛京医院诊断为EFE的患儿23例,男8例,女15例;平均(18.0±4.3)个月。本组病例符合1980年九省市心肌炎协作组修订的EFE诊断标准[2]及Ino等[3]提出的诊断标准:①早期发生心力衰竭;②无明显杂音或二尖瓣区有轻度收缩期杂音,为左心室扩大引起二尖瓣相对关闭不全所致;③X线显示心脏增大,以左心室为主,透视可见左心搏动减弱;④心电图显示左心室肥厚同时伴有V5~6 ST-T倒置或低平;⑤超声心动图检查显示左心室扩大,左心室壁运动减弱,心内膜增厚,厚度>2mm,回声增强;⑥排除其他心血管疾病。对照组为同期中国医科大学附属盛京医院20例健康体检者,其中男7例,女13例;平均(15.0±7.7)个月。经询问病史、体格检查、超声心动图及心电图检查排除心脏疾病。
1.2 仪器与方法 采用Philips iE33彩色多普勒超声诊断仪,S5-1探头,频率1~5MHz,帧频54帧/s。患者取左侧卧位,平静呼吸,连接心电图。常规心脏超声检查完毕后,采集胸骨旁左心室短轴基底段、中间段、心尖段连续5个心动周期图像。
1.3 图像分析 在QLab 8.1工作站分析中,选择图像对应切面,根据实际调整感兴趣区(ROI)曲线宽度和位置,使中间线位于心室壁心肌而宽度涵盖心内膜和外膜。运行软件后从3个平面得到16节段径向应变(RS)及圆周应变(CS)。以心电图R波起始作为左心室收缩期的开始,R-R间期为一个心动周期,记录曲线收缩期径向应变峰值及收缩期圆周应变峰值。取连续3个心动周期测值的平均值进行分析。
1.4 统计学方法 采用SPSS 17.0软件,计量资料数据以±s表示,两组间比较采用独立样本t检验;组内节段间应变比较采用单因素方差分析,两两比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况 EFE组心内膜增厚的部位集中在下壁(100%)、后壁(100%)、侧壁(87%),少数累及前壁(4%)。心内膜厚度为(2.63±0.52)mm。与对照组比较,EFE组左心室射血分数(LVEF)明显减低,差异有统计学意义(P<0.01);每搏量(SV)变化差异无统计学意义(P>0.05)。见表 1。
表1 对照组与EFE组左心室整体收缩功能参数(±s )
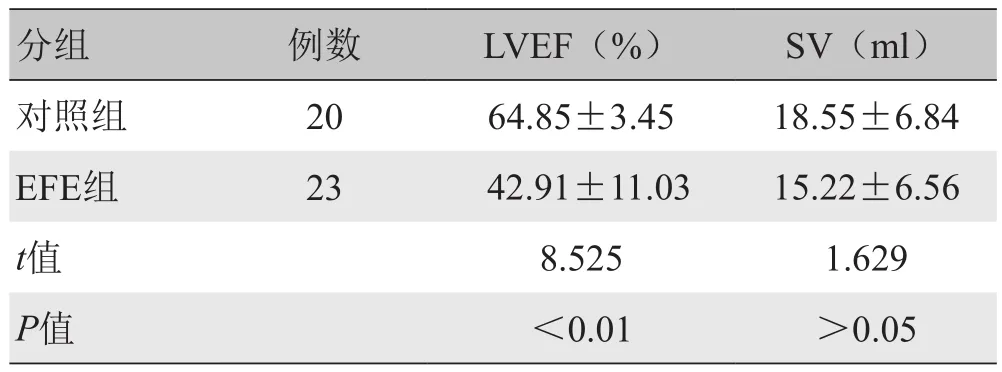
表1 对照组与EFE组左心室整体收缩功能参数(±s )
分组 例数 LVEF(%) SV(ml)对照组 20 64.85±3.45 18.55±6.84 EFE组 23 42.91±11.03 15.22±6.56 t值 8.525 1.629 P值 <0.01 >0.05
2.2 二维应变参数比较 EFE组RS减低,甚至出现倒置,曲线形态紊乱,达峰时间延迟(图1A)。对照组RS为向上的波形,各节段应变-时间曲线形态一致(图1B)。
EFE组CS减低,曲线形态紊乱,达峰时间延迟(图2A)。对照组CS为向下的波形,各节段应变-时间曲线形态一致(图2B)。
与对照组比较,EFE组除基底段前壁、侧壁、后间隔及心尖段前壁和间壁外,其余节段RS明显减低(P<0.05、P<0.01),所有节段 CS 均明显降低(P<0.01)。EFE组内各平面下、后、侧壁心肌较其余各壁径向及圆周应变减低的程度无明显区别。见表2。
2.3 左心室短轴基底段、中间段及心尖段整体应变对比 EFE组左心室短轴3个平面整体应变较对照组明显降低,差异有统计学意义(P<0.01、P<0.05)。见表3。
3 讨论
EFE是一种心内膜心肌病,存在心内膜增厚、胶原纤维及弹力纤维增生、心肌细胞变性坏死及间质增生等病理特征。Lurie[4]认为EFE不是一种独立的疾病,而是心脏面对应激刺激的反应性改变。EFE由于心肌弥漫性损害,使心肌纤维排列方向紊乱,破坏了心肌纤维肌束间的正常收缩构型,使左心室内血液不能有效地排空,最终导致左心室增大,左心室收缩功能降低[5]。每搏量反映舒张末期与收缩末期左心室容积的变化,因为心腔扩大,左心室舒张末期与收缩末期容积同时增大,所以每搏量可以正常。
超声心动图可实时、直观地排除其他心脏疾病,显示增生的心内膜,同时进行心功能评价,是临床诊断EFE最常用的影像学方法。本研究采用STI通过追踪心肌组织内的高回声斑点,可测量心脏短轴及长轴各节段的应变[6],实现了无角度依赖,同时可以很好地研究心尖段心肌的应变。STI测量结果与心脏MRI研究结果高度一致,对心肌运动评价可靠[7,8]。超声STI测量的二维应变和旋转角度与MRI的相关性优于组织多普勒基础上所测的应变[9]。因此,STI成为目前研究左心室心肌短轴和心尖段心肌运动的首选方法。
表2 对照组与EFE组各短轴平面各节段径向应变及圆周应变峰值比较(±s , %)

表2 对照组与EFE组各短轴平面各节段径向应变及圆周应变峰值比较(±s , %)
注:与对照组比较,(1)P<0.05,(2)P<0.01
?
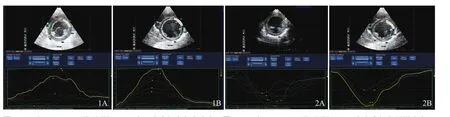
图1 EFE组(A)及正常对照组(B)左心室中间段径向应变。图2 EFE组(A)及正常对照组(B)左室中间段圆周应变
表3 对照组与EFE组各短轴平面整体径向应变与圆周应变峰值比较(±s , %)
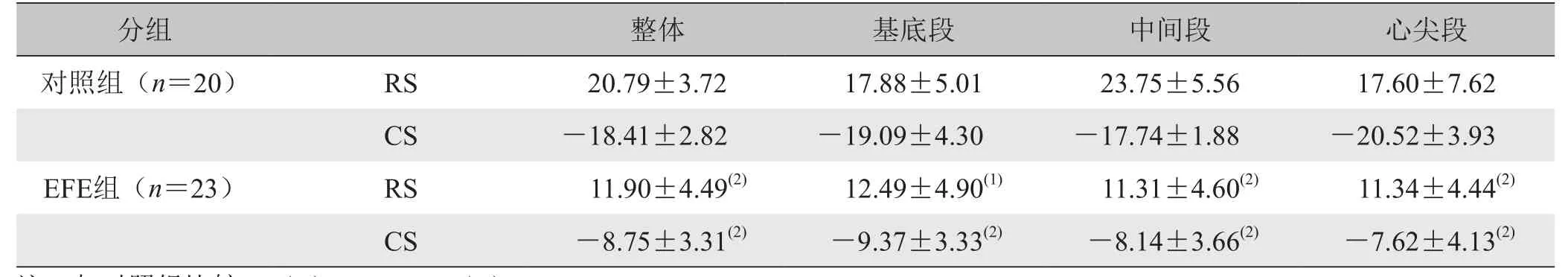
表3 对照组与EFE组各短轴平面整体径向应变与圆周应变峰值比较(±s , %)
注:与对照组比较,(1)P<0.05,(2)P<0.01
分组 整体 基底段 中间段 心尖段对照组(n=20) RS 20.79±3.72 17.88±5.01 23.75±5.56 17.60±7.62 CS-18.41±2.82-19.09±4.30-17.74±1.88-20.52±3.93 EFE组(n=23) RS 11.90±4.49(2) 12.49±4.90(1) 11.31±4.60(2) 11.34±4.44(2)CS -8.75±3.31(2) -9.37±3.33(2) -8.14±3.66(2) -7.62±4.13(2)
本研究中EFE患儿左心室短轴整体及各节段收缩期圆周应变和多数节段的径向应变明显低于正常人,提示其左心室短轴收缩功能严重受损,少数节段的径向应变与对照组相比无明显变化,提示EFE患儿左心室心肌变性对心室壁的影响是非均衡性的,因而心肌的收缩功能呈非均匀弥漫性减低。同时,本研究还发现EFE组心内膜增厚呈非均匀性,心内膜显著增厚的心肌短轴应变与同平面的其余各壁相比减低程度无明显差异,说明EFE心内膜增厚的程度不直接影响心肌的收缩功能。增生的心内膜胶原弹力纤维本身的病理学意义尚未达成普遍共识[4],部分学者认为这层组织直接影响心肌的运动,限制了心肌的收缩和舒张功能;另有学者认为其实际起到了防止心肌进一步扩张的保护作用[10],按此观点推测增厚的心内膜不会直接影响心肌的功能。本研究结果印证了后一种说法。
综上所述,STI依赖清晰的二维超声图像,在保证帧频及图像质量的基础上,STI能够精确地评价心室各节段的应变情况。这项新技术能够无创、简单、高效地评价EFE患儿左心室收缩功能,尤其是在评价其左心室短轴应变中具有较大的应用价值。
[1]Leitman M, Lysyansky P, Sidenko S, et al. Two-dimensional strain—a novel software for real-time quantitative echocardiographic assessment of myocardial function. J Am Soc Echocardiogr, 2004, 17(10): 1021-1029.
[2]李家宜. 病毒性心肌炎诊断依据参考. 中华儿科杂志,1981, 19(1): 62-63.
[3]Ino T, Benson LN, Freedom RM, et al. Natural history and prognostic risk factors in endocardial fi broelastosis. Am J Cardiol, 1988, 62(7): 431-434.
[4]Lurie PR. Changing concepts of endocardial fi broelastosis.Cardiol Young, 2010, 20(2): 115-123.
[5]童晓明, 曹培荣, 王华, 等. 超声心动图对心内膜弹力纤维增生症患儿血流动力学变化的分析研究. 中华超声影像学杂志 , 2000, 9(3): 170-172.
[6]王建华, 巩晓红, 张春东, 等. 超声斑点追踪成像技术评价正常人左室心肌周向收缩功能. 中国医学影像技术,2008, 24(10): 1597-1599.
[7]蒋大磊, 郑慧, 张新书, 等. 实时三平面定量组织速度成像与应变率成像技术评价高血压病左室舒张功能. 安徽医科大学学报, 2010, 45(2): 227-231.
[8]Amundsen BH, Helle-Valle T, Edvardsen T, et al.Noninvasive myocardial strain measurement by speckle tracking echocardiography: validation against sonomicrometry and tagged magnetic resonance imaging. J Am Coll Cardiol, 2006, 47(4): 789-793.
[9]Cho G Y, Chan J, Leano R, et al. Comparison of twodimensional speckle and tissue velocity based strain and validation with harmonic phase magnetic resonance imaging. Am J Cardiol, 2006, 97(11): 1661-1666.
[10]Black-Schaffer B. Infantile endocardial fibroelastosis: a suggested etiology. AMA Arch Pathol, 1957, 63(3): 281-306.
Short-axis Strain of Left Ventricle in Endocardial Fibroelastosis:Quantified by Speckle Tracking Imaging
PurposeTo quantify two-dimensional systolic strain of short axis in left ventricle (LV) in patients with endocardial fibroelastosis (EFE) using speckle tracking imaging (STI).Materials and MethodsEchocardiographic examinations were performed on 23 patients with EFE and 20 healthy subjects were recruited as controls. LV short-axis views of five consecutive cardiac cycles were obtained.QLab 8.1 was used to analyze global strains in basal, middle, and apical views, as well as systolic peak radial and circumferential strains in LV 16 segments. Results①Thickened endocardium of EFE mostly involved the inferior wall (100%),posterior wall (100%) and lateral wall (87%), with little chance to involve anterior wall (4%). ②Compared with the controls, peak of all segments of LV circumferential strain (P<0.01) and systolic peak radial strain in 11 of 16 segments (P<0.05,P<0.01)significantly reduced in EFE group. Overall strain in all three planes of short axis of LV also signi fi cantly reduced (P<0.01). ③ There was no signi fi cant difference of systolic peak radial and circumferential strains between the inferior, posterior and lateral segments and other segments in the same view.ConclusionEndocardial thickening of EFE children is non-uniformly where LV global strain, systolic peak circumferential strain in all segments and systolic peak radical strain in 11 of 16 segments signi fi cantly reduced in EFE children when compared with normal children,which indicates systolic function of LV short-axis in EFE children is severely impaired with non-uniformly diffuse reduction.
Endocardial fi broelastosis; Echocardiography, Doppler, color; Speckle tracking imaging; Ventricular function, left
10.3969/j.issn.1005-5185.2012.11.012
1. 中国医科大学附属盛京医院超声科辽宁沈阳 110004
2. 中国医科大学附属第一医院心功能科辽宁沈阳 110001
任卫东
Department of Ultrasound, Shengjing Hospital of China Medical University,Shenyang 110004, China
Address Correspondence to:REN WeidongE-mail: renshutang@yahoo.com.cn
辽宁省教育厅课题项目(L2010660,L2010667)。
中国图书资料分类法分类号R725.4;R445.1
2012-02-21
2012-08-21
中国医学影像学杂志2012年 第20卷 第11期:842-845
Chinese Journal of Medical Imaging 2012 Volume 20(11): 842-845
(责任编辑 张春辉)
