吸入糖皮质激素对哮喘大鼠气道重塑的影响
2012-01-11王淑娟
田 红 王淑娟 董 亮
(1.泰山医学院附属医院呼吸内科, 山东 泰安 271000;2. 浙江省中西医结合医院,杭州市职业病治疗中心职业病科,浙江 杭州 310003;3.山东大学齐鲁医院呼吸内科,山东 济南 250012)
哮喘是一种免疫功能异常导致的变态反应性疾病,早期气道重塑是支气管哮喘重要病理特征之一,损伤后的上皮细胞诱导成纤维细胞聚集和活化,转分化为表达具有收缩潜能和较强胶原合成能力的α-平滑肌动蛋白(α-SMA)的肌成纤维细胞,促进细胞外基质中I型胶原过度沉积;α-SMA和I型胶原的沉积促使管壁增厚和僵硬,因此二者被认为是早期气道重塑的重要指标[1]。本研究对大鼠哮喘模型予以布地奈德(BUD)干预治疗,了解糖皮质激素对气道重塑指标I型胶原和α-SMA的影响,从分子水平探讨糖皮质激素对哮喘大鼠气道重塑的干预作用,为糖皮质激素在哮喘中的应用提供理论依据。
1 材料与方法
1.1材料 健康Wistar大鼠(山东大学实验动物中心,SPF级)30只,IV级卵蛋白OVA购自Sigma公司,雾化吸入装置为德国勃林格殷格翰公司产品,Trizol 、oligo dT试剂购自 Invitrogen 公司,iQTM SYBR green real-time PCR kit 购自Bio-Rad公司,T-bet (62 kDa)、GATA-3 (50 kDa) 和 β-actin (43 kDa) 购自Santa Cruz Biotechnology公司,α-SMA免疫组化试剂盒购自北京中山生物公司,I型胶原的ELISA试剂盒购自上海西唐生物公司。
1.2哮喘模型的制备 随机将大鼠分为3组:正常对照组,OVA组即哮喘模型组和布地奈德组。哮喘大鼠模型制作按参考文献[2]稍加改进。OVA组:将卵清蛋白100 mg和Al(OH)3200 mg溶于生理盐水1 ml中新鲜配成凝胶,第1天和第8天在大鼠双侧胸部、腹股沟共4点各皮下注射0.1 ml,同时腹腔注射0.6 ml,共计1 ml进行致敏。连续7天将动物置于30 cm×24 cm×50 cm有机玻璃盒中,每次雾化5%OVA溶液30分钟进行激发,连续7天;布地奈德组:同上述方法致敏及激发,但每次激发前1小时雾化吸入布地奈德悬液4 mg/8ml(普米克令舒1 mg/2 ml Astra 公司)。正常对照组以等量生理盐水代替卵清蛋白/ Al(OH)3进行胸部、腹股沟注射和等时间雾化吸入,正常对照组、OVA组、布地奈德组分别在雾化后2 h后处死。
1.3免疫组化法检测肺内支气管α-SMA的表达水平 1.5%戊巴比妥按40 mg/kg麻醉大鼠后立即右心室插管,肺组织灌注4%甲醛, 固定24 h后切片,然后应用免疫组织化学法进行α-SMA染色,最后应用图象分析软件分析3组中α-SMA的单位面积累计光密度值(integrated optical density, IOD)。
1.4成纤维细胞的培养和分离 分别在无菌条件下,取3组大鼠肺组织,D-Hanks 液洗净血污,剪成1 mm3大小组织块,D-Hanks 漂洗,用弯头吸管吸取组织块,将其均匀摆置在50 ml培养瓶壁,加适量DMEM(含10% FBS),保持组织块湿润即可,放入37 ℃、5 %CO2培养箱,培养24 h后再补加培养液至适量,及时换液去除漂浮组织块和杂细胞。细胞生长成片后小心剔除肺组织块,加0.125 % 胰酶消化1~3 min,弃消化液,加DMEM 3~4 ml ,以弯嘴滴管吹打成细胞悬液,调整细胞浓度为1.5 ×105/ ml个接种于培养瓶,约3天传1 代,经过3~5 次传代后用于实验。
1.5ELISA测定肺内成纤维细胞中I型胶原表达水平 将各组成纤维细胞,通过按每孔加入200 μl蛋白裂解液提取蛋白,按照上海西唐生物公司提供试剂盒说明书检测 I 型胶原的含量。
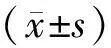
2 结 果
2.1大鼠造模成功的表现 以大鼠出现烦躁不安、活动频繁、呼吸急促、缩胸收腹,上肢抬起,以及大小便失禁等为诱喘成功的标志。
2.2肺内支气管α-SMA的表达水平(图1,表1) 经OVA刺激的大鼠OVA组中可见气道壁和肺组织内大量炎性细胞浸润等炎症反应的表现,同时可见肺组织增厚的肺泡间隔及肺内的成纤维细胞中存在大量被染成褐色α-SMA阳性免疫反应;正常对照组和布地奈德组中,可见α-SMA免疫反应信号呈阴性反应,未见到明显的炎症细胞和炎症反应的现象。OVA组肺中支气管的α-SMA的表达较正常对照组增强(P< 0.05),布地奈德组肺中支气管的α-SMA的表达较OVA组减弱(P< 0.05)。
2.3肺内成纤维细胞中I型胶原表达水平(表1) OVA组成纤维细胞中I型胶原含量高于正常对照组(P< 0.05),布地奈德组成纤维细胞中I型胶原含量低于OVA组(P< 0.05)。

表1 肺组织中 α-SMA和I型胶原的表达
注:*P<0.05 vs正常对照组,▲P<0.05 vs OVA组。
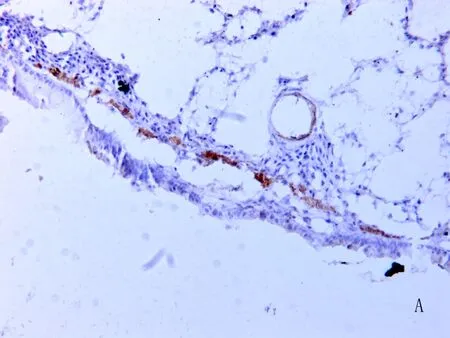
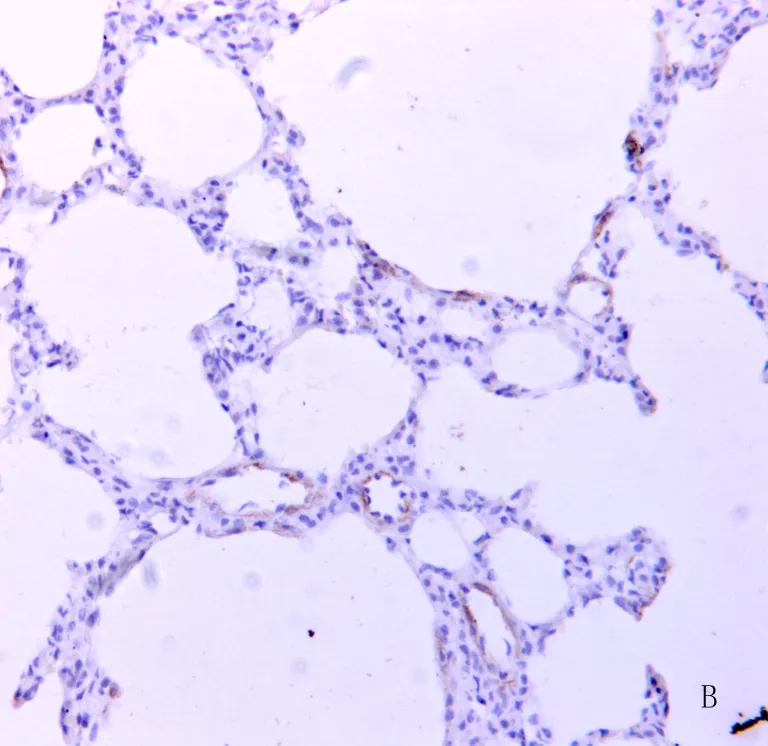

图1 肺组织中 α-SMA的表达 (×200)
图1A 正常对照组可见α-SMA免疫反应信号呈阴性反应 图1B 布地奈德组可见α-SMA免疫反应信号呈阴性反应 图 1C OVA组大鼠肺组织增厚的肺泡间隔中可见到大量 α-SMA免疫反应阳性以及大量的炎性细胞的浸润
3 讨 论
支气管哮喘是我国的常见病和多发病,以气道慢性炎症、气道高反应性和气道重塑为特点[3]。流行病学调查显示,我国的哮喘患病率正逐年增加,仅仅用气道炎症不足以解释哮喘的慢性进行性和难以根治性,因此,对于哮喘气道壁重塑的研究日益受到重视。气道重塑是支气管哮喘的重要病理特征之一,是上皮损伤和炎症反应所启动的多步骤效应,主要病理表现为气道粘膜组织中有大量炎性细胞浸润,以嗜酸性细胞为主;同时伴有气道粘膜管壁的增厚,包括气道平滑肌肥大引起的基底层增生,支气管壁增厚,管腔狭窄,平滑肌增厚等炎症表现[4],肺组织增厚的肺泡间隔及肺内成纤维细胞中可见α-平滑肌动蛋白大量增生,细胞外基质的改变表现为上皮下纤维化,胶原沉积等。嗜酸性粒细胞的激活使碱基蛋白等毒性物质释放,间接损伤上皮组织,上皮细胞能够迁移并聚集到上皮损伤的部位,表达基底细胞的抗原性,损伤后的上皮细胞能产生纤维连接蛋白(Fn)和TGF-β(transforming growth factor)[5],诱导上皮下成纤维细胞转分化为表达α-平滑肌动蛋白(α-SMA)的肌成纤维细胞聚集至组织损伤部位并增殖,产生I型胶原等导致纤维化,促使气道处于高反应状态[6]。同时α-SMA具有收缩潜能及较强胶原合成能力,促进细胞外基质中I型胶原过度沉积,进而形成纤维化,促进气道重塑形成。Roche等发现哮喘患者支气管平滑肌成纤维细胞数量明显增加,平滑肌成纤维细胞可促进胶原沉积导致上皮下纤维化[6]。有研究报道:用卵蛋白致敏仅有GATA-3高表达的小鼠(GATA-3-tg)后,TGF-β明显增多,导致平滑肌动蛋白增生和I型胶原过度沉积。因此,研究组织肺胶原和α-SMA含量的表达变化,可以估计气道重塑的程度[7]。
气道上皮受损后释放的细胞因子、炎性介质、生长因子等在哮喘抗炎作用中起重要作用,吸入糖皮质激素除通过调节炎症反应而对气道重塑产生间接影响外,体外实验还发现糖皮质激素对与重塑相关的细胞、生长因子以及细胞因子有直接作用,早期应用激素治疗能阻止气道上皮细胞的增殖,这可能是激素的抗炎效应通过避免炎性介质引起上皮细胞损伤实现的,而且吸入激素可下调气道上皮细胞表达炎性基因[8]。Naureckas等[9]在研究哮喘患者和正常人的肺泡灌洗液实验中发现,哮喘患者肺泡灌洗液中存在TGF-β1,另有研究表明哮喘时TGF-β1表达增高,而TGF-β1可导致多种基质蛋白的基因表达,吸入布地奈德可明显抑制大鼠气道TGF-β1的表达,推测布地奈德抑制细胞外基质(ECM)在气道沉积可能与其抑制TGF-β1在气道表达有关。另外对支气管肺组织的TGF-β检测结果发现激素干预具有明显的抑制作用,且主要是在细支气管上皮部位,相关性分析说明TGF-β蛋白表达与气道管壁增厚呈正相关。以上研究提示糖皮质激素影响气道重塑可能与抑制TGF-β1的表达有关,至少有部分作用,详细机制尚需进一步研究。
本试验研究了糖皮质激素对气道重塑指标α-平滑肌动蛋白(α-SMA)和I型胶原的影响,结果显示OVA组肺中支气管的α-SMA的表达较正常对照组增强(P< 0.05);布地奈德组肺中支气管的α-SMA的表达较OVA组减弱(P< 0.05);OVA组的成纤维细胞(LF)提取物中的I型胶原含量高于正常对照组(P<0.05) ;布地奈德组肺中支气管的I型胶原含量低于OVA组 (P< 0.05),证实布地奈德可降低α-SMA和I 型胶原的形成和聚集,可预防早期气道重塑的发生。
总之,支气管哮喘作为一种慢性气道炎性疾病, 气道重塑是哮喘患者的重要病理特征,α-平滑肌动蛋白(α-SMA)和I 型胶原是哮喘早期气道重塑的重要指标。气道炎症和气道重塑是支气管哮喘的两个重要病理改变,国内外有关哮喘的防治指南虽各不相同,但均强调对气道炎症的控制,而对气道重塑的防治涉及较少。尽管气道重塑与哮喘患者肺功能损害及气道高反应(AHR)密切相关,但其发生机制迄今尚未阐明,因此更深一步的研究哮喘气道重塑发生机制,采取相应的针对性治疗措施,对临床上治疗难治性、致死性哮喘,改善哮喘的愈后和转归,具有重要意义。同时对影响气道重塑的药物研究还不够深入,目前常用的哮喘治疗方案多强调对气道炎症的控制,而对气道重塑重视不够,相信随着对气道重塑的认识不断增加,一些更理想的治疗哮喘药物将会进一步得到研究开发。
[1] Davies DE, Wicks J, Powell RM,et al. Airway remodeling in asthma: new insights[J].J Allergy Clin Immunol,2003,111(2):215-225.
[2] Smith JJ,Loveren HV,Maarten O,et al.Therapeutic treatment with heat-killed Mycobacterium vaccae(SRL 172)in a mild and severe mouse model for allergic asthma[J].Eur J Pharmacol,2003,470(3):193-199.
[3] 欧阳海峰,倪殿涛,吴昌归.肺表面活性物质在哮喘大鼠气道重塑中的作用及机制[J].第四军医大学学报,2005,26(14):1297-1299.
[4] Chinpparn G,Gagliardo R,Siena A,et al.Airway remodeling in the pathogenesis of asthma[J].Curropin Allergy Clin Tourmal,2001,35(1),85-93.
[5] Niimi A,Matsumoto H,Minakuchi M,et al. Airway remodelling in Cough-variant asthmal[J].Lancet,2000,356:5642-5651.
[6] Bradding P, Brightling C. Mast cell infiltration of airway smooth muscle in asthma [J].Respir Med,2007,101(5):1045.
[7] Davies DE,Wicks J,Powel L,et al.Airway rmodeling in asthma:New insights[J].J Allery Clin Immunol,2003,111(2):215-225.
[8] Vanacker NJ, Palmans E, Kips JC,et al.Fluticasone inhibits but dose not reverse Allergen-induced.Structural airway change[J].Am J Respir Crit Care Med, 2001,163(3):L674-679.
[9] Naureckas ET, Ndukwu IM,Halagko AJ, et al.Bronchoalveclar lavage fluid from asthmatic subjects is milogenic for human airway smooth muscle[J].Am J Repir Crit Care Med, 1999,160(6):2062-2066.
