醇水混合体系中藏花素褪色的动力学反应及机理研究
2012-01-11张生万李梅冯彦琳
张生万,李梅,冯彦琳
(1.山西大学 生命科学学院,山西 太原 030006;2.山西大学 化学化工学院,山西 太原 030006)
醇水混合体系中藏花素褪色的动力学反应及机理研究
张生万1,李梅1,冯彦琳2
(1.山西大学 生命科学学院,山西 太原 030006;2.山西大学 化学化工学院,山西 太原 030006)
从成熟的植物栀子果实中提取分离得到藏花素(1),采用半合成法制得藏红花酸二乙酯(2).利用紫外光谱研究了醇水混合体系中藏花素在紫外光照和自然光照下褪色的动力学反应,利用电子自旋共振技术研究了藏花素褪色过程中的自由基种类,利用气相色谱/质谱联用对藏红花酸二乙酯的褪色产物进行了结构推断.结果表明:藏花素的褪色反应遵循动力学一级反应,反应速率常数随醇/水混合体系中乙醇含量的增加而减少,且紫外光照下比自然光照下减小的更快;单线态氧和超氧阴离子参与了藏花素的褪色反应.其褪色原因主要是共轭双键被氧化加成和酯键水解光催化重排所致.最后,提出了藏花素褪色反应的可能途径.
藏花素;藏红花酸二乙酯;动力学一级反应;褪色机理;气-质联用
藏花素是从茜草科植物栀子(GardeniajasminoidesEllis)果实中提取出的一种天然色素[1],是由藏红花酸与龙胆二糖或葡萄糖以糖苷键相连而成的一类水溶性类胡萝卜素,因具有很好的水溶性、着色力、耐热性以及受p H值、金属离子和常用食品添加剂影响小等优点,被广泛应用于食品与饮料行业[2-3].近年研究也表明,藏花素不仅具有抗癌、降血脂、抑制肿瘤、消炎、保护神经中枢的作用,还具有增强免疫力、保护肝脏、抗氧化等功能[4-6].但由于其易氧化和耐光性差[2-3],容易发生褪色反应.目前,对藏花素的研究主要集中在提取、精制、稳定性及药理作用等方面,对于题示内容的研究少见报导.
本实验从栀子果中分离得到纯的藏花素(1),并用半合成法制得藏红花酸二乙酯(2),合成反应式如图1所示.实验对紫外光照和自然光照下水、乙醇和醇水混合体系中藏花素褪色的动力学反应进行了研究,并以藏红花酸二乙酯作为藏花素的模型化合物对其褪色产物进行了气相色谱质谱分析,对藏花素的褪色机理进行了探讨,旨在从根本上了解藏花素的褪色原因,为使藏花素的合理使用起到一定的指导作用.

图1 半合成法制备藏红花酸二乙酯的合成反应式Fig.1 Synthetic reaction of diethyl ester of crocetin prepared by semi-synthesized method
1 实验部分
1.1 实验仪器与试剂
Bruker DRX-300 MHz核磁共振仪(德国Bruker公司);UV 2550紫外可见光谱仪(日本Shimadzu公司);Nicolet 380傅立叶变换红外光谱仪(美国Thermo Electron公司);HP 5890/5988A气相色谱质谱联用仪(美国惠普公司);Brucker ESR 300E电子自旋共振波谱仪(德国Bruker公司).
实验用水为双蒸馏水,试剂均为分析纯.
1.2 仪器测定条件
1.2.1 UV-Vis测定条件
被测样品在25℃恒温,扫描速率为600 nm/min,扫描范围为200~700 nm.
1.2.2 ESR测定条件
微波功率5.05 m W;微波频率9.83 GHz;扫场宽度200.0 G;中心磁场3 486.7 G.
1.2.3 GC/MS测定条件
色谱柱:OV-101毛细管柱(25 m×0.25 mm,0.25μm);升温程序:60℃保持2 min,以5℃/min升至180℃;载气(He)流速1.2 m L/min;进样口温度280℃;离子源温度180℃;电离电压70 e V;进样量2μL.
1.3 方法
1.3.1 藏花素(1)的提取纯化
将干燥的栀子果破碎后,用水浸、加热至沸后过滤.滤液经减压蒸干水分,残留物用乙醇提取.蒸干乙醇后,残留物经四氢呋喃进一步纯化,得黄色粉末.
1.3.2 藏红花酸二乙酯(2)的制备
取1.3.1适量黄色粉末加水溶解,再加入少量盐酸,置于58℃水浴中加热30 min,反应液冷却至室温后,用二氯甲烷多次萃取,合并有机相,并蒸干溶剂得黄色粉末.再加入适量无水乙醇,待黄色粉末溶解后加入少量浓硫酸,摇匀后于暗处过夜,用正庚烷多次萃取,合并正庚烷层,蒸干溶剂得黄色结晶.
1.3.3 藏花素(1)褪色的动力学研究
分别配制乙醇体积分数为0.00、0.28、0.38、0.50的5×10-4mol·dm-3藏花素醇水混合溶液,用NaOH溶液或稀H2SO4调节其p H至中性.每份溶液等分3份,1份紫外光照,1份自然光照,1份暗存.按1.2.1条件每隔一段时间测定1次溶液的紫外可见光谱.
1.3.4 藏花素(1)褪色的ESR研究
分别加入少量的DMPO和TMP于5×10-5mol·dm-3藏花素水溶液和乙醇溶液中,摇匀后置于距离紫外灯30 cm处进行照射.按1.2.2条件每隔一段时间在Quanta-Ray Nd:YAG脉冲(10 pulses/s)激光系统(λ=320 nm)下检测反应液中自旋加合物的ESR信号.
1.3.5 藏花素模型化合物及褪色产物的GC/MS研究
将藏红花酸二乙酯(2)乙醇/水混合溶液等分成两份,1份避光存放10 d,另1份紫外光照2 h.蒸干溶剂,残留物用少量甲醇溶解,按1.2.3条件进行分析.
1.3.6 藏花素模型化合物光照前后紫外光谱分析
将藏红花酸二乙酯(2)乙醇/水混合溶液等分成两份,按1.2.1条件,1份直接测定,另1份紫外光照2 h后测定.
2 结果与讨论
2.1 结构鉴定


2.2 醇水混合体系中藏花素(1)褪色的动力学研究
按1.2.1条件进行测定紫外光照不同时间的藏花素水溶液和乙醇溶液,结果如图2所示.
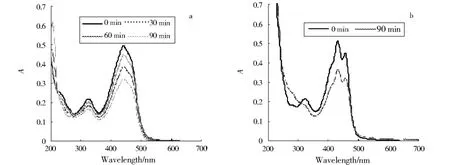
图2 25℃时不同溶剂中藏花素随紫外光照时间的紫外可见光谱变化:(a)水溶液(b)乙醇溶液Fig.2 Variation in UV/Vis spectra of crocin with UV irradiation time in different media at 25℃:(a)In water;(b)In ethanol
由图2a可以看出,随着紫外光照射时间的增加,藏花素水溶液在441 nm(λmax)处的吸光度值迅速减小.而由图2b可以看出藏花素乙醇溶液在431 nm(λmax)处的吸光度值变化较水溶液中慢.
当温度为25℃、p H=7.0时,乙醇/水混合体系(乙醇体积分数分别为0.00、0.28、0.38、0.50)中藏花素在紫外光照下褪色的动力学研究以ln(A0/A)对紫外光照时间t作图,结果如图3所示.
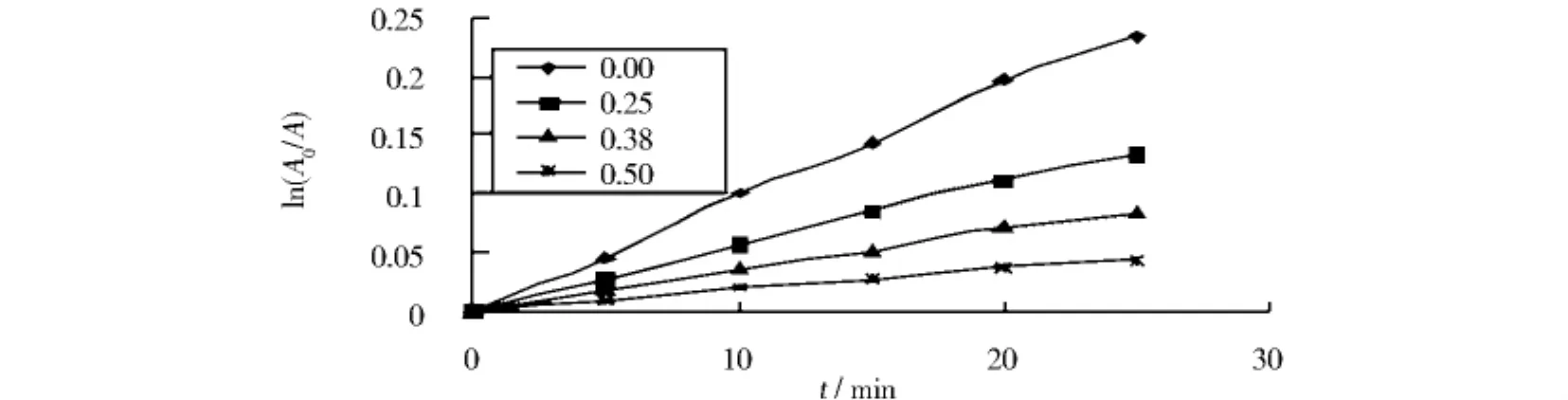
图3 25℃紫外光照下不同乙醇含量的醇/水混合溶剂中藏花素褪色的动力学反应图Fig.3 Kinetic reaction of fading plots for crocin in different ethanol/water mixed media at 25℃ by UV irradiation
由图3可知,ln(A0/A)对时间t作图得一直线,斜率大于0,由此可知藏花素在紫外光照下的褪色反应遵循动力学一级反应.藏花素在自然光照和暗存(包括50℃、-10℃)下褪色的动力学反应同样得到良好的线性关系,说明藏花素在自然光照和暗存下的褪色反应也遵循动力学一级反应.上述所有条件下藏花素褪色的速率常数(k)和半衰期(t1/2)见表1.

表1 不同条件下醇/水混合溶剂中藏花素发生褪色反应的速率常数和半衰期Table 1 Rate constants and half-life periods for crocin fading in various mixed ethanol/water solvents under different conditions
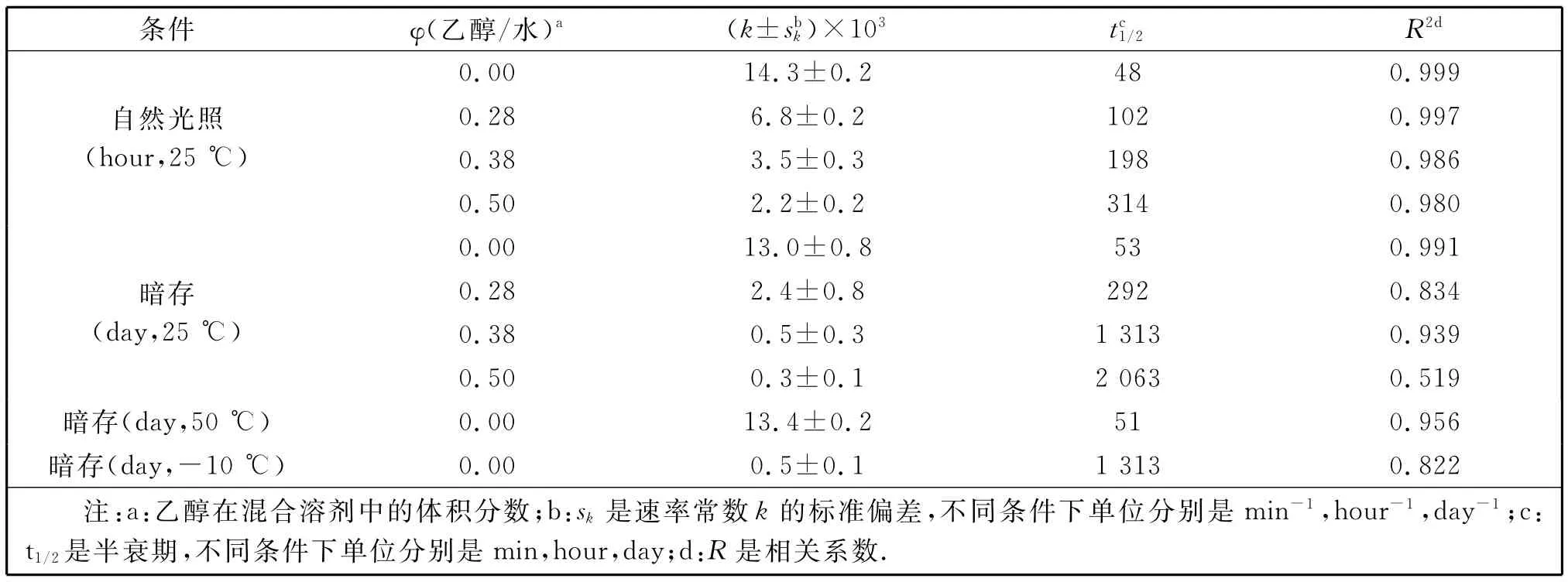
续表1 不同条件下醇/水混合溶剂中藏花素发生褪色反应的速率常数和半衰期Continue Table 1 Rate constants and half-life periods for crocin fading in various mixed ethanol/water solvents under different conditions
从表1可以看出,紫外光照下醇/水混合溶剂中藏花素褪色的速率常数k随乙醇含量的增加而迅速减小;但自然光照下藏花素的褪色速率比紫外光照下慢得多.同时,在避光甚至高温(50℃)环境下藏花素的褪色速率也相当慢.由此说明藏花素的褪色反应是一个典型的光催化反应.
2.3 藏花素(1)可能的褪色机理研究
2.3.1 利用ESR技术研究藏花素(1)光褪色过程中可能产生的自由基种类
实验1.3.4选择DMPO和TMP作为两种自旋捕获剂,按1.2.2条件考察了藏花素在紫外光照下可能产生的自由基种类.结果显示不仅有DMPO-O2·-自旋加合物的强特征信号[6条超精细谱线,超精细耦合常数αN=13.627 G(水中),αH=8.150 G(乙醇中)],还有TMP-1O2自旋加合物的信号(3条谱线,αN=
β16.502 G).同时这些信号随着紫外光照时间的增加而增强.由此推测,藏花素在光褪色过程中形成了和1O2.然而,整个体系中并没有提供生成1O2所需的光敏剂和能源.一个可能的解释是紫外光照下藏花素自身作为光敏剂,吸收光子后跃迁至单重激发态1S,然后弛豫到三重激发态3S,与氧分子发生两种作用:一种是与基态氧发生能量转移,产生1O;另一种是与基态氧发生单电子转移,生成超氧阴离子自由基
2
2.3.2 藏花素模型化合物褪色产物的GC/MS分析结果
按1.3.5节方法,藏红花酸二乙酯溶液经紫外光照2 h后按1.2.3条件进行测定,所得总离子流色谱(TIC)和质谱(MS)(图4)所示.

图4 藏红花酸二乙酯醇/水混合溶液紫外光照2h后降解产物的TIC谱(A)和MS谱(B)图Fig.4 TIC spectra(A)and MS spectra(B)of diethyl ester of crocetin in the UV irradiation for 2 hours in the ethanol/water mixed media
由图4A可以看出,保留时间为11.108 min时出现了一个峰,说明该物质为藏红花酸二乙酯的光照褪色产物,同时由图4B可知其分子离子(M+.)峰的m/z为344,主要碎片离子峰的m/z为326、280、252、207及192,经质谱解析,该物可能的结构式为(3)式,其裂解过程如图5.
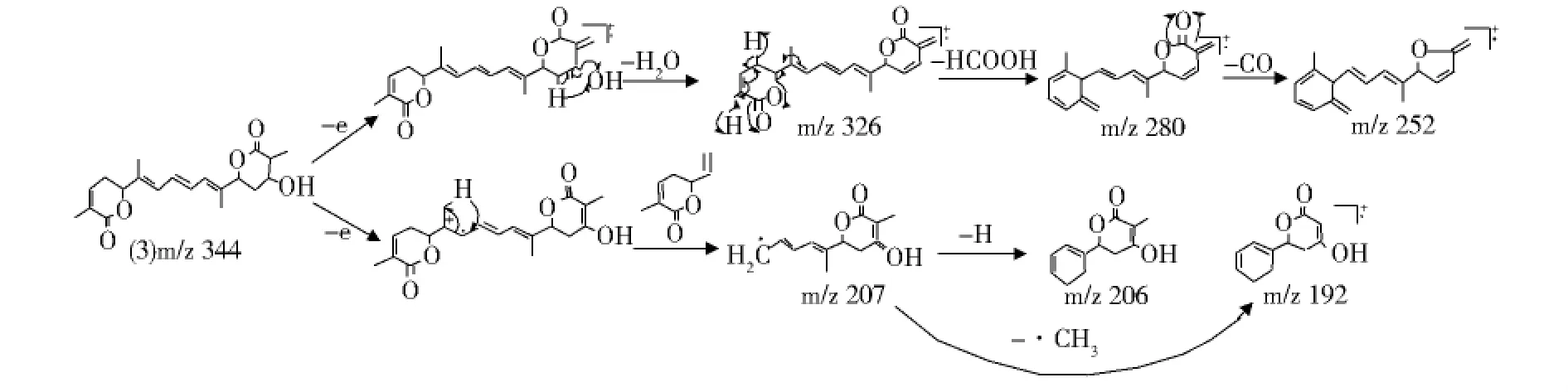
图5 藏红花酸二乙酯光照褪色产物的质谱裂解行为Fig.5 Mass spectrometric analysis of photofading product of diethyl ester of crocetin
2.3.3 藏花素模型化合物光照前后紫外光谱分析结果
按1.3.6节方法,对藏红花酸二乙酯溶液光照前后进行光谱扫描,结果如图6所示.
由图6b可知,藏红花酸二乙酯光照后,400~500 nm处的吸收消失,并在260.5 nm处出现吸收,表明其褪色产物发色团最多只可能有三个双键共轭.对结构(3)式用Woodward规则[9]进行计算,其K带最大吸收波长为262 nm,紫外光谱计算结果与实验值(260.5 nm)非常吻合,表明紫外光谱测定藏红花酸二乙酯光解产物结构得到与质谱解析相同的结论.
2.3.4 藏花素模型化合物避光存放降解产物的GC/MS分析结果
按1.3.5节条件,藏红花酸二乙酯溶液避光存放10 d后,按1.2.3条件测定,所得总离子流色谱 (TIC)图和质谱数据如图7和表2所示.
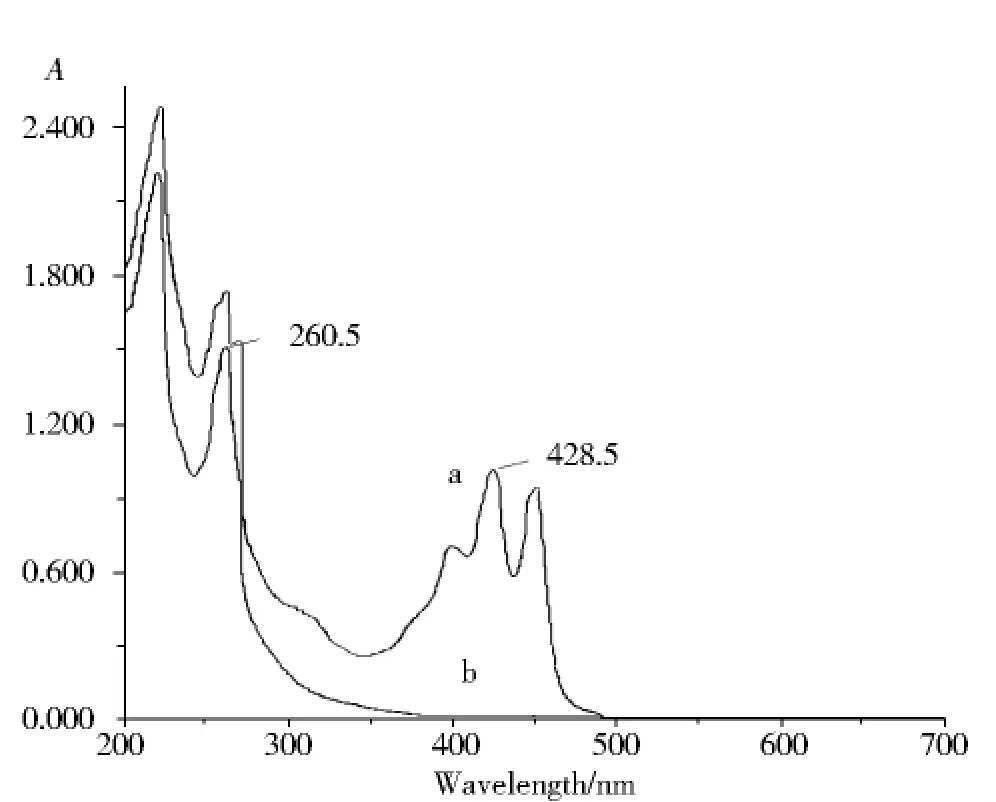
图6 藏红花酸二乙酯光照前后的吸收光谱:(a)光照前(b)光照后Fig.6 UV-Vis spectra of diethyl ester of crocetin and its fading product:(a)before light;(b)after light
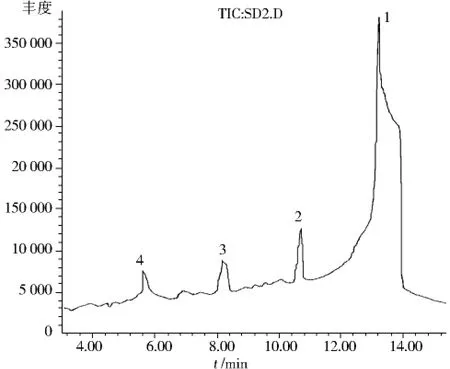
图7 藏红花酸二乙酯醇/水混合溶液避光存放10 d的TIC图Fig.7 TIC spectra of diethyl ester of crocetin without light for 10 days in the ethanol/water mixed media

表2 藏花素模型化合物避光存放10天降解产物的GC/MS分析结果Table 2 GC/MS spectra results of crocin model compound without light for 10 days in the ethanol/water solvent
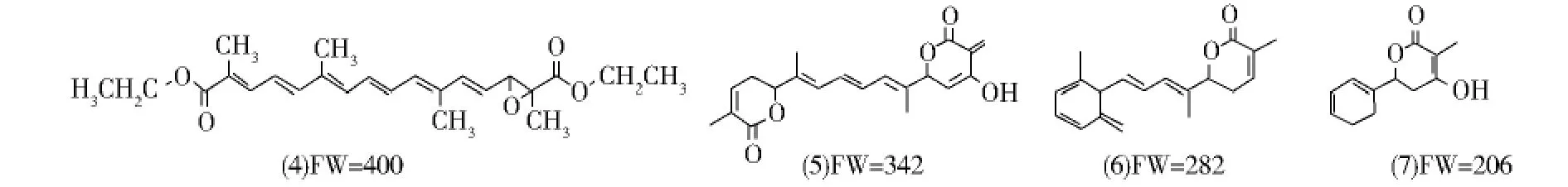
由图7和表2数据可知,避光存放主要有4种降解产物,组分1含量最高,其保留时间为13.554 min,M+.峰的m/z为400,主要碎片离子m/z为355、327、282、206等.经质谱解析,该物可能为藏红花酸二乙酯的氧化加成产物,其氧化加成可能发生在如(4)式所示的2-3碳的双键上,也可能发生在4-5碳或者其它双键上;组分2保留时间为10.609 min,其 M+.峰的 m/z为342,主要碎片离子 m/z为326、282、206、192等,经质谱解析,该物可能为组分1水解成二酸后的重排产物,其结构如(5)式所示;组分3保留时间为8.122 min,其M+.峰的m/z为282,主要碎片离子m/z为206、142等,经质谱解析,该物可能为藏红花酸二乙酯水解成二酸后的脱羧(去一分子羧基)重排产物,其结构如(6)式所示;组分4保留时间为5.570 min,其M+.峰的m/z为206,该物可能为藏红花酸二乙酯水解成二酸后6-7碳双键被氧化分解的产物,其结构如(7)式所示.
2.3.5 藏花素的褪色机理
综上所述,根据藏红花酸二乙酯褪色产物结构及其介质极性增加(乙醇浓度减小)水解速率加快的实验事实,不难推测其褪色原因主要是双键被氧化加成和酯键水解光催化重排共轭体系受损所致.即分子中双键被1O2或O·-
2氧化加成,形成环氧加合物,使共轭体系受损而褪色.另外,在醇水体系中,酯键也易发生水解,水解成酸后,在光催化下,极易发生顺-反异构化反应,重排形成稳定的六元环内酯,使其共轭程度减小而褪色.同时也表明,避光存放褪色主要以氧化加成为主,在非避光情况下,主要以酯键水解光催化重排为主.并且,氧化加成可能发生在水解前也可能发生在水解后,并可能在共轭体系的任一双键上发生.
任何有色物质的色泽以及褪色行为主要决定于其发色团结构[9-10].而藏花素与藏红花酸二乙酯的长链共轭二酸(发色团)结构完全相同,故用藏红花酸二乙酯作为藏花素的模型化合物来研究其褪色行为完全合理.由上述藏红花酸二乙酯褪色产物的结构及其行为,可推测藏花素的褪色机理如图8所示.

图8 藏花素可能的褪色机理Fig.8 Possible fading mechanism of crocin
3 结论
在醇水体系中藏花素的褪色反应属于动力学一级反应.其褪色原因是共轭双键被氧化加成和酯键水解光催化重排所致.参与藏花素褪色反应的氧为单线态氧1O2和超氧阴离子O·-2,由于氧化加成和异构化重排反应不可逆,故藏花素的褪色反应也是不可逆的.另外,乙醇浓度增加能够降低藏花素的褪色速率,原因可能是水溶液中乙醇含量的增加不仅能减小藏花素的水解速率,还能增加溶液中单线态氧的寿命.这两种可能都有助于抑制藏花素的褪色反应,故藏花素可作为酒精类饮料的一种很好的着色剂.
[1]蒋志国,陈文学,刘四新,等.低速逆流色谱分离制备栀子黄色素中的藏花素[J].色谱,2011,29(3):277-280.
[2]邱斌,陈卫平,王青.栀子黄色素稳定性研究[J].食品研究与开发,2009,9(30):190-192.
[3]艾志录,张晓宇,乔明武,等.天然食用色素栀子黄的应用特性研究[J].食品工业科技,2003,12(24):69-73.
[4]Nam Kyong-Nyon,Park Young-Min,Jung Hoon-Ji,etal.Anti-inflammatory Effects of Crocin and Crocetin in Rat Brain Microglial Cells[J].EuropeanJournalofPharmacology,2010,648(1-3):110-116.
[5]Khajuria Deepak-Kumar,Asad Mohammed,Asdaq Syed M B,etal.The Potency of Crocus Sativus(Saffron)and Its Constituent Crocin as an Immunomodulator in Animals[J].LatinAmericanJournalofPharmacy,2010,29(5):713-718.
[6]Mohajeri Seyed Ahmad,Hosseinzadeh Hossein,Keyhanfar Fariborz,etal.Antioxidant Activity of Aqueous and Ethanolic Extracts of Crocus Sativus L.Stigma and its Bioactive Constituents,Crocin and Safranal[J].PharmacognosyMagazine,2009,5(20):419-424.
[7]Petros A Tarantilis,Abdelilah Beljebbar,Michel Manfait,etal.FT-IR,FT-Raman Spectroscopic Study of Carotenoids from Saffron(Crocus sativus L.)and some Derivatives[J].SpectrochimicaActaPartA,1998,54:651-657.
[8]马礼敦.高等结构分析[M].上海:复旦大学出版社,2003:124.
[9]常建华,董绮功.波谱原理及解析[M].北京:科学出版社,2001:41-46.
[10]邢其毅,徐瑞秋,周政,等.基础有机化学:下册[M].2版.北京:高等教育出版社,2001:822-824.
Photofading Kinetics and Mechanism of Crocins in Ethanol/Water Mixed Media
ZHANG Sheng-wan1,LI Mei1,FENG Yan-lin2
(1.SchoolofLifeScience,ShanxiUniversity,Taiyuan030006,China;2.SchoolofChemistryandChemicalEngineering,ShanxiUniversity,Taiyuan030006,China)
A crocin(1),which is digentiobiosyl ester of crocetin,was extracted and isolated selectively from the matured fruits of Gardenia jasminoides.A diethyl ester of crocetin(2)was prepared by semi-synthesized method.Photofading kinetic reaction of crocin in ethanol/water mixed systems was studied by UV irradiation and natural light vis UV spectra.The radical species of crocin’s fading process was studied by electron spin resonance(ESR)technique.The fading product of diethyl ester of crocetin was studied by gas chromatography-mass spectrometry(GC/MS).The results showed that fading reaction of crocin was first-order kinetic reaction.The rate constants decreased with the content of ethanol increasing in ethanol aqueous solution.Furthermore,the rate of this reaction became much more rapidly in the condition of UV irradiation compared with natural light.Singlet oxygen and superoxide anion were both trapped by the ESR technique in the process of fading reaction.The fading phenomenon of crocin is mainly caused by oxidative addition happened to conjugated double bond,ester hydrolysis and photocatalyzing cis-trans isomerization rearrangement reaction and the possible pathway of this reaction is analyzed.
crocin;diethyl ester of crocetin;kinetic first-order reaction;photofading mechanism;gas chromatography-mass spectrometry(GC/MS)
TS202. 3;O643
A
0253-2395(2012)02-0410-07*
2011-12- 06;
2012-02-11
山西省回国留学人员科研项目(2009002)
张生万(1955-),男,山西盂县人,教授,研究方向为食品科学、化学计量学、药物合成.E-mail:zswan@sxu.edu.cn
