致奶牛恶性水肿腐败梭菌的分离鉴定
2012-01-11张小燕王静梅孙延明剡根强
张小燕,王静梅,孙延明,剡根强
(石河子大学动物科技学院,石河子832003)
恶性水肿(malignat edema)是由腐败梭菌为主的多种梭菌引起的家畜的一种急性传染病。其特征性病变为创伤局部发生急剧炎性水肿,并伴有发热和全身毒血症。该菌为严格厌氧菌,在肝脏表面触片的标本中,该菌呈长丝状或长链状,在组织内则呈长短不一的粗大杆状菌;培养物涂片染色镜检为单个、成双或短链状,芽胞呈卵圆形,位于菌体中央或近端,略宽于菌体,有周围鞭毛,能运动,无荚膜[1]。
腐败梭菌引起的疾病国内外均有报道,国外在人的感染方面报道较多[2-4],主要集中表现在对毒素和疫苗的研究[5];虽然国内也有对腐败梭菌毒素相关的研究,但是对于动物腐败梭菌的研究较少,目前,我国还没有利用腐败梭菌的16SrRNA设计引物进行PCR鉴定的相关报道。
本研究对石河子地区某牛场死亡12h的病牛肝脏组织进行触片染色镜检、病原的分离鉴定、分子生物学检测及动物感染,并对分离株某些生物学特性进行检测,旨在为今后该病的实验室诊断建立实用的方法提供依据。
1 材料与方法
1.1 材料
1.1.1 病料来源与采集
2009-2010年石河子某规模化奶牛场连续2年发生奶牛产前和产后急性死亡,先后死亡11头3-4岁高产奶牛,患牛均有外伤史,临床表现体温升高41.0~41.5℃,厌食,阴门周围组织高度肿胀,呈暗红色至褐色,压之凹陷柔软。切开病变部位流出红褐色透明渗出物,并很快成胶胨状,病牛多于出现症状后几小时至3d死亡,经现场诊断,疑为恶性水肿。采取死亡时间在12h内发病牛的肝脏组织。
1.1.2 培养基
葡萄糖胰酶消化培养基、血琼脂培养基、厌氧糖发酵培养基、卵磷脂培养基、石蕊牛乳培养基、厌氧吲哚培养基、明胶培养基的配制及操作方法参照文献[6-7]。
1.1.3 引物
根据GenBank登录号为JF733419的腐败梭菌16SrRNA序列,用Primer premier 5.0软件设计1对引物:
上游引物,5′-AACACATGCAAGTCGAGCGA-3′;下游引物,5′-TCGCCACCTACGTATTACCG-3′。引物由北京华大生物工程有限公司合成。
1.1.4 实验动物
健康昆明系清洁级小鼠12只(15~20g),购自石河子大学实验动物中心;健康英国花色毛系普通级豚鼠6只(25~30g)购自新疆医科大学实验动物中心。
1.1.5 主要试剂
PCR产物纯化试剂盒购自大连宝生物工程有限 公 司,Taq DNA 聚 合 酶 (5U/μL)、Marker DL2000、dNTP(2.5mmol)均购自广东东盛生物科技有限公司,PMD19-T连接试剂盒购自Takara公司。
1.2 方法
1.2.1 涂片染色镜检
对发病牛场病死牛肝表面触片后经瑞特氏染色镜检。
1.2.2 分离培养
无菌采取肝脏组织,将其接种到新配置的葡萄糖胰酶消化厌氧肉干汤液体培养基中,37℃厌氧培养24-48h后,将培养物再次接种到血平板,采用焦性没食子酸厌氧法,放入温箱中37℃培养48h,观察菌落生长情况,菌落形态以及是否溶血,挑取典型的单个菌落转接于血琼脂上厌氧培养进行纯化[8],保存备用。
1.2.3 分离菌生化鉴定
分离菌的生化鉴定按厌氧菌的方法进行,参照参考文献[6]中的方法。
1.2.4 分离菌的PCR鉴定及克隆测序
挑取分离株典型菌落接种于液体培养基,厌氧培养24h,提取细菌总DNA。基因组DNA的提取参照文献[9]中方法,并略加改进。PCR反应体系(25.0μL)10×Buffer 2.5μL,DNTP 0.5μL,10μmol/L上下游引物各1.0μL,Taq DNA聚合酶0.5μL,模板DNA 2.0μL,剩余加无菌双蒸水。反应条件:94℃预变性4min;94℃ 变性30s;53.1℃退火30s;72℃延伸30s;共30个循环,72℃延伸7min,PCR产物短时间内4℃保存。
取PCR扩增的反应产物5.0μL,加到含EB的1.5%的琼脂糖胶中,在80V电压下电泳30min,然后在凝胶成像系统下观察。
将扩增的PCR产物用UNIQ-10柱式DNA胶回收试剖盒回收,回收产物与pMD19-T载体连接,后转化到E.coli DH5α感受态37℃ 过夜培养,挑取单个菌落,采用菌落PCR方法进行阳性鉴定,参照文献[10]中的方法,并略加改进。
挑取阳性菌落在含有Amp的LB肉汤中培养,后送往北京华大生物工程有限公司,对腐败梭菌的扩增片段进行测序。采用DNAMAN软件分析序列,并与GenBank上登录的的腐败梭菌(序列号为JF733419)进行同源性比较。
1.2.5 动物实验
将临床分离株的纯培养,制成菌悬液,分别于腹腔与肌内给小鼠与豚鼠注射。小鼠各4只(0.2 mL/只,腹腔注射;0.2mL/只,肌肉注射),对照组各2只;豚鼠各2只(1.5mL/只,肌肉注射;1.5 mL/只,腹腔注射),对照组各1只。对照组的豚鼠及小鼠以相同剂量注射生理盐水。
2 结果与分析
2.1 分离株的形态学观察
对发病牛场病死牛肝表面触片瑞特氏染色镜检,可初步确诊为腐败梭菌引起的病牛的死亡;将分离菌接种至肉干汤中,37℃厌氧培养24-48h,可见培养基内产生气体,培养物呈白色絮状沉入底部,摇晃后培养基变浑浊。
培养物接种到葡萄糖血琼脂平板厌氧培养48 h后可见有β溶血现象,在体视显微镜下观察菌落如纽扣状(图1)。将典型菌落涂片,革兰氏染色镜检可见革兰氏阳性大杆菌,芽孢位于菌体中央(图2),分离株菌落特征,溶血性及菌体特征符合腐败梭菌特征。
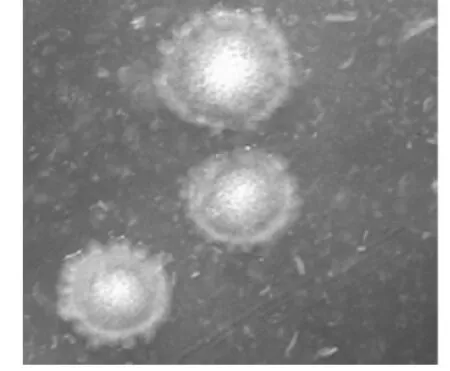
图1 分离株菌落形态(10×12.5)Fig.1Colony morphology of isolates(10×12.5)
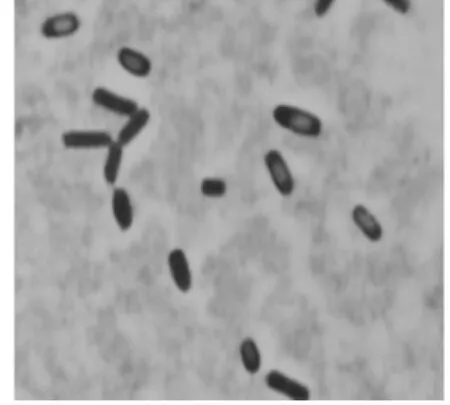
图2 分离株菌体形态 (革兰氏染色10×100)Fig.2Bacteria morphology of isolates(Gram10×100)
2.2 生化鉴定结果
生化鉴定以产气荚膜梭菌作对照。由表1可见,分离株明胶液化;能发酵葡萄糖、麦芽糖、乳糖,产酸产气;不发酵蔗糖;能消化石蕊牛奶,但不能凝固牛乳;不产生硫化氢;吲哚试验阴性;卵磷脂和酯酶实验均是阴性。结果符合腐败梭菌生化特性。

表1 分离株生化实验结果Tab.1The results of biochemistry experiment
2.3 PCR扩增结果鉴定
分离株泳道在472bp处有明显的条带(图3),与预期的扩增片段大小相一致。
2.4 克隆测序及同源性分析
将分离株扩增的PCR产物的片段回收后进行克隆测序。测序结果用DNAMAN进行分析比对,结果与GenBank中登录的序列号为JF733419的腐败梭菌的同源性达95.43%(图4),其中有16个碱基突变,2个碱基缺失。
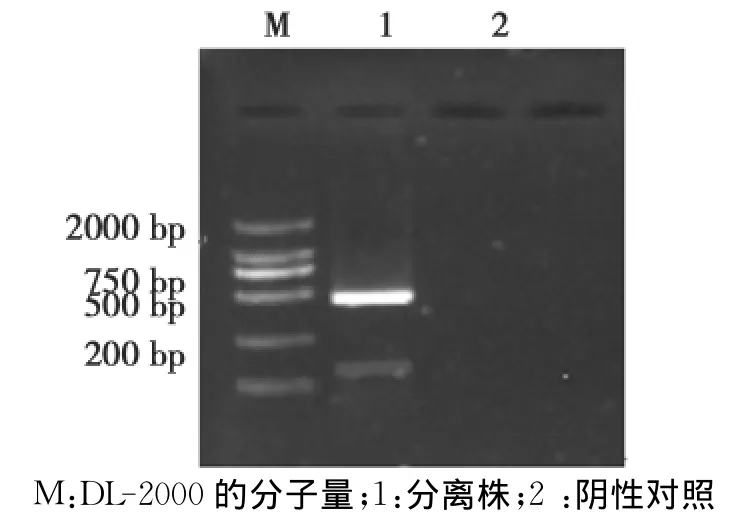
图3 腐败梭菌的PCR鉴定Fig.3PCR identification of Clostridium septicum

图4 分离株与JF733419序列比对结果Fig.4The comparison of gene sequence between JF733419and isolates
2.5 动物实验结果
小鼠感染分离株5-7h后,表现精神沉郁,8只感染小鼠均在12h内死亡;豚鼠感染分离株后,在30h相继表现闭眼,厌食,精神沉郁,闭目最后死亡,4只感染豚鼠均在48h先后死亡。注射生理盐水的对照组小鼠和豚鼠均存活。
无菌采取感染分离株死亡后小鼠及豚鼠肝脏触片,瑞特氏染色镜检可见呈长丝状无关节菌体(图5),其菌体形态与死亡奶牛肝脏触片形态一致,也与腐败梭菌的特性相一致。
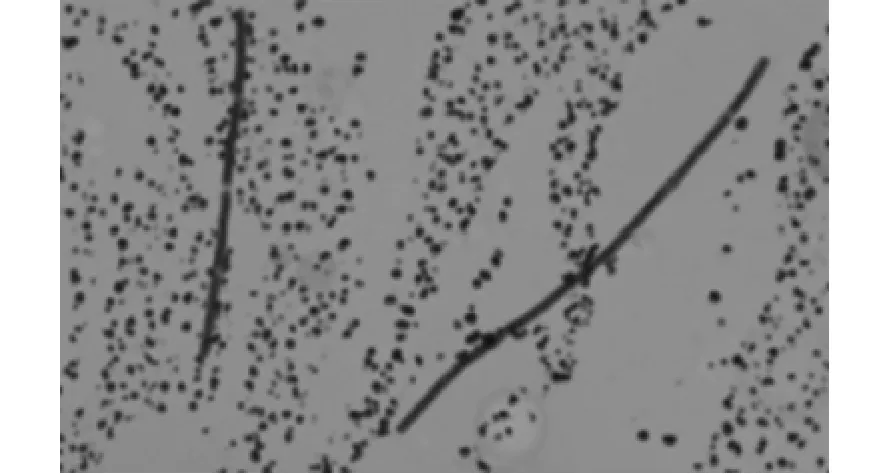
图5 肝触片 (革兰氏染色,10×100)Fig.5Liver tissue smear(Gram,10×100)
2.6 感染动物分离株的PCR检测结果
将感染分离株的小鼠及豚鼠死亡后的肝脏按1.2.4中的方法进行PCR检测,结果扩增出了472 bp的片段(图6)与奶牛自然感染分离株的PCR扩增片段一致。
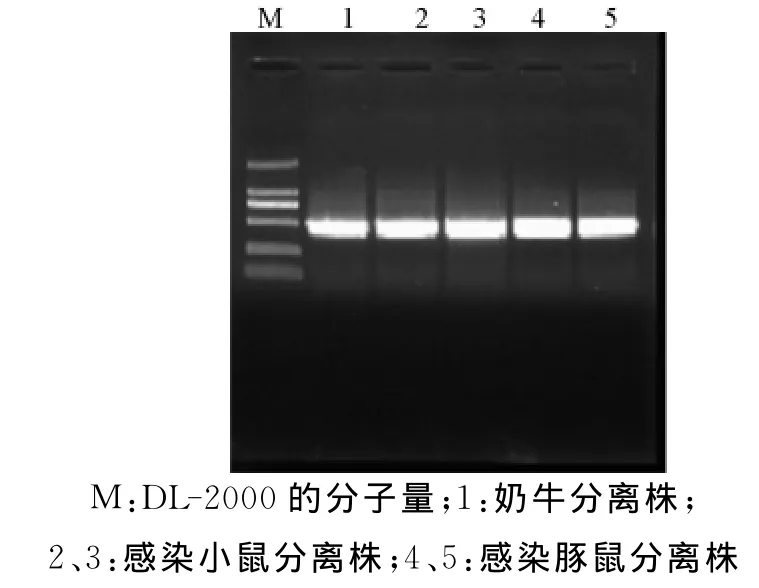
图6 腐败梭菌实验动的PCR鉴定图片Fig.6PCR identification of animals infected with Clostridium septicum
3 讨论
腐败梭菌广泛存在于牛舍粪便中,属于专性厌氧菌,其芽胞的抵抗力极强,可随尘埃在牛舍内散布,但奶牛感染多发生于外伤如采血、免疫注射、分娩助产有关,一般呈散发。该牛场在2009和2010年同一时间先后发生11头相同症状的恶性水肿病例,经调查发病牛均有产前注射口蹄疫疫苗或分娩时助产史[11]。这可能由于消毒不严而经伤口感染发病。因此,防止牛体外伤及伤口及时处理,做好注射、助产的无菌操作与术后护理,定期对牛舍特别是发病牛的污染物及所处环境进行消毒,这是预防该病的前提。
由实验动物感染结果表明,分离株无论经肌内或腹腔注射,致死率均为100%,说明其具有较强的致病性。通过对病死牛剖检及肝脏触片染色,初步诊断得出病原菌为腐败梭菌,再经病原菌的分离、生化鉴定、实验动物感染、分离株PCR鉴定及克隆测序和同源性分析,结果表明该奶牛场奶牛急性死亡病例系由腐败梭菌引起的奶牛恶性水肿所致。
本研究的病料来源于生产,通过结合临床及实验室的诊断方法,为腐败梭菌引起奶牛恶性水肿病的诊断及病原菌的分离鉴定提供依据。
[1]杨本升,刘玉斌,苟仕金,等.动物微生物学[M].长春:吉林科学技术出版社,1995.
[2]Bamham M,Weightman.Clostridium septicum infection and hemolytic uremic syndrome[J].Emerg Infect Dis,1998,4:321-324.
[3] Candra L Smith Slatas,Michael Bourque,Juan C Salazar.Clostridium septicum infections in children;a case report and review of the literature[J].Biological Sciences,2006,4:796-805.
[4]Minhao Zhou,Robert G,Martindale.Clostridium septicum infection Associated with necrotizing pancreatitis,transmural gastric necrosis,and liquefaction of the spleen[J].European Journal of Trauma and Emergency Surgery,2008,1:77-79.
[5]Gordon V M,Benz R,Fuji K,et al.Clostridium septicum alpha-toxin is prot-eolytically activated by furin[J].Infect Immun,2001,65(10):4130-4134.
[6]陈聪敏,王文风.厌氧菌及其感染[M].上海:上海医科大学出版社,1989.
[7]姚火春.兽医微生物学实验指导[M].北京:中国农业出版社,2006.
[8]布坎南,吉本斯.伯杰细菌鉴定手册[M].北京:科学出版社,1984.
[9]刘进元,常智杰,赵广荣,等.分子生物学实验指导[M].北京:清华大学出版社,2002.
[10]陈小云,张存帅,关孚时,等,腐败梭菌a毒素基因的克隆与序列分析[J].中国预防兽医学报,2005,27(2):112-115.
[11]陆承平.兽医微生物学[M].北京:中国农业出版社,2005.
