封闭环境对C57BL/6J小鼠听功能及听皮层GABA能神经元凋亡的影响*
2012-01-11吴晓平陈继川陈炜
吴晓平 陈继川 陈炜
老年性聋主要的病理学变化是听觉神经细胞的凋亡[1~3],并且可能是外周听觉系统与中枢听觉系统功能联合降低衰变的结果[4,5],其病因可能为遗传性因素与环境因素的共同作用,其中遗传因素在老年性聋发展过程中所起作用的比例约为35%~55%[6]。有关后天环境因素与老年性聋的关系的研究集中于环境噪声[7]、耳毒性药物[8]、糖尿病[9]、心血管病[10]等等方面,而对环境因素的研究中注意到许多老年人处于相对封闭的社会生活环境下,这种情况对老年性聋的发生发展是否有促进作用目前未有明确报道。本实验拟通过将老年性聋动物模型置于封闭环境中,探讨封闭环境对老年性聋的影响。
1 材料与方法
1.1实验动物及试剂 无强噪声暴露史及耳毒性药物使用史的2月龄(体重15~25 g)、10月龄(体重45~60 g)老年性聋动物模型C57BL/6J小鼠各40只,均为雌性,购于第三军医大学大坪医院野战外科研究所实验动物中心,SPF级。鼠抗γ-氨基丁酸(GABA)多克隆抗体购于sigma公司,二抗兔抗鼠Dylight及Tunel试剂盒购于江苏碧云天生物技术研究所,速眠新II购于长春军事医学科学院研究所。
1.2封闭环境的构建 自制约为0.30 m×0.30 m×0.30 m大小空间的鼠笼,透光透气,互相远离并置于安静环境,使之不受外来噪声影响。温度控制在20~25℃,饮食光线等无特殊干预。除喂食水及清洁鼠笼外,尽量不干扰实验动物。
1.3实验方法
1.3.1动物分组及饲养 实验动物群居饲养1月后分组,将2月龄、10月龄动物各均分为实验组和对照组,每组20只。将实验组动物全部单独置于封闭环境中,对照组继续普通环境群居饲养,各组动物分别饲养2个月。
1.3.2ABR检测 实验组与对照组动物分别于分组前及分组饲养2月后进行ABR检测,动物均以左耳为测试耳。采用美国智听公司(intelligent hearing system)Smart EP进行ABR检测,动物以20%的速眠新II(10 ml/kg)肌肉注射麻醉,麻醉后置隔声恒温室内,自制电极连接,以鼻尖为地线,颅顶为记录电极,左侧乳突为参考电极,给声管置于左侧外耳道中,刺激声为纯音(puretoner),低通1 500 Hz,高通100 Hz,叠加1 024次,刺激重复率11.1次/秒,刺激声90 dB SPL,以10分贝递减,阈值附近5分贝递减,以可引出波III的最小刺激强度为阈值。分别检测1、2、4、8、16 kHz各频率反应阈。
1.3.3听皮层神经元凋亡检测 动物用20%的速眠新II(10 ml/kg)麻醉后,暴露心脏,剪开右心耳,同时经左心室快速灌注37 ℃ PBS 60~80 ml以冲尽血液,此后先快速灌注4 ℃的4%的多聚甲醛40 ml左右,再缓慢灌注40~60 ml,然后开颅取脑组织,置于上述灌注液中,4 ℃保存,24小时后修剪标本。听皮层的定位参照The Mouse Brain in stereotaxic coordinates图谱,取听皮层组织,沿冠状面常规方法制作冰冻切片,片厚10 μm ,切片间隔20 μm,每个标本取10张切片,随机抽取5张,0.3% Triton,37 ℃,15 min,山羊血清封闭,37 ℃,30 min;加入一抗鼠抗GABA(浓度为1:400),4 ℃孵育24 h;Dylight(浓度为1:100)37 ℃孵育1 h,在每两个步骤中间都用PBS洗3遍,每遍5 min,此后按tunel说明书操作检测凋亡情况。激光共聚焦显微镜观察拍照,细胞核被染成红色为凋亡的听皮层细胞,胞浆呈蓝色为听皮层GABA能神经元,胞核呈红色而胞浆呈蓝色为听皮层凋亡的GABA能神经元,任选5个听皮层视野计数并取平均值。
1.4统计学方法 采用SPSS13.0统计软件对资料进行数据分析,两组均数比较用t检验(P<0.05有统计学意义)。
2 结果
2.1ABR检测结果 不同年龄的实验组各频率ABR阈反应阈与对照组相比明显提高,尤其以高频(8、16 kHz)明显(P<0.05或P<0.01);2、10月龄实验组各频率反应阈明显高于分组前(P<0.01),而2月龄对照组在16 kHz、10月龄对照组在4、16 kHz的反应阈均较分组前升高(P<0.05)(表1)。

表1 各组ABR不同频率反应阈比较
注:与同龄对照组比较,*P<0.05,**P<0.01;与同龄分组前比较,#P<0.05,##P<0.01
2.2各组听皮层GABA能神经元凋亡数 2月龄实验组的听皮层GABA能神经元数与对照组无差异(P>0.05),而凋亡的细胞数及凋亡的GABA能神经元数增多,与对照组比较差异有统计学意义(P<0.05)。10月龄实验组GABA能神经元数明显少于对照组(P<0.01),而凋亡的听皮层细胞个数明显多于对照组(P<0.01),而由于10月龄实验组GABA能神经元已大量凋亡,许多已不能被验出,故残存的凋亡GABA能神经元数偏少(图1,表2)。
表2 各组GABA能神经元、凋亡的听皮层细胞及凋亡的GABA能神经元数(个/视野,
注:与同月龄对照组比较,*P<0.05,**P<0.01
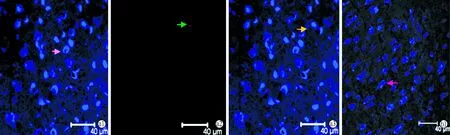
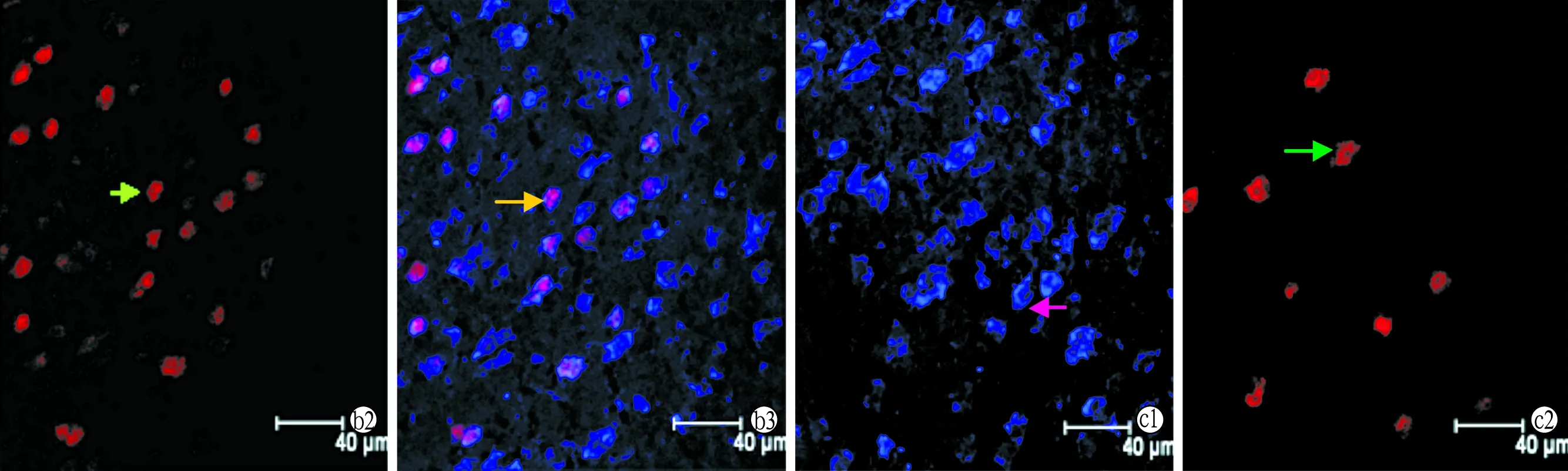
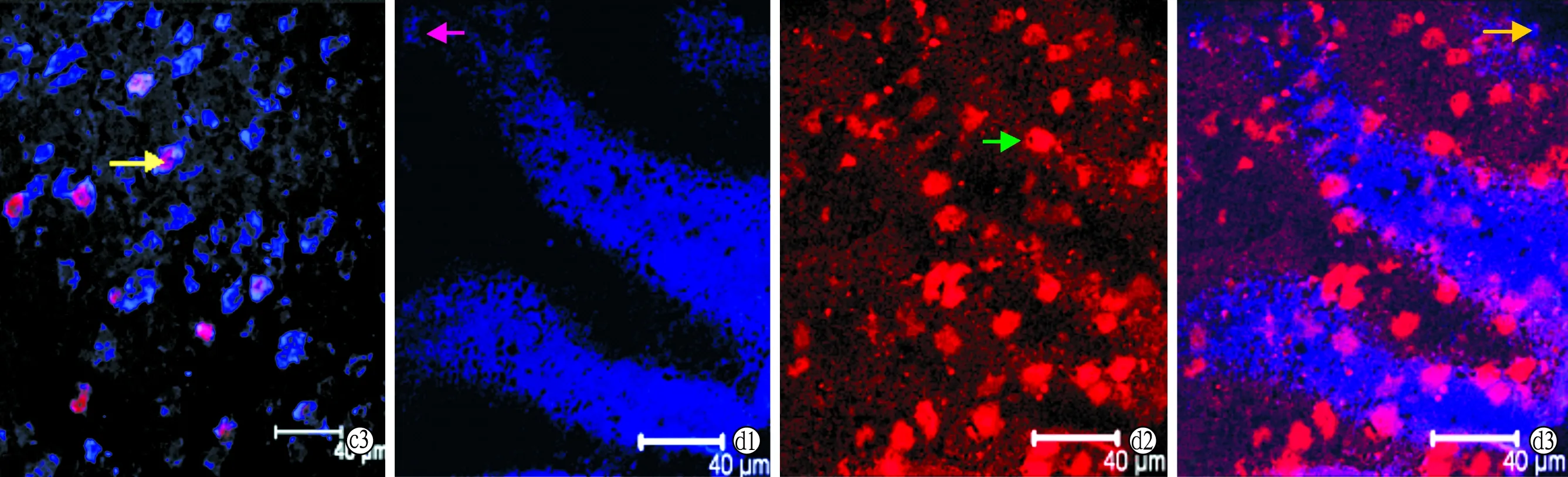
图1 Tunel法检测听皮层GABA能神经元的凋亡(激光共聚焦显微镜 ×800)
3 讨论
C57BL/6J小鼠是一种具有先天性遗传缺陷的老化动物模型,具有与人类相似的听觉衰退现象,故常被用于老年性聋的研究[11,12],因此本研究选择G57BL/6J小鼠来进行实验以模拟人类社会生活环境尤其是封闭环境对老年性聋的影响。对老年性聋的外部环境研究发现不同年龄段的C57BL/6J小鼠听力损失程度不同,性别的差异也影响听力损失水平[13,14];所以,本研究选择了不同年龄阶段的同性别的动物;而为了更好的模拟老年人生活环境的变化,先将所有实验动物群居饲养了1个月后再分组分别予以封闭环境和普通环境饲养,结果显示在置于封闭环境后,实验组动物活动减少,对刺激的敏感性下降,ABR反应阈比对照组提高,并且呈现出与年龄呈正相关。
目前发现老年性聋患者听觉功能衰退主要表现为言语区功能障碍,故认为中枢听觉系统病变为主要病因。听皮层中GABA能神经元含量丰富,本实验的结果显示听皮层GABA能神经元凋亡程度越重,其听功能受损程度越严重,说明听皮层GABA能神经元凋亡是老年性聋的重要病理因素。
目前公认的影响老年性聋最为重要的环境因素是噪声,此外,其发病率因地区环境、生活状况、饮食习惯及性别因素而不同,且受地区差异及许多未知因素如文化习俗、饮食习惯、精神压力及测试标准等影响,因而各时期各地区关于老年性聋发病率的报道各异。郑宏等[15]于1997年报道老年聋无论城乡均存在明显的地区差异,且同一地区城乡之间也存在差异;陈曦等[16]报道广东省老年性聋发病率农村(73.3%)高于城市(26.7%);刘民等[17]报道北京老年性聋发病率城市(48.23%)稍高于农村(41.63%)。这些流行病学资料间接说明患者所处的社会生活环境对老年性聋的重要影响。而现在存在普遍的社会现象是许多老年人由于疾病、丧偶、退休失业、子女外出工作等原因,其生活单调枯燥,缺乏正常的社交活动,对新事物的认知接受能力及意愿均减退,容易产生失落感和孤独感等情绪,与其它人群相比,其社会生活空间狭小封闭,尤其是在一些偏僻农村地区。封闭环境对老年性聋的发生发展是否有影响,值得探讨。从文中结果看,置于封闭环境后,实验组动物与分组前及同龄对照组比较其听皮层的GABA能神经元数目减少,凋亡程度增加,听功能减退,尤其在8、16 kHz高频区表现明显(P<0.01)。而处于开放环境中的2月龄对照组动物与分组前听功能比较,除在16 kHz反应阈升高外(P<0.05),其余频率无明显差异,而2月龄实验组各频率ABR反应阈均较同月龄对照组及分组前明显升高;10月龄对照组与分组前相比,在4、16 kHz反应阈升高(P<0.05),而实验组各频率ABR反应阈较同月龄对照组及分组前明显升高,由此可证明封闭环境可导致听皮层GABA能神经元凋亡,进而导致听功能下降,并且对高频听功能影响明显。另外,本研究经Tunel法检测听皮层细胞凋亡时发现,2、10月龄实验组细胞凋亡数均高于对照组,说明封闭环境也能促进听皮层除GABA能神经元以外的其它细胞的凋亡,而这种其它细胞的凋亡是否与听功能下降有关,除了GABA能神经元外还有哪些细胞与听功能关系密切,它们与GABA能神经元对听功能的影响是拮抗作用还是协同作用等等,都有待于进一步研究。
老年性聋作为一种神经功能退行性病变,其病因非常复杂,本研究为排除其他影响因素干扰,以同样时间、地区、相同的年龄、同样的饮食、同样的测试标准单纯考查封闭环境对老年性聋发生发展的影响,结果证实GABA能神经元凋亡是老年性聋的病理变化;封闭环境是老年性聋的危险因素,它能促进听皮层GABA能神经细胞的凋亡,从而加快老年性聋的发生和发展。而封闭环境通过何种机制导致GABA能细胞凋亡,有待于进一步研究。
4 参考文献
1 Spicer SS, Schulte BA.Spiral ligament pathology in quiet-age gerbils[J].Hear Res,2002,172:172.
2 Alam SA, Oshima T, Suzuki M, et al. The expression of a- poptosis-relate proteins in the aged cochlea of Mongollian gerbils[J]. Laryngoscope,2001,111:528.
3 宣伟军,黄正团,丁大连.中药健耳胶囊对抗C57BL/6J 小鼠老年性耳蜗损害的试验研究[J].听力学及言语疾病杂志,2007,15:47.
4 Mazelova J, Popelar J,Syka J. Auditory function in presbycusis: peripheral vs cent-.ral changes[J].Exp Gerontol,2003,38:87.
5 Hang JH ,Li CW, Wu CW,et al. Aging effects on the activation of the auditory cortex during binaural speech listening in white noise:an fMRI study[J].Audiol Neurootol,2007,12:285.
6 Gates GA,Couropmiree NN,Myers RH,et al.Genetic association in age-related hearing thresholds[J].Arch Otolaryngol Head Neck Surg,1999,12:654.
7 Dobie RA.The relative contributions of occupational noise and aging in individual cases of hearing loss[J].Ear Hear,1992,13:15.
8 Mills JH,Matthews LJ,Lee FS ,et al.Gender-specific effects of drugs on hearing levels of older persons[J].Ann NY Acad Sci,1999,884:381.
9 Dalton DS, Cruickshanks KJ, Klein R,et al.Association of NIDDM and hearing loss[J].Diabetes Care ,1998,21:1 540.
10 Gates GA,Cobb JL,D'Agostino RB,et al.The relation of hearing in the elderly to the presence of cardiovascular disease and cardiovasculai risk factors[J].Arch Otolaryngol Head Surg Neck,1993,119:156.
11 Chole RA, Henry KR .Disparity in the cytocoleogram and the eletrocochgram in aging P/J andA/J inbred mice [J].Audiology,1993,22:383.
12 Schnerson A, Dev Pujol R .Age-related change in the C57BL/6J mouse cochlea Physiological findings [J]. Brain Res, 1981,2:65.
13 Henry KR. Sex- and age-related elevation of cochlear nerve envelope response (CNER) and auditory brainstem response (ABR) thresholds in C57BL/6 mice[J]. Hear Res,2002,170:107.
14 Willott JF, Bross LS. Effects of prolonged exposure to an augmented acoustic environment on the auditory system of middle-aged C57BL/6J mice cochlear and central histology and sex differences[J]. J Comp Neurol,2004,472:358.
15 郑宏,于普林,高芳坤,等.1997年中国六城市老年人群六种疾病横断面调查[J]. 中华老年医学杂志,2000,19:215.
16 陈曦,黄东锋,陈少贞,等. 广东省成人听力残疾主要致残原因分析和对策分析[J].中国康复医学杂志,2009(5):439.
17 刘民,沈励,栾承. 北京市居民听力残疾主要原因调查分析[J].听力学及言语疾病杂志,2009,17:336.
