LY294002对阿霉素诱导的人乳腺癌上皮-间质转化作用的影响
2012-01-11钱玉珺成向明武晨江赵梦琳戚晓红
钱玉珺,成向明,王 斌,徐 磊,武晨江,赵梦琳,戚晓红,郭 军
南京医科大学基础医学实验教学中心,南京 210029
LY294002对阿霉素诱导的人乳腺癌上皮-间质转化作用的影响
钱玉珺,成向明,王 斌,徐 磊,武晨江,赵梦琳,戚晓红,郭 军
南京医科大学基础医学实验教学中心,南京 210029
目的研究LY294002对阿霉素 (ADM)诱导的人乳腺癌细胞上皮-间质转化作用的影响。方法体外培养人乳腺癌细胞MCF-7,以ADM与或不与PI3K特异抑制剂LY294002共同处理,采用Western blot法检测Akt、p-Akt、Snail和E-cadherin蛋白水平的变化,RT-PCR检测Snail与E-cadherin mRNA的表达。结果ADM可通过磷酸化上调Akt活性,增加Snail蛋白水平及降低E-cadherin的表达 (P<0.05),LY294002预处理可逆转上述蛋白的活性和含量变化(P<0.05)。结论LY294002可逆转ADM诱导的人乳腺癌上皮-间质转化,其可能是通过抑制PI3K/Akt通路参与Snail和E-cadherin表达调控来实现的。
阿霉素;LY294002;人乳腺癌细胞;上皮-间质转化
上皮-间质转化 (epithelial-mesenchymal transition,EMT)是多细胞生物胚胎发育的基础,是具有极性的上皮细胞转换成具有活动能力、能够在细胞基质间自由移动的间质细胞过程。EMT以上皮细胞极性丧失及间质特性获得为重要特征,具体包括:细胞黏附分子 (如E-cadherin)表达减少;角蛋白为主的细胞骨架转变为波形蛋白为主的细胞骨架,从而引起细胞形态的改变[1]。最近,EMT在肿瘤的发生、浸润和转移中的作用引起人们广泛关注[2]。肿瘤的EMT与化疗耐药密切相关[3],乳腺癌耐药细胞系及对紫杉醇耐药的卵巢癌细胞均有EMT改变[4-5]。本研究观察了 LY294002对阿霉素 (adriamycin,ADM)诱导的人乳腺癌细胞EMT作用的影响。
材料和方法
材料 人乳腺癌细胞MCF-7细胞株由南京医科大学细胞生物学系提供。阿霉素购自深圳海王药业公司,LY294002购自碧云天生物技术研究所,RPMI medium 1640购自美国Invitrogen公司,新生牛血清购自美国Hyclone公司,Akt抗体、磷酸化Akt抗体(Ser473)、E-cadherin抗体、Snail抗体购自北京博奥森生物技术公司,β-actin、Snail、E-cadherin引物由美国Invitrogen公司合成,Trizol与Trans RT-PCR SuperMix kit购自北京全式金生物技术有限公司。
细胞培养与药物处理 将MCF-7按常规培养在含15%新生牛血清的1640培养基中,于37℃、5%CO2条件下培养,细胞为贴壁生长,每5~6 d传代,取对数生长期的细胞进行实验。处理前,将MCF-7消化后接种于细胞培养板,待细胞贴壁生长至80%的融合状态,加入10 μmol/L ADM作用12 h和48 h,于预处理组应用10 g/L的LY294002,12 h后加入10 μmol/L 的 ADM 作用48 h。
Western blot检测 p-Akt、Snail、E-cadherin 的表达 将MCF-7消化后接种于6孔板,药物处理后收集各组细胞,加入细胞裂解液,于4℃、12 000×g离心10 min,小心吸出上清液,用Bradford法进行蛋白质定量。经变性后取30 μg蛋白质/泳道进行SDS-聚丙稀酰胺凝胶电泳,转移蛋白到硝酸纤维素膜上。5%脱脂牛奶室温封闭2 h后,分别与p-Akt抗体、Snail抗体、E-cadherin抗体杂交过夜,以Akt、β-actin作为对照,TBST洗膜5 min×3次,加入HRP标记的Ⅱ抗,摇床上室温孵育2 h,TBST洗膜10 min×3次,最后用DAB-HRP荧光检测试剂激发荧光,于暗室显影和定影后进行图像分析。
RT-PCR检测Snail、E-cadherin的表达 将MCF-7消化后接种于6孔板,药物处理后收集各组细胞,Trizol试剂提取细胞总RNA,溶于无RNase水中,紫外分光光度计测定D260/D280的比值在1.8~2.0之间。用北京全式金生物技术有限公司逆转录试剂盒提供的25℃ 10 min、42℃ 30 min、85℃ 5 min的条件合成cDNA,再取RT产物于50 μl体系进行PCR循环,并以β-actin做为内参照。反应结束后,取PCR产物5 μl在1.5%的琼脂糖凝胶中电泳,溴化乙锭染色,在捷达凝胶成像系统中观察并摄图。Snail上游引物为5'-TCAGACGAGGACAGTGGGAAAG-3',下游引物为5'-GCTTGTGGAGCAGGGACATTC-3',产物长度 487 bp。E-cadherin上游引物为5'-TGCCCAGAAAATGAAAAAGG-3',下游引物为5'-GGATGACACAGCGTGAGAGA-3',产物长度225 bp。β-actin上游引物为5'-AAATCTGGCACCACACCTTC-3',下游引物为5'-CCATCTCTTGCTCGAAGTCC-3',产物长度432 bp。PCR反应条件均为94℃预变性40 s;94℃变性30 s,58℃退火30 s,72℃延伸20 s,28个循环;最后72℃延伸7 min。
统计学处理 采用SPSS 13.0统计软件,所有实验均重复3次以上,数据以均数±标准差表示,组间比较采用单因素方差分析及LSD-t检验,P<0.05为差异有统计学意义。
结 果
LY294002对ADM刺激MCF-7细胞Akt磷酸化的干预作用 ADM处理MCF-7细胞后,Akt磷酸化水平提高 (P<0.05),并且此效应随时间延长而更为显著;与ADM直接作用48 h组相比,LY294002处理12 h后再经ADM作用48 h的细胞,Akt磷酸化水平明显降低,差异有统计学意义 (P<0.05)(图 1)。
LY294002对ADM刺激MCF-7细胞Snail表达的干预作用 与对照组相比,ADM能升高胞内Snail蛋白和mRNA表达量 (P<0.05),随时间延长而更为显著。预先采用LY294002处理组与ADM处理48 h组相比,Snail表达明显减少 (P<0.05)(图2、3)。
LY294002干预ADM对E-cadherin表达的影响
与对照组相比,ADM能降低胞内E-cadherin蛋白和mRNA表达量 (P<0.05),随时间延长而更为显著。预先采用LY294002处理组与ADM处理48 h组相比,E-cadherin表达明显增加 (P<0.05)(图4、5)。
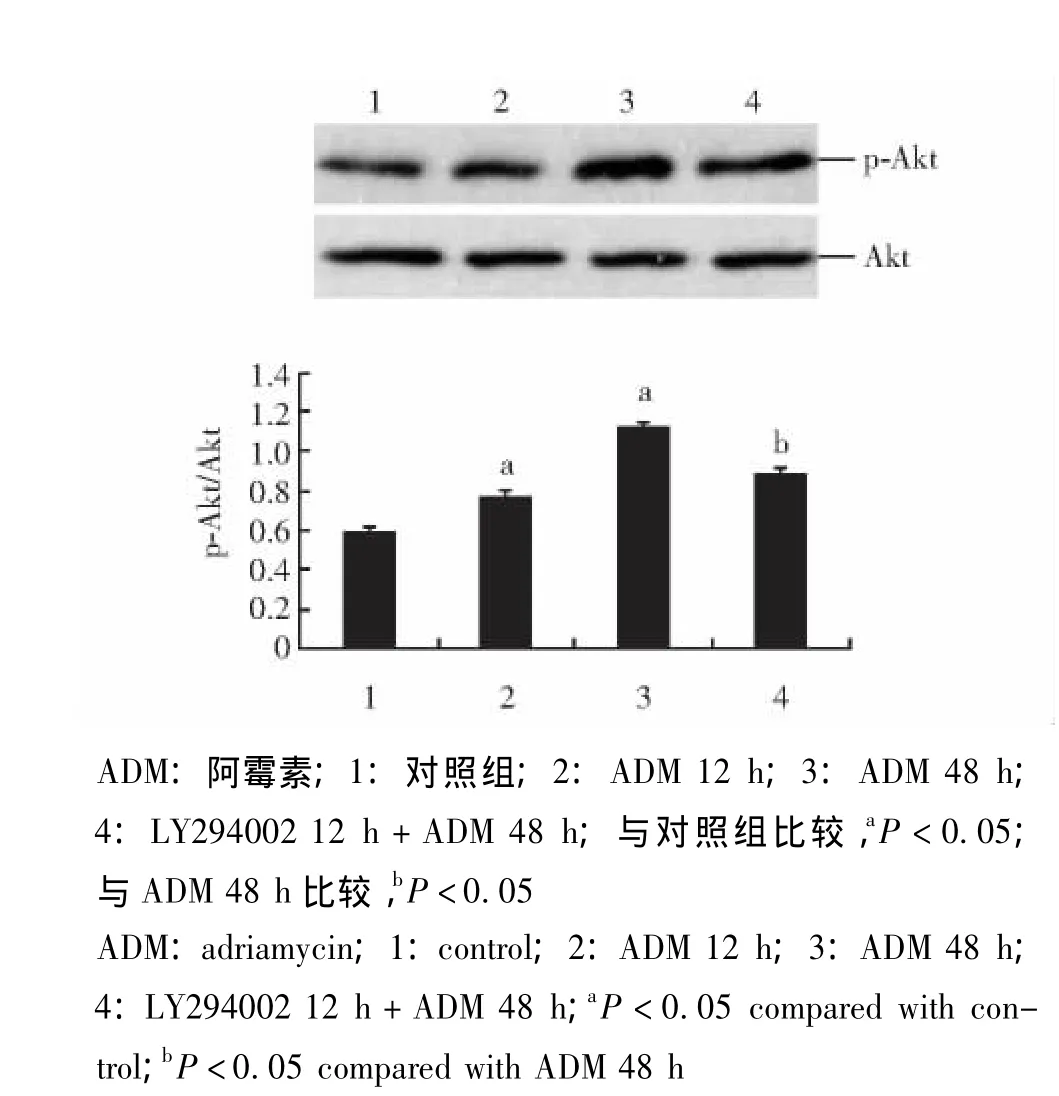
图1 LY294002对ADM刺激MCF-7细胞Akt磷酸化的干预作用Fig 1 Effect of LY294002 on adriamycin-induced phosphorylation of Akt in MCF-7
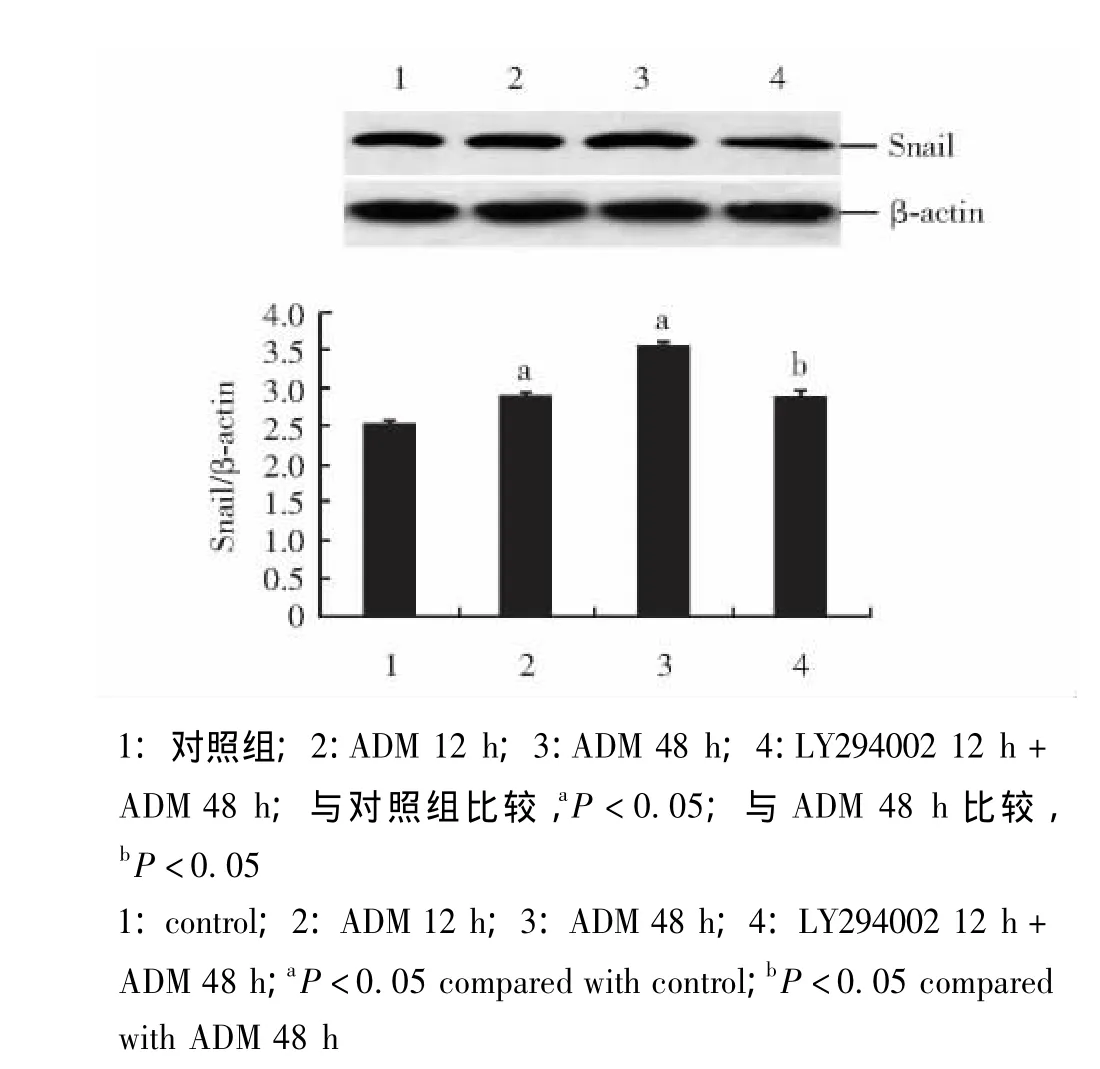
图2 LY294002对ADM刺激MCF-7细胞Snail蛋白表达的干预作用Fig 2 Effect of LY294002 on adriamycin-induced expression of Snail in MCF-7
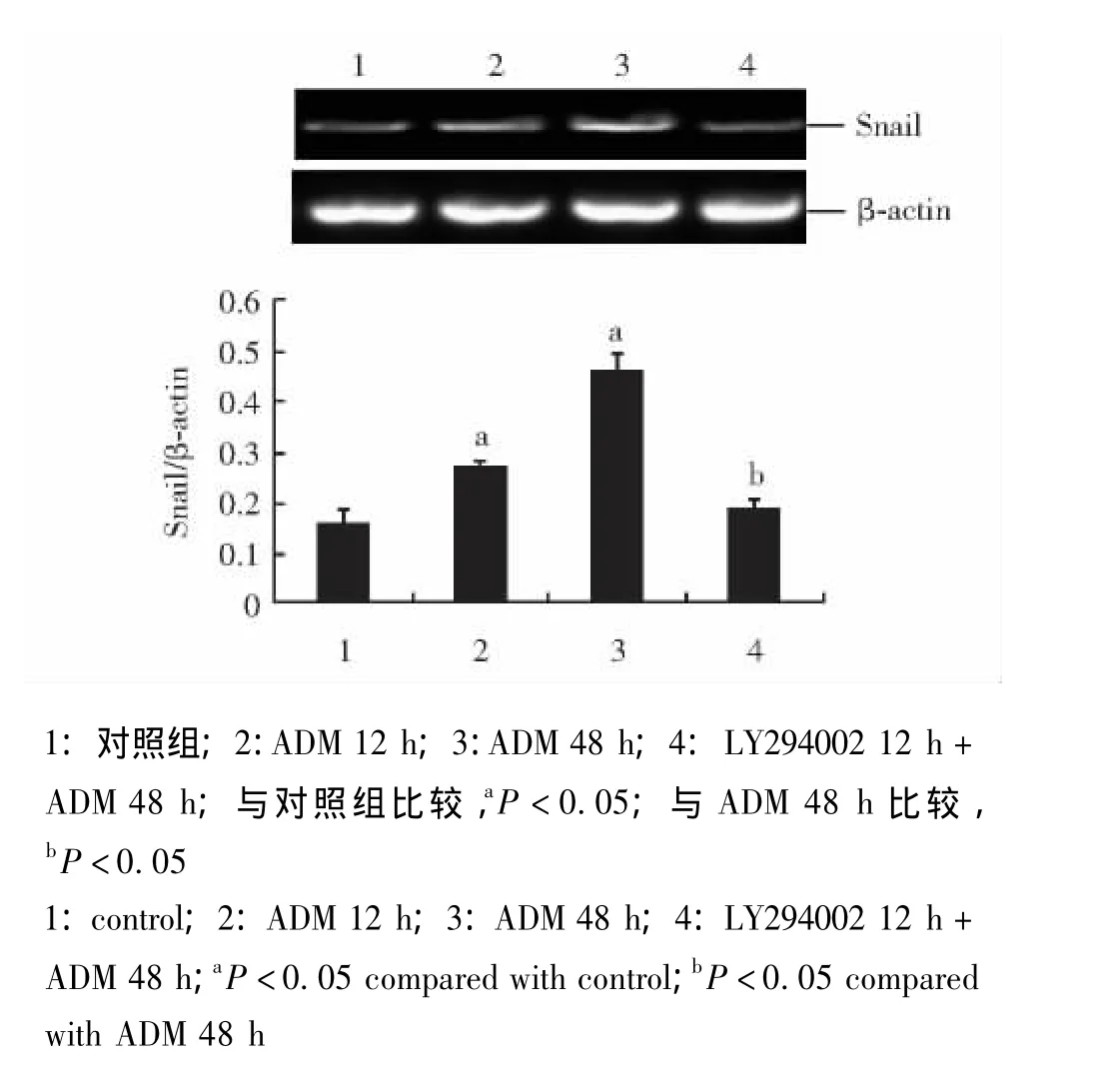
图3 LY294002对ADM刺激MCF-7细胞Snail mRNA表达的干预作用Fig 3 Effect of LY294002 on adriamycin-induced mRNA expression of Snail in MCF-7
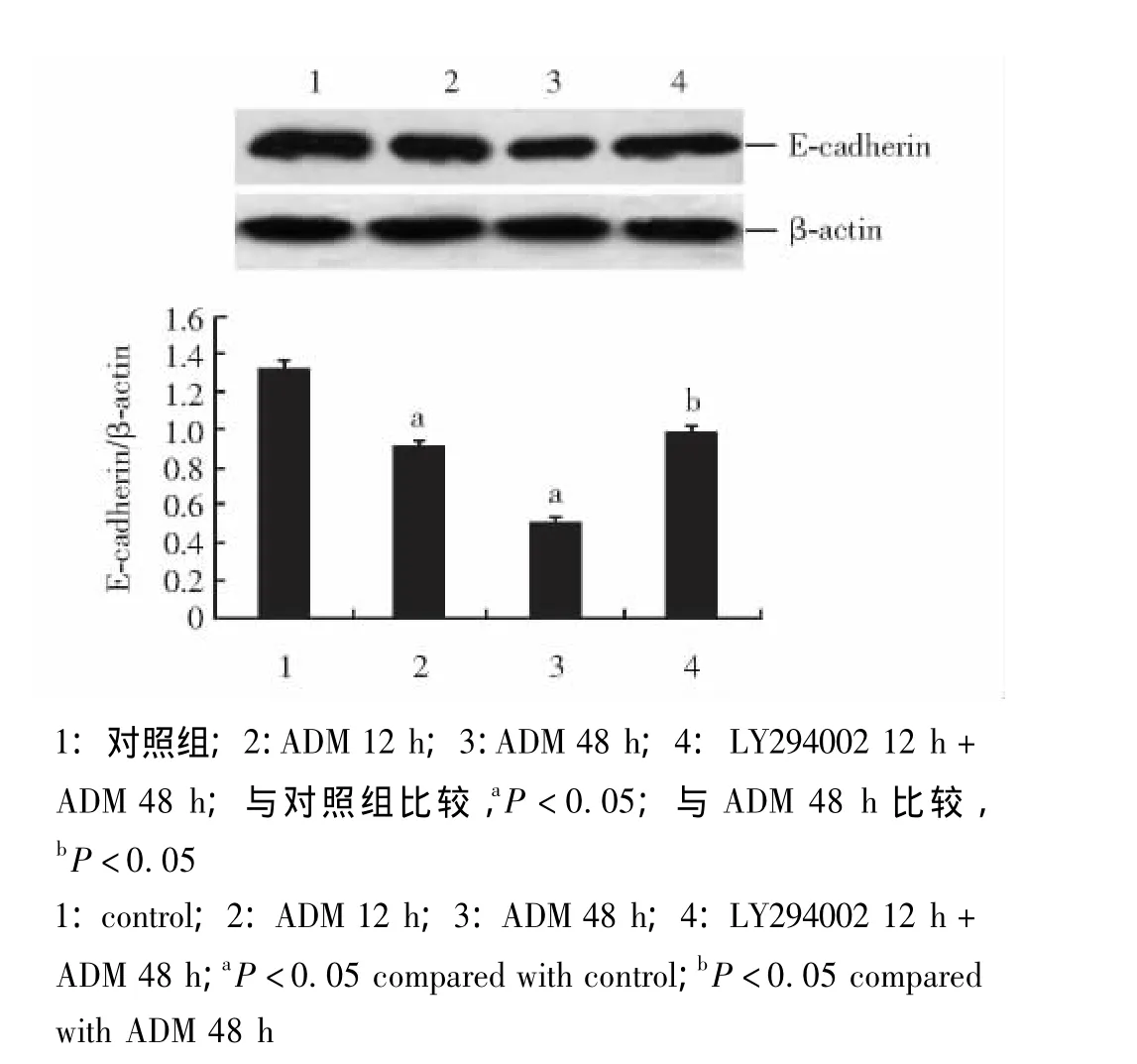
图4 LY294002干预ADM对E-cadherin蛋白表达的影响Fig 4 Effect of LY294002 on adriamycin-induced expression of E-cadherin in MCF-7
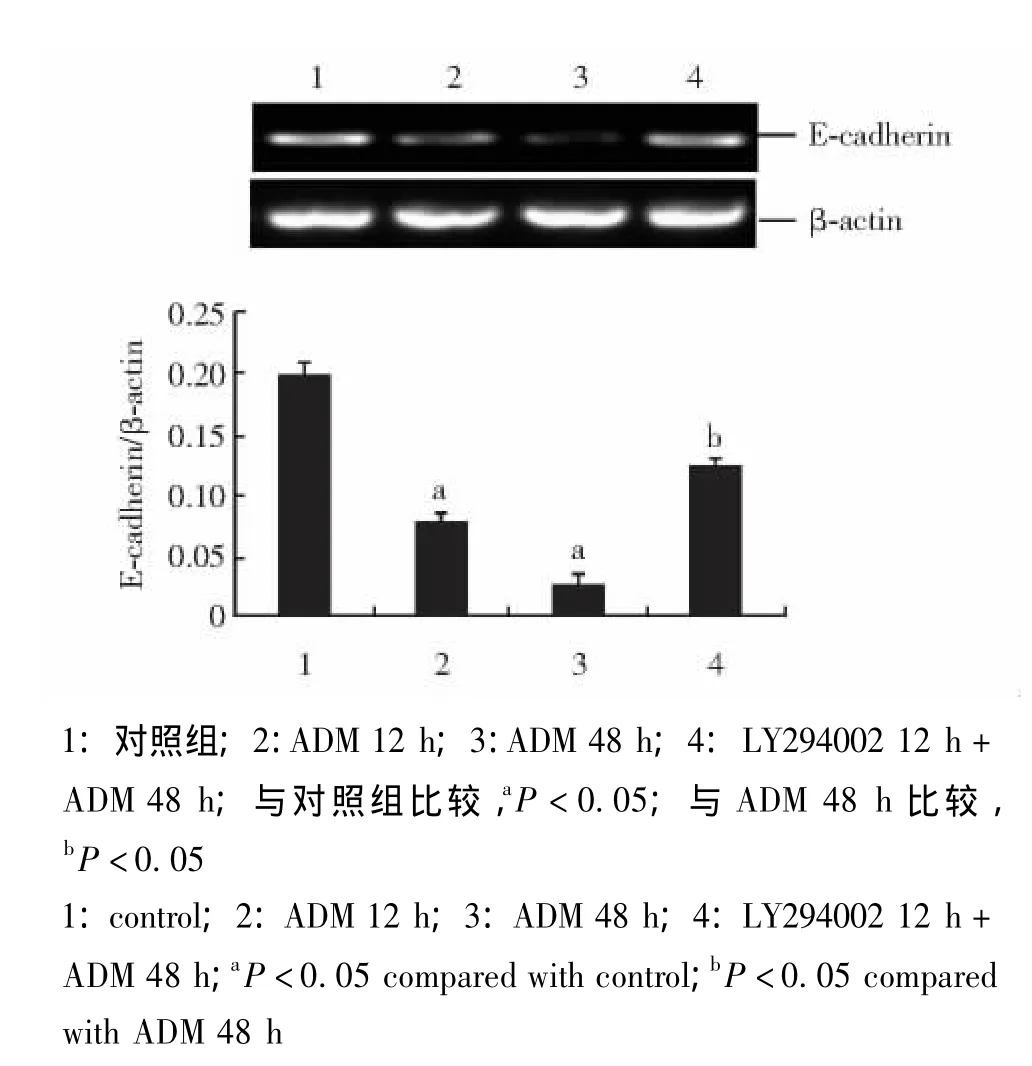
图5 LY294002干预ADM对E-cadherin mRNA表达的影响Fig 5 Effect of LY294002 on adriamycin-induced mRNA expression of E-cadherin in MCF-7
讨 论
化疗药物在有效清除肿瘤细胞的同时,亦会引起肿瘤细胞恶性程度增加[6-7]。作为首个在临床上使用的蒽环类抗癌药、当前乳腺癌治疗最有效的药物之一,ADM在临床应用中常引起肿瘤细胞的化疗耐药与转移而降低疗效,探明其具体机制对改善肿瘤治疗极有意义。
E-cadherin是一种依赖Ca2+的细胞间跨膜黏连糖蛋白分子,主要存在于上皮组织中,参与细胞间的连接。作为EMT的关键分子,E-cadherin的表达下调或抑制和功能丧失都可以启动EMT,肿瘤细胞经过这种细胞表型的转化获得更高的侵袭性[8]。本研究中,以ADM处理乳腺癌细胞MCF-7,12 h后E-cadherin表达开始下调,48 h下降更显著,证明ADM在早期即诱导细胞发生EMT,此结果与相关文献报道基本一致。同时在此过程中,细胞的形态发生变化,迁移能力增强[9]。
进一步结果显示,ADM诱导乳腺癌细胞发生EMT的过程中,伴随Akt磷酸化水平上升,Snail转录因子表达增加,且有显著的时间效应。以PI3K特异性抑制剂LY294002预处理能显著降低Akt磷酸化及活性,减少Snail含量,刺激E-cadherin表达,逆转ADM诱导的EMT。这表明ADM能通过Akt通路上调Snail表达,诱导乳腺癌细胞发生EMT,且随时间延长而效果更显著,而LY294002可逆转此过程。
PI3K/Akt信号转导途径与Snail转录因子参与多种细胞的EMT:如PI3K/Akt信号途径的激活可诱导前列腺癌发生EMT[10],肝癌的EMT与PI3K通路及Snail的活性上调有关[11-12],乳腺癌细胞 EMT与Snail高表达有关[13]。本研究表明,PI3K/Akt信号通路及Snail在乳腺癌细胞EMT中有重要地位,且PI3K/Akt信号通路参与了Snail表达调控。
综上,本研究提示了ADM联合LY294002治疗乳腺癌的新思路。肿瘤细胞的化疗耐药与EMT密切相关可能与两者都受PI3K/Akt通路调节有关[14]。早期以LY294002阻止EMT的发生,对防止耐药性形成、降低转移风险有重要意义,能有效抑制应用ADM的不良后果。另外,PI3K/Akt通路已被证实参与肿瘤增殖、耐药、转移、EMT等众多进程[9-10,15-17]。以 PI3K为靶点的治疗方案可能同时阻断多条信号传导通路,起到高效、多向的治疗作用,具有广泛应用前景。
[1]Mathias RA,Simpsion RJ.Towards understanding epithelial-mesenchymal transition:A proteomics perspective [J].Biochim Biophys Acta,2009,1794(9):1325-1331.
[2]Voulqari A,Pintzas A.Epithelial-mesenchymal transition in cancer metastasis:mechanisms,markers and strategies to overcome drug resistance in the clinic[J].Biochim Biophys Acta,2009,1796(2):75-90.
[3]Singh A,Settleman J.EMT,cancer stem cells and drug resistance:an emerging axis of evil in the war on cancer[J].Oncogene,2010,29(34):4741-4751.
[4]Işeri OD,Kars MD,Arpaci F,et al.Drug resistant MCF-7 cells exhibit epithelial-mesenchymal transition gene expression pattern[J].Biomed Pharmacother,2011,65(1):40-45.
[5]Kajiyama H,Shibata K,Terauchi M,et al.Chemoresistance to paclitaxel induces epithelial-mesenchymal transition and enhances metastatic potential for epithelial ovarian carcinoma cells[J].Int J Oncol,2007,31(2):277-283.
[6]Yang JM,Medina GY,Vassil DJ,et al.Treatment of multidrug resistant(MDR1)murine leukemia with P-glycoprotein substrates accelerates the course of the disease [J].Biochem Biophys Res Commun,1999,266(1):167-173.
[7]Yamauchi K,Yang M,Hayashi K,et al.Induction of canc-er metastasis by cyclophosphamide pretreatment of host mice:an opposite effect of chemotherapy[J].Cancer Res,2008,68(2):516-520.
[8]Liu YN,Liu Y,Lee HJ,et al.Activated androgen receptor downregulates E-cadherin gene expression and promotes tumor metastasis[J].Mol Cell Biol,2008,28(23):7096-7108.
[9]Li QQ,Xu JD,Wang WJ,et al.Twist1-mediated adriamycin-induced epithelial-mesenchymal transition relates to multidrug resistance and invasive potential in breast cancer cells[J].Clin Cancer Res,2009,15(8):2657-2665.
[10]Lim M,Chuong CM,Roy-burman P.PI3K,Erk signaling in BMP7-induced epithelial-mesenchymal transition(EMT)of PC-3 prostate cancer cells in 2-and 3-dimensional cultures[J].Horm Cancer,2011,2(5):298-309.
[11]Ke AW,Shi GM,Zhou J,et al.CD151 amplifies signaling by integrin α6β1 to PI3K and induces the epithelial-mesenchymal transition in HCC cells [J].Gastroenterology,2011,140(5):1629-1641.
[12]Dang H,Ding W,Emerson D,et al.Snail1 induces epithelial-to-mesenchymal transition and tumor initiating stem cell characteristics[J].BMC Cancer,2011,11:396.
[13]Zhang W,Feng M,Zheng G,et al.Chemoresistance to 5-fluorouracil induces epithelial-mesenchymal transition via upregulation of Snail in MCF7 human breast cancer cells[J].Biochem Biophys Res Commun,2012,417(2):679-685.
[14]Hafsi S,Pezzino FM,Candido S,et al.Gene alterations in the PI3K/PTEN/AKT pathway as a mechanism of drug-resistance[J].Int J Oncol,2012,40(3):639-644.
[15]Hatton O,Phillips LK,Vaysberg M,et al.Syk activation of phosphatidylinositol 3-kinase/Akt prevents HtrA2-dependent loss of X-linked inhibitor of apoptosis protein(XIAP)to promote survival of Epstein-Barr virus+(EBV+)B cell lymphomas[J].Biol Chem,2011,286(43):37368-37378.
[16]Li H,Schmid-bindert G,Wang D,et al.Blocking the PI3K/AKT and MEK/ERK signaling pathways can overcome gefitinib-resistance in non-small cell lung cancer cell lines[J].Adv Med Sci,2011,56(2):275-284.
[17]Kim J,Lee JW,Kim SI,et al.Thrombin-induced migration and matrix metalloproteinase-9 expression are regulated by MAPK and PI3K pathways in C6 glioma cells[J].Korean J Physiol Pharmacol,2011,15(4):211-216.
Effect of LY294002 on Adriamycin-induced Epithelial-mesenchymal Transition in Human Breast Carcinoma Cells
QIAN Yu-jun,CHENG Xiang-ming,WANG Bin,XU Lei,WU Chen-jiang,ZHAO Meng-lin,QI Xiao-hong,GUO Jun
Laboratory Center for Basic Medical Sciences,Nanjing Medical University,Nanjing 210029,China
GUO Jun Tel:025-86862882,E-mail:Guoj69@yahoo.com.cn
ObjectiveTo study the effect of LY294002 on the adriamycin-induced epithelial-mesenchymal transition in human breast carcinoma cells.MethodsHuman breast carcinoma cells MCF-7 was culturedin vitroand then exposed to adriamycin with or without LY294002.The protein expression levels of Akt,phosphorylated-Akt(p-Akt),Snail,and E-cadherin was detected by Western blot analysis.The mRNA expressions of Snail and E-cadherin were determined by RT-PCR.ResultsAdriamycin significantly increased the protein expression of Snail and depressed the protein expression of E-cadherin(P<0.05).The pre-treatment with LY294002 significantly reversed the changes of activities and levels of the above proteins(P<0.05).ConclusionLY294002 could reverse the adriamycin-induced epithelial-mesenchymal transition in human breast carcinoma cells by regulating the expressions of Snail and E-cadherin through suppressing PI3K/Akt signaling pathway.
adriamycin;LY294002;human breast carcinoma cells;epithelial-mesenchymal transition
国家自然科学基金 (81170714)Supported by the National Natural Sciences Foundation of China(81170714)
郭 军 电话:025-86862882,电子邮件:Guoj69@yahoo.com.cn
R966
A
1000-503X(2012)04-0319-05
10.3881/j.issn.1000-503X.2012.04.002
Acta Acad Med Sin,2012,34(4):319-323
2012-02-29)
·综 述·
