肥胖症与心血管疾病
2012-01-11张抒扬
赵 青,张抒扬
中国医学科学院 北京协和医学院 北京协和医院心内科,北京 100730
肥胖症与心血管疾病
赵 青,张抒扬
中国医学科学院 北京协和医学院 北京协和医院心内科,北京 100730
随着肥胖发生率的日益增高,其危害性在全球已受到广泛关注。多项研究证实,肥胖及其并发症可使心脑血管疾患的发病年龄提前、药物及有创治疗阻力增大、死亡率明显升高,还可能导致心脏的结构、电生理及心肌功能损伤,尤其对于女性患者更具有显著意义。反之,心脏损伤亦可影响减肥方式的选择及综合预后。本文总结了肥胖及其并发症与心血管疾病的关系,并对心血管疾病的预防提出新思考。
肥胖;胰岛素抵抗;心血管疾病
近年来,生活水平的提高使高糖、高脂、高热量食品逐渐占据饮食金字塔底层,超重和肥胖人数显著增加。世界卫生组织将超重定义为体重指数 (body mass index,BMI)大于25 kg/m2,超过30 kg/m2即为肥胖;而基于人种差异,国内指标分别为24 kg/m2和28 kg/m2。从1991年到2002年,中国超重人口上升了40%,而肥胖比例更是翻了1倍[1]。
本质上说,肥胖是由于能量代谢紊乱导致的脂肪堆积。超额的体重不但增加了心、肺等脏器负担,更易造成全身各系统功能紊乱,其中病死率最高的并发症是心脑血管缺血性疾病。一项Meta分析纳入全球57个研究,探讨BMI和死亡风险的关系,发现BMI在22.5~25 kg/m2间患者的死亡率最低,超过25 kg/m2后,每增加5 kg/m2,总死亡率增加30%,其中缺血性心脏病死亡风险增加39%[2]。因此,肥胖被视为冠心病发生的独立影响因子。
心脏损伤机制
作为系统性疾病,肥胖可以通过直接或间接两种途径影响循环系统。直接作用主要来自脂肪组织局部堆积产生的压迫及炎症反应。心脏脂肪堆积使心肌细胞比例减小,收缩功能减低,而胸壁及腹部堆积的脂肪则进一步限制胸廓扩张及横膈移动,减低心脏舒张功能。有研究显示,胸廓的顺应性随BMI的增长呈指数下降[3]。另一方面,炎症反应可进一步破坏正常心肌组织。Rocha等[4]研究认为,肥胖是机体的一种炎症状态,堆积的脂肪可分泌大量细胞因子,招募并活化免疫细胞分泌炎症介质,影响组织细胞的糖脂代谢,导致其坏死。此外,增加的体重又对心输出量提出了更高要求,最终将导致心脏结构及功能的进行性损害。
除了直接作用,循环系统的损伤更多来自肥胖并发症的间接影响,其中包括内分泌及代谢紊乱导致的高血压、高脂血症、胰岛素抵抗、血管受损后形成的动脉粥样硬化斑,呼吸系统受累引发的低氧-高碳酸血症等。
肥胖相关的内分泌及代谢异常对心血管系统具有显著影响,而这一切都源于脂肪组织体积扩增所带来的全身炎症效应,其中尤以内脏周围脂肪组织的分泌活性最高。因此,即使是BMI相同的患者,其预后也可能差异悬殊。随着游离脂肪酸的局部堆积和脂肪组织质量的增加,肥大的脂肪细胞逐渐向巨噬细胞分化,表达并释放细胞因子和趋化因子,如肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)白细胞介素-6(interleukin-6,IL-6)、瘦素、抵抗素、单核细胞趋化蛋白-1(monocyte chemoatracttant protein-1,MCP-1)及纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor-1,PAI-1)等,而内皮细胞则通过增加黏附因子的表达发挥协同作用,一起参与对单核细胞的募集。上述过程形成的局部炎症反应环境降低了组织细胞对胰岛素的敏感性,导致胰岛素抵抗;而促炎症反应因子及致动脉粥样硬化调节因子进入血循环,则更进一步引发了系统性胰岛素抵抗状态及动脉粥样硬化[5]。反之,也正因为肝脏和骨骼肌组织的胰岛素抵抗状态使机体不能响应胰岛素对脂肪动员的抑制作用,从而造成脂肪的迅速分解,产生更多的游离脂肪酸,并由此形成恶性循环[6]。
此外,炎性细胞因子还参与了神经-内分泌系统的调节。实验证据显示,细胞因子瘦素水平随局部脂肪组织堆积量的增多而升高,其可引起交感神经轴兴奋,活化肾素-血管紧张素系统 (renin-angiotensin system,RAS)[7],并进一步激活体内的氧化应激反应,导致血管平滑肌增生、管壁弹力减小,以及对运动诱发的升压反应过度敏感化,在肥胖相关高血压的发生与进展中起主要介导作用 (图1)。升高的血压一方面使后负荷增加,导致心肌肥厚、收缩功能不全及心肌缺血;另一方面还能损伤血管内膜,引起动脉粥样硬化。与局部炎症反应类似,RAS的激活也可抑制胰岛素受体信号传递,导致胰岛素抵抗或2型糖尿病。洛沙坦干预降低高血压患者终点事件研究 (Losartan Intervention For Endpoint reduction in hypertension,LIFE)[8]和缬沙坦抗高血压长期应用评价(Valsartan Antihypertensive Long-term Use Evaluation,VALUE)[9]两项大规模临床试验证实,抑制RAS系统可增强胰岛素敏感性,减少肥胖患者新发糖尿病概率。糖尿病及高胰岛素水平代表着胰岛素抵抗的程度,与血清低密度脂蛋白 (low-density lipoprotein,LDL)及三酰甘油 (triglyceride,TG)升高密切相关[10],后两者均为动脉粥样硬化的重要介导分子,可引发缺血性心血管病。
肥胖引起的代谢紊乱不仅增加有害因素,还减少了某些重要保护成分,例如脂联素[11],该因子主要由脂肪细胞分泌,受体AdipoR1/R2广泛分布在血管内皮、骨骼肌、肝脏、淋巴细胞等多种组织和间质细胞表面。通过与受体结合,脂联素可有效增加组织细胞对胰岛素的敏感性,降低血脂及炎症因子水平;活化血管内皮细胞的NO合成酶 (endothelial NO synthase,eNOS)可增加局部NO浓度,起到扩张血管、防止血小板聚集和血管平滑肌细胞增生的作用。脂联素减少可造成胰岛素抵抗及内皮功能损伤,减少NO合成并加重血管病变[12],一方面增加血管内皮细胞中NAD(P)H氧化酶活性,持续刺激动脉粥样硬化、高血压的发生发展;同时上调细胞核因子 κB(nuclear factor kappa B,NF-κB)和内皮素-1(endothelin-1,ET-1)的表达[13],而后者的血管收缩效应可诱发冠状动脉痉挛。
除了对内分泌和代谢的影响,肥胖相关的呼吸系统并发症也可间接损伤心脏及血管。Damia等[3]研究认为,由于头颈部脂肪堆积、口咽部软组织增生和肌肉松弛,容易造成气道尤其是咽腔部位狭窄,导致患者发生阻塞性睡眠呼吸暂停 (obstructive sleep
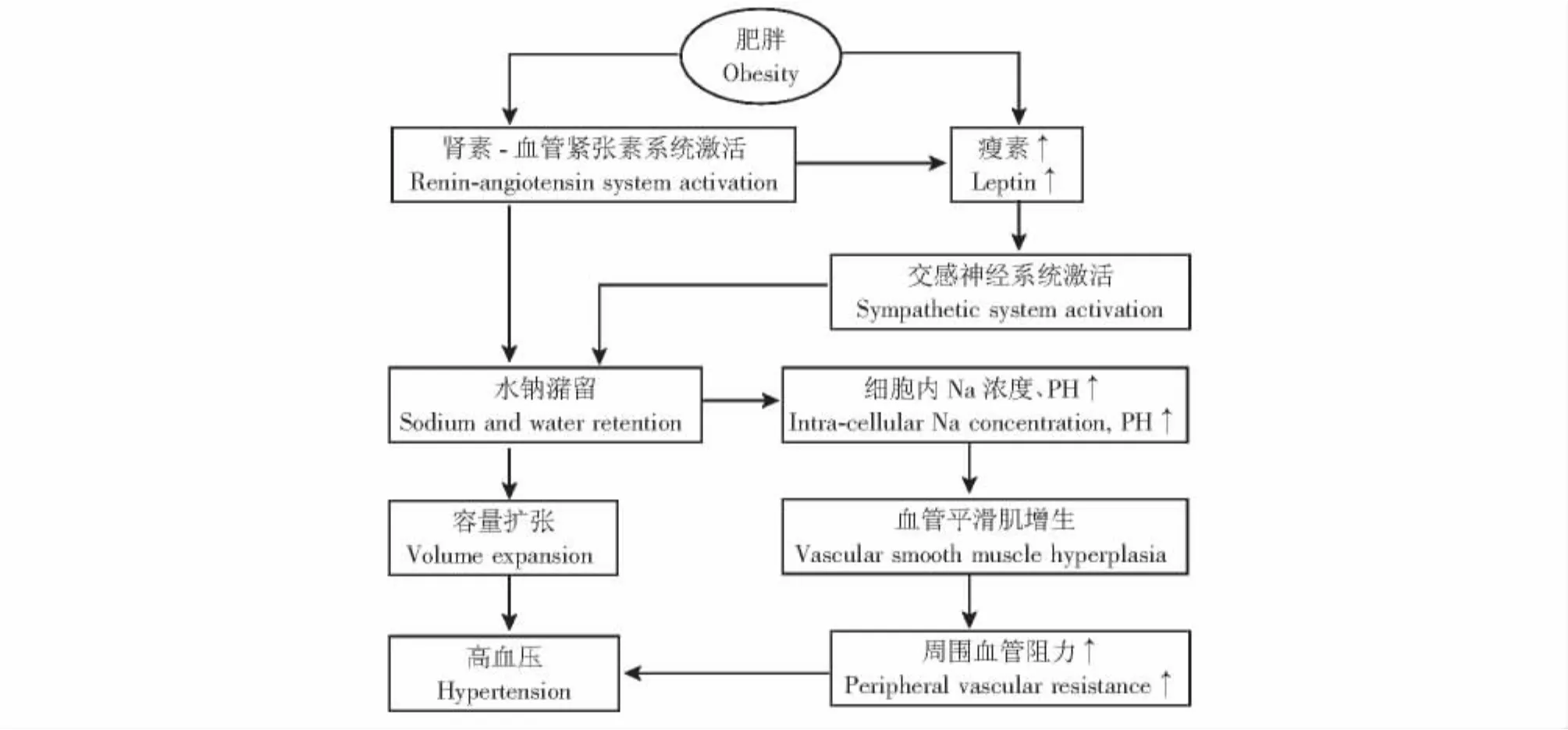
图1 肥胖相关高血压的发生机制Fig 1 Mechenisms of obesity-related hypertension
apnea,OSA)或低通气 (obstructive sleep hypoventilation,OSH),进而出现静息低氧-高碳酸血症。持续的低氧、高CO2可引起肺小动脉痉挛,久之形成肺动脉高压、右心室扩张及右心衰竭,还可加重全身血管内皮的氧化应激损伤,促进动脉粥样硬化斑形成及血管狭窄。此外,低氧血症还可刺激红细胞大量合成,使血液黏滞性升高,血流速度减慢,增加了心脑血管缺血性事件发生风险。Miller等[14]回顾了阻塞性睡眠通气障碍与循环系统受累之间的关系,发现患者血清中 C-反应蛋白 (C-reactive protein,CRP)和同型半胱氨酸含量升高,并且对于指示体内的炎症反应程度及心血管事件风险具有指导意义。
综上,肥胖患者因脂肪细胞扩增、分化可引发局部及循环血促炎症因子和致动脉粥样硬化调节因子增多、血管扩张和内皮保护因子减少。由于交感神经兴奋和RAS激活导致了高血压及低氧-高碳酸造成血管内皮的氧化应激损伤、血液黏滞度升高,都为冠状动脉不稳定斑块的形成与破裂创造了条件,以致早发冠心病和重症急性冠状动脉综合征 (acute coronary syndrome,ACS)而需急诊介入治疗 (percutaneous coronary interventions,PCI)的比例明显升高。据统计,北京协和医院心内科因急性心肌梗死 (acute myocardial infarction,AMI)行 PCI治疗的患者中,70%以上为超重或肥胖,而其中大多数年龄不超过65岁。2001年至2007年,Madala等[15]回顾性分析了189 065例ACS患者的BMI与非ST段抬高型心肌梗死(non-ST segment elevation myocardial infarction,NSTEMI)初发年龄之间的关系,结果显示两者呈显著负相关,即随着肥胖程度增加 (BMI分别为25.1~30.0、30.1~35.0、35.1~40.0和 >40.0 kg/m2),初发NSTEMI的时间分别较 BMI 18.6~25.0 kg/m2的患者提前了3.5、6.8、9.4和12.0年。此外,由于肥胖尤其是合并代谢综合征者对于传统二联抗血小板治疗的敏感性降低,使得支架术后的二级预防受到限制[16-17],在血压、血脂、炎症反应等危险因素得不到良好控制的情况下,极易出现近、远期的再狭窄。因此通常情况下患者的BMI越高则冠心病治疗效果越不理想[18]。然而近年来也有部分学者提出所谓肥胖悖论 (obesity paradox),即某些临床试验显示,冠心病患者的BMI升高与临床治疗的总体预后良好具有相关性[19-20],但目前并未找到可靠的理论依据。研究者认为其原因可能在于肥胖患者的平均年龄较小,可接受的治疗侵入性及根治意义较强,肥胖、高血压等危险因素控制后收效更显著。
肥胖对于心脏、血管的改变还远不仅此。多因素慢性作用可引发心脏的结构和功能缺陷、电生理异常,并影响综合预后。Park等[21]对2540名既往无任何心血管病史的肥胖患者按照BMI及其他合并症分组,并分别进行超声心动图(ultrasound cardiogram,UCG)、组织多普勒成像(tissue doppler imaging,TDI)、颈动脉超声及脉搏波传导速度 (pulse wave velocity,PWV)的检查。多因素分析显示,肥胖 (BMI≥25 kg/m2)以及超重 (BMI 23~24.9 kg/m2)且合并代谢综合征的患者与体重正常者 (BMI<23 kg/m2)相比,左心室质量指数 (left ventricular mass index,LEMI)增大,心脏结构及功能出现明显异常,颈总动脉内膜增厚,肱踝PWV增大,因此该研究认为,BMI异常升高可破坏心血管的结构及功能,代谢紊乱则可加速该进程。Mattioli[22]提出肥胖与房颤及心功能衰竭关系密切,Mathieu[23]则指出高LDL水平易造成狭窄主动脉瓣的炎症反应,加速心功能衰竭进展,还可导致机械瓣的早期损坏。Kuduvalli等[24]从外科角度证实肥胖冠心病患者行冠状动脉搭桥术(coronary artery bypass grafting,CABG)后出现并发症的概率增加。
另据调查显示,肥胖合并心脏受累的人群中男性占大多数,大众研究对于女性患者缺乏代表性,于是部分学者单独针对女性肥胖病例做了多方面深入研究。Basili等[25]以尿血栓素代谢物作为血小板激活的非损伤性指数,对40例肥胖和20例非肥胖健康妇女进行了横向对比研究,证实胰岛素抵抗是肥胖妇女血小板激活的决定因素,与冠心病血栓形成密切相关。Dokras等[26]前瞻性研究了多囊卵巢综合征 (poly cystic ovary syndrome,PCOS)与早期动脉粥样硬化生化指标的关联性,结果证实PCOS妇女血管功能紊乱及血栓高发由肥胖和胰岛素抵抗导致,而并非雄激素过多。Mizia-Stec等[27]通过对肥胖女性与正常女性的调查对比发现,单纯性肥胖可导致肱踝PWV明显降低和血管硬化,成为女性高血压、冠心病的重要危险因素。可见,肥胖带来的心血管效应对女性更为显著。
心血管损伤与减重
研究证实,BMI的下降可明显降低交感神经系统及RAS活性[28],减轻炎症反应和胰岛素抵抗,改善肥胖及代谢综合征患者的心脏疾病预后。根据肥胖本质,减重的意义在于限制高糖及油脂类食物带来的能量摄入,加强锻炼增加能量去向。近年来,以蔬菜、水果、干果、深海鱼和橄榄油为主的地中海饮食已被证实能显著降低心血管疾病及某些癌症的发生率[29],ω3长链多不饱和脂肪酸的应用对预防心血管病的意义也越发受到重视[30],而长期进行中等强度的有氧运动对心血管功能的改善已成为共识[31]。然而,对于大多数肥胖患者而言,单纯依靠节食和运动减重是极其艰难的。目前主要的辅助手段为药物和胃减容术。手术减重原理在于使患者在进食后迅速产生饱胀感以抑制食欲,从而达到减少用药,增强效果的目的,但对患者的要求较高,需要较好的心、肺功能,以及对麻醉、插管的高耐受力,因此主要适用于年轻人群。其他多数患者适于选用药物方式,目前市场上减重降脂的药物主要分为两类:(1)肠道脂肪吸收抑制剂,如奥利司他;(2)中枢神经系统食欲抑制剂,如芬氟拉明、西布曲明。2010年公布的心血管安全性随机双盲对照试验SCOUTs研究结果显示,在对近10 000例患者为期3.4年的随访中,已经存在心血管高危因素的肥胖患者使用西布曲明可使主要终点事件 (包括非致死性心肌梗死、非致死性脑卒中、心脏骤停复苏等)的风险增加16%[32]。因此,西布曲明被宣布撤出市场,我国食品药品监督管理局也在2010年宣布停止该药的生产和临床使用。由此可见,肥胖症与心血管疾病的发展与治疗存在相互作用的关系,只有减重降脂才能消除炎症根源、重建血管保护屏障;而心血管疾病则限制了减重方法的选择,严重影响疾病的综合预后。
总之,从脂肪堆积的第一刻起,机体便陷入了自我强化的炎症反应链,并且难以避免地通向心血管损伤的终点。因此,肥胖预防应从儿童期开始,以降低成年血脂水平,减少相关并发症。对于超重人群,则应及时制定合理的减重计划,减少体脂含量,达到风险最小化。而已经出现并发症或循环系统受累者,在减肥同时还应配合阿司匹林、RAS系统抑制剂、他汀类等心血管保护性药物,以减轻炎症,抑制重构,改善功能。故而对于心血管疾病而言,无论是Ⅰ、Ⅱ级预防还是对症治疗,控制体重、减低体脂都是获得良好预后的关键。
[1]Wu YF,Ma GS,Hu YH,et al.The current prevalence status of body overweight and obesity in China:data from the China National Nutrition and Health Survey [J].Zhonghua Yu Fang Yi Xue Za Zhi,2005,39(5):316-320.
[2]Whitlock G,Lewington S,Sherliker P,et al.Body-mass index and cause-specific mortality in 900 000 adults:collaborative analyses of 57 prospective studies [J].Lancet,2009,373(9669):1083-1096.
[3]Damia G,Mascheroni D,Croci M,et al.Perioperative changes in functional residual capacity in morbidly obese patients[J].Br J Anaesth,1988,60(5):574-578.
[4]Rocha VZ,Folco EJ.Inflammatory concepts of obesity[J].Int J Inflam,2011,2011:529061.
[5]Shoelson S,Herrero L,Naaz A.Obesity,inflammation,and insulin resistance[J].Gastroenterology,2007,132(6):2169-2180.
[6]Chawla A,Nguyen K,Goh Y.Macrophage-mediated inflammation in metabolic disease [J].Nat Rev Immunol,2011,11(11):738-749.
[7]Schorr U,Blaschke K,Turan S,et al.Relationship between angiotensinogen,leptin and blood pressure levels in young normotensive men[J].J Hypertens,1998,16(10):1475-1480.
[8]Dahlöf B,Devereux RB,Kjeldsen SE,et al.Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study(LIFE):a randomised trial against atenolol[J].Lancet,2002,359(9311):995-1003.
[9]Julius S,Kjeldsen SE,Weber M,et al.Outcomes in hypertensive patients at high cardiovascular risk treated with regimens based on valsartan or amlodipine:the VALUE randomised trial[J].Lancet,2004,363(9426):2022-2031.
[10]U.K.Prospective Diabetes Study 27.Plasma lipids and lipoproteins at diagnosis of NIDDM by age and sex[J].Diabetes Care,1997,20(11):1683-1687.
[11]Shimabukuro M,Higa N,Asahi T,et al.Hypoadiponectinemia is closely linked to endothelial dysfunction in man[J].J Clin Endocrinol Metab,2003,88(7):3236-3240.
[12]Kim JA,Montagnani M,Koh KK,et al.Reciprocal relationships between insulin resistance and endothelial dysfunction:molecular and pathophysiological mechanisms [J].Circulation,2006,113(15):1888-1904.
[13]Aróstegui JI.Pathophysiological mechanisms underlying cryopyrin-associated periodic syndromes:genetic and molecular basis and the inflammasome[J].Med Clin(Barc),2011,136(Suppl 1):22-28.
[14]Miller M.Association of inflammatory markers with cardiovascular risk and sleepiness[J].J Clin Sleep Med,2011,7(Suppl 5):S31-S33.
[15]Madala MC,Franklin BA,Chen AY,et al.Obesity and age of first non-ST-segment elevation myocardial infarction[J].J Am Coll Cardiol,2008,52(12):979-985.
[16]Feher G,Koltai K,Alkonyi B,et al.Clopidogrel resistance:role of body mass and concomitant medications[J].Int J Cardiol,2007,120(2):188-192.
[17]Coccheri S.Antiplatelet drugs—do we need new options?With a reappraisal of direct thromboxane inhibitors [J].Drugs,2010,70(7):887-908.
[18]Powell BD,Lennon RJ,Lerman A,et al.Association of body mass index with outcome after percutaneous coronary intervention[J].Am J Cardiol,2003,91(4):472-476.
[19]Mehta L,Devlin W,Mccullough PA,et al.Impact of body mass index on outcomes after percutaneous coronary intervention in patients with acute myocardial infarction[J].Am J Cardiol,2007,99(7):906-910.
[20]Oreopoulos A,Mcalister FA,Kalantar-Zadeh K,et al.The relationship between body mass index,treatment,and mortality in patients with established coronary artery disease:a report from APPROACH[J].Eur Heart J,2009,30(21):2584-2592.
[21]Park J,Kim SH,Cho GY,et al.Obesity phenotype and cardiovascular changes[J].J Hypertens,2011,29(9):1765-1772.
[22]Mattioli AV.Lifestyle and atrial fibrillation[J].Expert Rev Cardiovasc Ther,2011,9(7):895-902.
[23]Mathieu P.Abdominal obesity and the metabolic syndrome:a surgeon's perspective[J].Can J Cardiol,2008,24(Suppl D):19D-23D.
[24]Kuduvalli M,Grayson AD,Oo AY,et al.Risk of morbidity and in-hospital mortality in obese patients undergoing coronary artery bypass surgery [J].Eur J Cardiothorac Surg,2002,22(5):787-793.
[25]Basili S,Pacini G,Guagnano MT,et al.Insulin resistance as a determinant of platelet activation in obese women[J].J Am Coll Cardiol,2006,48(12):2531-2538.
[26]Dokras A,Jagasia DH,Maifeld M,et al.Obesity and insulin resistance but not hyperandrogenism mediates vascular dysfunction in women with polycystic ovary syndrome[J].Fertil Steril,2006,86(6):1702-1709.
[27]Mizia-Stec K,Gasior Z,Zahorska-Markiewicz B,et al.The indexes of arterial structure and function in women with simple obesity:a preliminary study[J].Heart Vessels,2008,23(4):224-229.
[28]Engeli S,Bohnke J,Gorzelniak K,et al.Weight loss and the renin-angiotensin-aldosterone system [J].Hypertension,2005,45(3):356-362.
[29]Miller ER 3rd,Erlinger TP,Young DR,et al.Results of the diet,exercise,and weight loss intervention trial(DEWIT)[J].Hypertension,2002,40(5):612-618.
[30]Abeywardena MY,Patten GS.Role of ω3 Longchain polyunsaturated fatty acids in reducing cardio-metabolic risk factors [J].Endocr Metab Immune Disord Drug Targets,2011,11:232-246.
[31]Blumenthal JA,Sherwood A,Gullette EC,et al.Exercise and weight loss reduce blood pressure in men and women with mild hypertension:effects on cardiovascular,metabolic,and hemodynamic functioning [J].Arch Intern Med,2000,160(13):1947-1958.
[32]Blumenthal JA,Thyrum ET,Gullette ED,et al.Do exercise and weight loss reduce blood pressure in patients with mild hypertension [J].N C Med J,1995,56(2):92-95.
Obesity and Cardiovascular Diseases
ZHAO Qing,ZHANG Shu-yang
Department of Cardiology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
ZHANG Shu-yang Tel:010-69155066,E-mail:shuyangzhang103@yahoo.com.cn
Obesityis becoming increasingly prevalent and thus has been a global public concern.Studies have demonstrated that obesity and its complications can cause an early onset of cardiovascular diseases(CVD),reduce the therapeutic effecacy of medical and invasive treatment,and thus increase the mortality.Meanwhile,it can also cause damage to the structure,electrophysiology,and myocardial function of heart.It can be a particularly important issue for women.On the other hand,heart injury can also affect the weight loss options and their outcomes.This article elucidates the relationship between obesity and its complications and CVD,and meanwhile proposes some new perspectives about the prevention of CVD.
obesity;insulin resistance;cardiovascular disease
Acta Acad Med Sin,2012,34(4):431-436
张抒扬 电话:010-69155066,电子邮件:shuyangzhang103@yahoo.com.cn
R58
A
1000-503X(2012)04-0431-06
10.3881/j.issn.1000-503X.2012.04.024
2011-09-28)
·论 著·
