近单分散介孔SiO2/Fe3O4/SiO2微球的制备及漆酶固定化
2012-01-10王苗苗李群艳聂祚仁
王苗苗,李群艳,韦 奇,聂祚仁
(北京工业大学材料科学与工程学院,北京,100124)
近单分散介孔SiO2/Fe3O4/SiO2微球的制备及漆酶固定化
王苗苗,李群艳,韦 奇,聂祚仁
(北京工业大学材料科学与工程学院,北京,100124)
以自制近单分散、平均粒径约为250 nm的SiO2亚微球为核心,采用液相沉积法得到β-FeOOH/SiO2微球,再通过溶胶-凝胶法以β-FeOOH/SiO2微球为内核,十六烷基三甲基溴化铵(CTAB)为模板剂,正硅酸乙酯(TEOS)为硅源,经水解缩聚反应,焙烧后得到近单分散介孔SiO2/Fe3O4/SiO2微球,以复合微球为载体,对漆酶进行固定。结果表明,近单分散介孔SiO2/Fe3O4/SiO2复合微球的介孔层厚约40 nm,具有较大的饱和磁化强度(14.715 emu/g),较小的剩余矫顽力(约为109 Oe),其比表面积为391.067 m2/g,孔容为0.53 cm3/g,孔径分别在5.43 nm和20~80 nm, 呈现双孔径分布。复合微球吸附漆酶后,介孔材料的比表面积与孔容分别减小为103 m2/g和0.37 cm3/g,复合微球对漆酶的吸附量为202.6 mg/g。
介孔二氧化硅 纳米 漆酶 固定化
漆酶是一种含铜的多酚氧化酶[1],具有相当广泛的底物专一性和较好的稳定性,因此漆酶在生物传感器、治理含酚废水和工业废水方面有着巨大的应用前景[2,3]。由于漆酶溶于水,不易回收利用,在实际的生产应用中受到限制。为了避免游离酶在工业应用中的缺点,Forde等[4]将漆酶成功地固定于介孔材料内,不仅提高酶的固定量及活性,还提高了它的稳定性及对环境适应能力,在生产中得到了更广泛的应用。Na等[5]成功地将微过氧化物酶固定于有机官能化修饰后的大孔径PMOs介孔孔道内,显著提高了微过氧化物酶的固定量。目前,越来越多的研究者将介孔材料作为固定生物酶分子的优良载体[6-9]。近年来,纳米磁性介孔材料在多相催化、化学传感器、生物分离、药物的靶向传输和生物医药等研究领域展现出传统无机多孔材料与之无法比拟的优越性和广阔的应用前景,成为固定化酶的优良载体[10-14]。磁性介孔二氧化硅材料的制备方法主要有三种:一种是原位法[15,16],方法简单,耗时少,但是制备过程中对复合材料微观结构的调控性差,难以有效控制材料的磁性能和介孔性能;第二种是两步法[17],这种方法制备的磁性介孔二氧化硅材料往往存在不均匀、铁和硅结合力差等缺点;第三种是核-壳结构法[18],在制备好的磁性颗粒表面上,通过硅源反应得到磁性介孔二氧化硅材料。核-壳结构法制备的磁性介孔二氧化硅材料避免了前两种方法的缺点,越来越多地应用于磁性介孔二氧化硅材料的制备。前期工作以自制的单分散 SiO2为核心[19],得到一种新型结构的介孔SiO2/Fe3O4中空磁性微球,该介孔磁性复合微球具有可调的孔径、可控的磁性,尺寸均一及无生理毒性的特点,并且Fe3O4纳米结构具有超顺磁性能,有利于颗粒的分离与再分散[20-22]。但是由于介孔SiO2/Fe3O4中空磁性微球中中空结构的存在,虽然复合微球具有低密度、高比表面积的优点,但是导致复合微球结构不稳定,容易坍塌破坏,将这种中空结构的磁性微球进一步应用到生物酶的固定存在数据重复性差等问题。本工作以具有尺寸均一、介孔层与磁性层独立可控、磁性能良好,且结构稳定的近单分散介孔 SiO2/Fe3O4/SiO2微球为载体材料,对漆酶进行固定化,考察了其对漆酶固定性能的影响。
1 实验部分
1.1 实验方法
以硅溶胶作为种子,在含有氨水和乙醇的水溶液中,通过TEOS的水解得到单分散的SiO2微球,以其为核心,采用液相沉积法在SiO2核心表面多次包覆β-FeOOH层,得到β-FeOOH/SiO2微球。其中,核心SiO2的颗粒尺寸为250 nm,二价铁盐FeCl2·4H2O的浓度为0.1 mol/L,体系的pH值为4.2,实验步骤见文献[19]。采用溶胶-凝胶法,对β-FeOOH/SiO2微球进行介孔SiO2的涂层。在实验过程中,以0.047 mol/L的CTAB为模板剂,0.053 mol/L的TEOS为硅源,在水溶液反应体系中,与0.108 mol/L的NaOH混合,经水解缩聚反应,得到介孔SiO2/β-FeOOH/SiO2沉淀,将沉淀在一定条件下焙烧,最终得到近单分散介孔SiO2/Fe3O4/SiO2微球,具体的实验步骤见文献[20]。
漆酶固定化实验:取10 mg制备的近单分散介孔SiO2/Fe3O4/SiO2微球与5 mL浓度为1 mg/mL的漆酶溶液在4 ℃的环境下搅拌12 h,离心,得到固定化漆酶的近单分散介孔SiO2/Fe3O4/SiO2微球样品。
1.2 漆酶活性的测定[23]
将一定体积的游离漆酶或固定化漆酶加入到等体积的1.0 mmol/L的ABTS溶液中,于25 ℃反应一定时间,冰浴终止反应,离心分离,采用紫外-可见分光光度计测定上清液在420 nm处吸光度的变化值,以此计算相应酶活。每分钟使每微摩尔的ABTS氧化所需的酶量为一个酶活单位,固定化酶活性用每克载体的酶活单位(U/g)表示。游离漆酶或固定化漆酶的相对活性是以在同组实验中将活性最高点的值记为100%,其余实验点的值与该点的值之比,通常以百分数表示。
1.3 样品表征
用JEM-2010型透射电子显微镜(TEM,工作电压为200 kV)观察样品的结构及包覆层厚度;采用日本岛津XRD-7000型X射线衍射(XRD)仪表征粉体的晶型结构;采用振动样品磁性计(HH-15)在室温下测试样品的磁性能;采用MicromeriticsASAP 2020比表面全自动物理吸附仪分析材料的吸附-脱附等温线,通过计算得到样品的比表面积、孔径和孔容;采用ThermoEvolution 600紫外分光光度计测定固定酶、游离酶的固定量及其活性。
2 结果与讨论
2.1 近单分散介孔SiO2/Fe3O4/SiO2微球的性能
单分散SiO2,β-FeOOH/SiO2和SiO2/Fe3O4/SiO2微球的TEM照片见图1。由图可知:SiO2微球单分散性很好,尺寸均一,约250 nm;SiO2微球进行两次β-FeOOH包覆后得到核壳结构β-FeOOH/SiO2微球(见图1(b)),此时,SiO2微球表面包覆层是由平均长度约为40 nm的β-FeOOH纳米棒搭建而成的三维网络结构,同时保持了与SiO2微球相同的单分散性。β-FeOOH/SiO2微球进行介孔二氧化硅包覆,并将近单分散介孔SiO2/β-FeOOH/SiO2微球在500 ℃进行焙烧,去除模板剂,继续将样品在H24%(体积分数)与96%Ar混合气体中还原2 h,得到近单分散介孔SiO2/Fe3O4/SiO2微球的TEM照片见图1(c)和(d)。由图可知,SiO2/Fe3O4/SiO2介孔复合微球依然保持了良好的单分散性,且颗粒尺寸较均匀,约320 nm,在介孔SiO2/Fe3O4/SiO2微球表面均匀包覆了无序介孔二氧化硅层。

图1 不同样品的TEM照片Fig.1 TEM images of different samples
图2为介孔SiO2/Fe3O4/SiO2微球样品的XRD图,图中的衍射峰位与Fe3O4(PDF卡号为65-3107)衍射峰位一致,因此,所制备的复合粒子不含任何杂相,具有纯的Fe3O4晶相。在衍射角为23°左右的宽峰来源于无定形SiO2壳层的衍射。
近单分散介孔 SiO2/Fe3O4/SiO2微球的室温磁滞回线见图3,该样品在所加磁场范围内基本达到饱和,复合磁性微球的饱和磁化强度为14.715 emu/g,左上角插图为磁滞回线的局部放大图,从图中可以看出该样品的矫顽力约为109 Oe,与解林艳等[20]制备得到的中空磁性介孔复合微球(饱和磁化强度为13.6 emu/g,矫顽力较大约为50 Oe)相比,饱和磁化强度相当,矫顽力有所增大。但将制备得到的近单分散介孔 SiO2/Fe3O4/SiO2微球分散在水中,施加一个永磁体后仍可以在30 s内完全富集,撤掉永磁体后,用手轻轻摇动容器,复合微球又可以迅速重新分散,可实现介孔复合微球在液体中的磁分离。
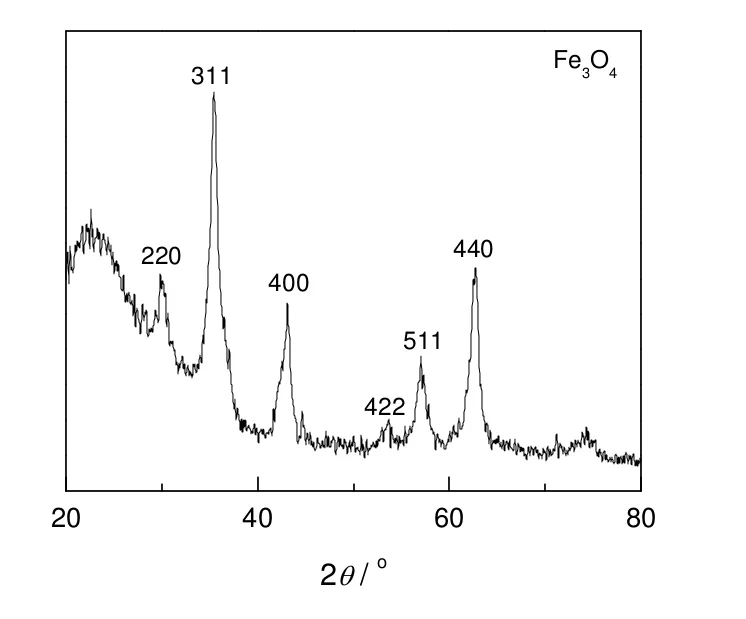
图2 去模板剂及还原气氛焙烧后样品的XRD图谱Fig.2 XRD pattern of mesoporous SiO2/ β-FeOOH/SiO2 microspheres after template removal and calcination in reducing atmosphere
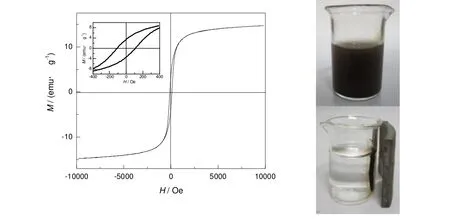
图3 介孔SiO2/Fe3O4/SiO2微球的室温磁滞回线及磁场分离效果照片Fig.3 Magnetic hysteresis loop of mesoporous SiO2/Fe3O4/SiO2 microspheres and the separation process of particles
2.2 近单分散介孔SiO2/Fe3O4/SiO2微球载体对漆酶吸附前后的孔结构
近单分散介孔SiO2/Fe3O4/SiO2微球吸附漆酶前后的等温曲线及其孔径分布图如图4所示。由图可知,近单分散介孔SiO2/Fe3O4/SiO2微球的吸附曲线属于第Ⅳ类等温线,在P/P0为0.35~0.45出现一个滞后环,氮气吸附量急剧增加,意味着孔尺寸较小,孔径分布较窄,在P/P0为0.8~1.0出现另一个滞后环,说明众多的小颗粒之间形成的二次孔结构及包覆在核心二氧化硅表面的由纳米棒搭接而成的不规则的孔结构。从孔径分布图(b)和(c)可以看出,在5.0 nm左右有一个很宽的孔径分布,并在20~80 nm内具有较宽、较低的孔径分布。表1为漆酶固定前后介孔SiO2/Fe3O4/SiO2微球的结构参数。由表可知,近单分散介孔SiO2/Fe3O4/SiO2微球的比表面积为391.067 m2/g,孔容为0.53 cm3/g。虽然与中空的介孔复合微球[20](比表面积为693 m2/g,孔容为0.63 cm3/g)相比,比表面积与孔容均有一定程度的减小。但是均大于普通的核壳结构介孔磁性材料[24,25]的比表面积(283 m2/g)和孔容(0.349 cm3/g),和“摇铃”状介孔磁性材料[26]的比表面积(436 m2/g)和孔容(0.53 cm3/g)数值相当。当漆酶分子进入介孔材料的孔道后,介孔材料的孔容和比表面积都有所下降,比表面积减小为103.288 m2/g,孔容减小为0.37 cm3/g,但复合微球的平均孔径增大。这是由于漆酶分子占据了介孔复合微球中较小的介孔孔道,介孔载体的孔径在5.43 nm处的分布比例极大减小,20~80 nm的孔径分布比例明显增加,导致复合微球的平均孔径增大。这说明漆酶分子占据了大部分孔径在5.00 nm左右的孔道,介孔SiO2/Fe3O4/SiO2磁性微球对漆酶进行了有效的吸附。这种近单分散介孔SiO2/Fe3O4/SiO2磁性微球的平均孔径为5.43 nm,大于漆酶的分子尺寸(6 nm×5 nm×4.5 nm),因此漆酶分子很容易进入到介孔 SiO2/Fe3O4/SiO2磁性微球的介孔孔道内,这证明孔容的减小程度与酶分子直径和孔径匹配程度有很大关系。
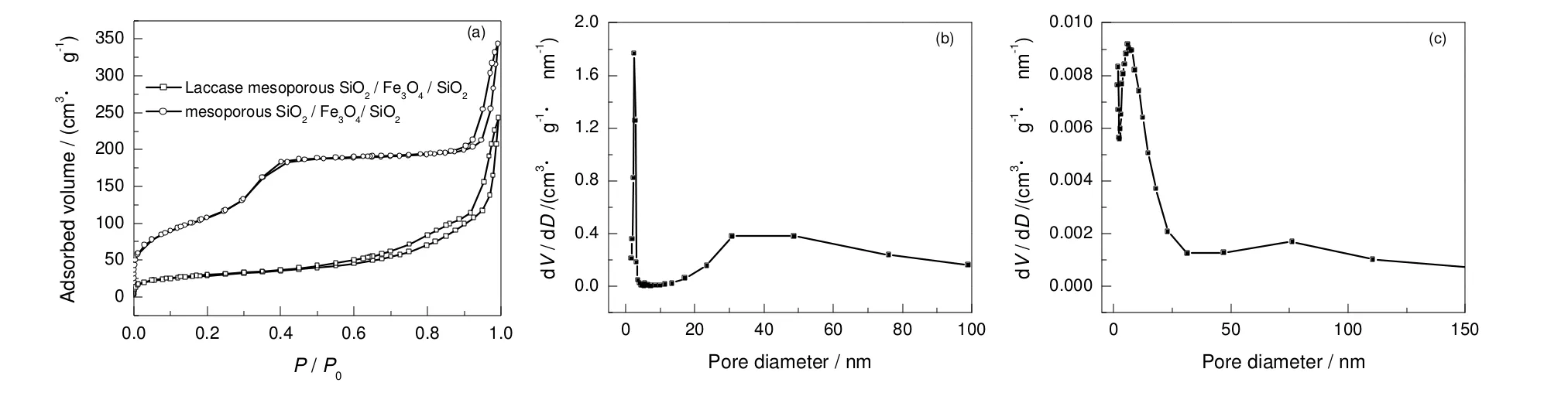
图4 介孔SiO2/Fe3O4/SiO2磁性微球吸附漆酶前后的N2吸附脱附曲线及孔径分布Fig.4 N2 absorption-desorption isotherms of mesoporous SiO2/Fe3O4/SiO2 microsphere and Laccase-mesoporous(a)-SiO2/Fe3O4/SiO2 microsphere; (b)-pore size distribution of mesoporous SiO2/Fe3O4/SiO2 microsphere;(c)-pore size distribution of Laccase-mesoporous SiO2/Fe3O4/SiO2 microsphere

表1 漆酶固定前后介孔SiO2/Fe3O4/SiO2磁性微球的结构参数Table 1 Structural parameters of mesoporous SiO2/Fe3O4/SiO2 microsphere and Laccase-mesoporous SiO2/Fe3O4/SiO2 microsphere
2.3 近单分散介孔SiO2/Fe3O4/SiO2微球固定化漆酶的吸附动力学
图5为近单分散介孔SiO2/Fe3O4/SiO2微球与自制的MCM-41介孔SiO2材料(比表面积为854.7 m2/g,孔容为0.642 cm3/g,平均孔径为3 nm)对漆酶的吸附量随时间的变化情况。由图可知,介孔SiO2/Fe3O4/SiO2磁性微球在2 h内,吸附速率较快,且吸附量急剧增加,随着时间的不断增加,载体对漆酶的吸附量也逐渐增大,当时间达到3 h后,载体对漆酶的吸附逐渐饱和,实验得到饱和吸附量(qe)为202.6 mg/g,达到吸附平衡状态。MCM-41介孔材料的吸附速率较慢,约5 h达到吸附平衡,对漆酶的最大吸附量qe为349.8mg/g。
介孔 SiO2/Fe3O4/SiO2微球的吸附动力学是根据吸附动力学模型对吸附进程及吸附结果进行分析,从而揭露物质结构与吸附性能之间的关系,对固定化酶的实际应用具有至关重要的影响。常用的吸附动力学模型是准二级动力学吸附速率模型(pseudo-second-order model),其方程式为:

对式(1)两边积分得到线性形式为:

式中:qe为平衡时的吸附量,mg/g;qt为t时间时的吸附量,mg/g;k为二级吸附速率常数,g/(mg·h)。以t/qt~t作图,结果见图 6。介孔磁性复合微球对漆酶吸附量的拟合直线为Y=2.612×10-4+5.12×10-3X,MCM-41介孔材料对漆酶吸附量的拟合直线为Y=1.88×10-3+2.76×10-3X,相关系数(R2)分别为 0.998和0.997,即所得两条曲线线性相关性较好,说明两种介孔材料对漆酶的吸附行为符合准二级动力学模型。由直线的斜率可得SiO2/Fe3O4/SiO2磁性微球对漆酶的最大吸附量qe为195.3 mg/g,与实验值202.6 mg/g相近,微球的二级吸附速率常数k为0.100 g/(mg·h),大于纯介孔材料MCM-41的二级吸附速率常数(0.004 g/(mg·h))。表明漆酶在复合微球中具有更快的吸附速率。这是由于MCM-41介孔材料的平均孔径较近单分散介孔SiO2/Fe3O4/SiO2微球的平均孔径5.43 nm小,漆酶分子较难进入MCM-41介孔材料的介孔孔道,因此MCM-41介孔材料对漆酶的吸附速率较慢。但是MCM-41介孔材料的比表面积与孔容较大,因此当材料达到吸附平衡时,单位质量的介孔材料 MCM-41所吸附的漆酶量较近单分散介孔SiO2/Fe3O4/SiO2微球多。
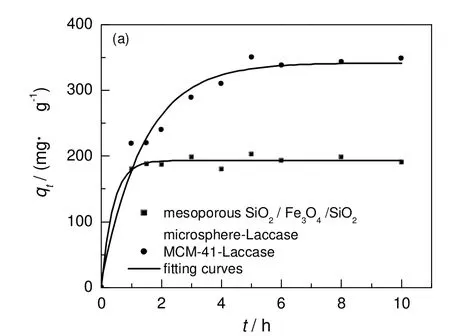
图5 漆酶在介孔SiO2/Fe3O4/SiO2微球载体和MCM-41上吸附量随时间变化情况Fig.5 Changes of laccase absorption on mesoporous SiO2/Fe3O4/SiO2 microsphere and MCM-4 with time
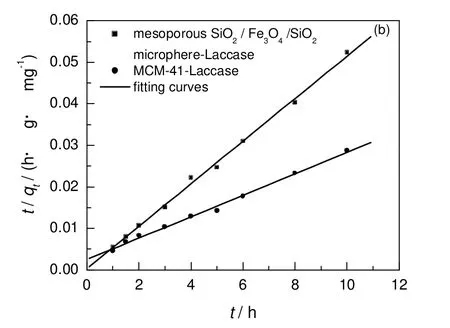
图6 t/qt与t的关系Fig.6 Relationship between t/qt and t
3 结 论
以单分散SiO2微球为核,β-FeOOH为壳,再以β-FeOOH/SiO2微球为内核,介孔SiO2为壳,制备的这种核壳结构的近单分散介孔SiO2/Fe3O4/SiO2微球,尺寸均一、可控,其磁化强度为14.715 emu/g,矫顽力约为 109 Oe,有利于介孔复合微球的再分散,在磁场的作用下,可实现药物的靶向运输及分离。近单分散介孔SiO2/Fe3O4/SiO2微球固定漆酶后,比表面积与孔容由391.067 m2/g,0.53 cm3/g分别减小为103 m2/g和0.37 cm3/g,介孔载体的孔径在5.0 nm左右的分布比例极大减小,说明介孔SiO2/Fe3O4/SiO2微球对漆酶进行了有效地吸附。近单分散介孔SiO2/Fe3O4/SiO2微球作为载体,对漆酶的固定量为202.6 mg/g,吸附速率大于纯介孔材料MCM-41。
[1]Thurston C F. The structure and function of fungal laccase[J]. Microbiology, 1994, 140(1): 19-26.
[2]王 华, 金大勇, 赵建夫. 真菌漆酶及其在环境污染控制中的应用[J]. 环境科学与技术, 2003, 26(4): 58-60.Wang H, Jin D Y, Zhao J F. Fungal laccases and their application to environmental pollution control[J]. Environ Science & Technol, 2003,26(4): 58-60.
[3]Abadulla E, Tzanov T, Costa S. Decolorization and detoxification of textile dyes with a laccase from trametes hirsuta[J]. Appl Environ Microb,2000, 66(8): 3357-3362.
[4]Forde J, Tully E, Vakurov A, et al. Chemical modification and immobilisation of laccase from trametes hirsuta and from myceliophtora thermophila[J]. Enz Mic Tec, 2010, 47(5): 241-241.
[5]Na W, Wei Q, Lan J N, et al. Effective immobilization of enzyme in glycidoxypropyl-functionalized periodic mesoporous organosilicas(PMOs)[J]. Micropor Mesopor Mater, 2010, 134(1-3): 72-78.
[6]郑旭翰. 漆酶在介孔材料上的固定化及性能研究[D]. 哈尔滨:哈尔滨理工大学, 2006.
[7]Na W, Wei Q, Zou Z C, et al. Mesoporous organosilicas with ultra-large pores: mesophase transformation and bioadsorpthion properties[J].J Colloid Interface Sci, 2010, 346(1): 61-65.
[8]Na W, Wei Q, Zou Z C, et al. Large pore 3D cubic mesoporous silica HOM-5 for enzyme immobilization[J]. Mater. Letters, 2008, 62(21-22):3707-3709.
[9]邹泽昌, 韦 奇, 纳 薇, 等. 氧化硅介孔泡沫材料固定木瓜蛋白酶的研究[J]. 无机材料学报, 2009, 24(4): 702-706.Zou Z C, Wei Q, NA, W., Sun, H., Nie, Z. R. Immobilization of Papain on Siliceous Mesocellular Foam[J]. Inorg Mater, 2009, 24(4): 702-706.
[10]Sen T, Bruce I J. Mesoporous silica-magnetite nanocomposites: Fabrication, characterisation and applications in biosciences[J]. Micropor Mesopor Mater, 2009, 120(3): 246-251.
[11]Dong J, Xu Z, Wang F. Engineering and characterization of mesoporous silica-coated magnetic particles for mercury removal from industrial effluents[J]. Appl Surf Sci, 2008, 254(11): 3522-3530.
[12]Zhang Z C, Zhang L M, Chen L, et al. Synthesis of novel porous magnetic silica microspheres as adsorbents for isolation of genomic DNA[J].Bio technol Prog, 2006, 22(2): 514-518.
[13]Yang H, Ou L W, Wimbrow A N, et al. Rapid detection of Listeria monocytogenes by nanoparticle-based immunomagnetic separation and real-time PCR[J]. Int Food Microbiol, 2007, 118(2): 132-138.
[14]Wu S H, Lin Y S, Chou Y H, et al. Multifunctional mesoporous silica nanoparticles for intracellular labeling and animal magnetic resonance imaging studies[J]. Chem Bio Chem, 2008, 9(1): 53-57.
[15]Wang Y G, Ren J W, Liu X H. Facile synthesis of ordered magnetic mesoporous γ-Fe2O3/SiO2nanocomposites with diverse mesostructures[J].J Colloid Interface Sci, 2008, 326(1): 158-165.
[16]Zhu S M, Zhou Z Y, Zhang D. Design and synthesis of delivery system based on SBA-15 with magnetic particles formed in situ and thermo-sensitive PNIPA as controlled switch[J]. Microporous Mecoporous Mater, 2007, 106(1-3): 56-61.
[17]朱慎林, 赵俊琦, 刁 香, 等. 磁性介孔氧化硅材料的制备与应用[J]. 石油化工, 2009, 38(8): 811-817.Zhu Shenlin, Zhao Junqi, Diao Xiang, et al. Preparation and applications of magnetic mesoporous silica[J]. Petrochemical Technology, 2009,38(8): 811-817.
[18]Zhao W R, Gu J L, Zhang L X, et al. Fabrication of uniform magnetic nanocomposite spheres with a magnetic core/mesoporous silica shell structure[J]. J Am Chem Soc, 2005, 127(25): 8916-8917.
[19]娄载亮, 李群艳, 王志宏, 等. 单分散α-Fe2O3纳米结构空心亚微球的制备及表征[J]. 高等学校化学学报, 2010, 31(6): 1098-1102.Lou Zailiang, Li Qunyan, Wang Zhihong, et al. Preparation and characterization of monodisperseα-Fe2O3nanostructured hollow submicrosphere[J]. Chem J Chinese Universities, 2009, 24(2): 345-348.
[20]解林艳, 李群艳, 王志宏, 等. 介孔SiO2/Fe3O4中空磁性复合微球的制备与表征[J]. 无机化学学报, 2010, 26(10): 1756-1760.Xie Linyan, Li Qunyan, Wang, Zhihong, et al. Preparation and characterization of Fe3O4/mesoporous SiO2hollow microsphere [J]. J Inorg Chem, 2010, 26(10): 1756-1760.
[21]Li Q Y, Wang R N, Wei Q, et al. Preparation of three-dimensional flowerlike Ni(OH)2nanostructures by a facile template-free solution process[J]. J Alloys Compd, 2010, 496: 300-305.
[22]Li Q Y, Wang R N, Wei Q, et al. Preparation and characterization of nanostructured Ni(OH)2and NiO thin films by a simple solution growth process[J]. J Colloid Interface Sci, 2008, 320(1-2): 254-258.
[23]兰甲宁, 纳 薇, 韦 奇, 等. 环氧基修饰周期性介孔有机氧化硅对漆酶的固定化作用[J]. 高等学校化学学报, 2010, 31(8): 1579-1584.Lan Jianing, Na Wei, Wei Qi, et al. Immobilization of Laccase on epoxy group-functionalized periodic mesoporous organosilicas[J]. Chem J Chinese Universities, 2010, 31(8): 1579-1584.
[24]Zhao W R, Gu L J, Zhang L X, et al. Fabrication of uniform magnetic nanocomposite spheres with a magnetic core/mesoporous silica shell structure[J]. J Am Chem Soc, 2005, 127(50): 8916-8917.
[25]Deng H Y, Qi W D, Deng C H, et al. Superparamagnetic high magnetization microspheres with an Fe3O4/SiO2core and perpendicularly aligned mesoporous SiO2shell for removal of microcystins[J]. J Am Chem Soc, 2008, 130(1): 28-29.
[26]Zhao W R, Chen H R, Li Y S, et al. Uniform rattle-type hollow magnetic mesoporous spheres as drug delivery carriers and their sustained-release property. Adv Funct Mater, 2008, 18(18): 2780-2788.
Monodisperse Mesoporous SiO2/Fe3O4/SiO2Microspheres: Preparation and Laccase Immobilization
Wang Miaomiao, Li Qunyan, Wei Qi, Nie Zuoren
(College of Materials Science and Engineering, Beijing University of Technology, Beijing 100124, China)
The home-made monodispersed SiO2microspheres with uniform size(250 nm) were coated withβ-FeOOH to prepareβ-FeOOH/SiO2microspheres by liquid deposition method. Then the SiO2/β-FeOOH/SiO2microspheres, prepared by coating a mesoporous silica layer on theβ-FeOOH/SiO2microspheres with sol-gel method, were calcinated and reduced to obtain the final mesoporous SiO2/Fe3O4/SiO2microspheres. The magnetic composited microspheres exhibited some good properties, such as high surface area (391.067 m2/g),large pore (0.53 cm3/g), high saturation magnetization (14.715 emu/g) and low coercivity (109 Oe). Furthermore the mesoporous SiO2/Fe3O4/SiO2microspheres were used as a carrier to immobilize the laccase. The surface area and the pore volume of the composite microsphereas decreased to 103 m2/g and 0.37 cm3/g, respectively, after immobilizing laccase. The adsorbance amount of laccase in mesoporous material was about 202.6 mg/g.
mesoporous silica; nanometer; laccase; immobilization
O611 文献标识码:A
1001—7631 ( 2012 ) 02—0122—07
2012-03-22;
2012-04-09
王苗苗(1986-),女,硕士研究生;李群艳(1974-),女,副教授,通讯联系人。E-mail: qyli@bjut.edu.cn
国家863计划课题(2009AA03Z213);国家自然科学基金项目(21171014)
