低温等离子体法直接分解硫化氢制氢的研究进展
2012-01-10王安杰
赵 璐,王 瑶,2,李 翔,2,王安杰,2
(1.大连理工大学精细化工国家重点实验室,辽宁 大连 116024;2.辽宁省高校石油化工技术与装备重点实验室,辽宁 大连 116024)
低温等离子体法直接分解硫化氢制氢的研究进展
赵 璐1,王 瑶1,2,李 翔1,2,王安杰1,2
(1.大连理工大学精细化工国家重点实验室,辽宁 大连 116024;2.辽宁省高校石油化工技术与装备重点实验室,辽宁 大连 116024)
总结了包括电晕放电、辉光放电、滑动弧光放电、微波等离子体、射频等离子体及介质阻挡在内的多种放电形式在分解硫化氢领域的研究现状。当前低温等离子体技术应用于硫化氢分解的研究仍停留于实验室阶段,实现工业应用仍有很多理论及工程问题有待解决。提高硫化氢转化率,降低产氢能耗将是该技术走向工业化和实用化的研究重点和方向。
硫化氢 分解 制氢 低温等离子体
硫化氢是一种剧毒、恶臭的无色气体,不仅会腐蚀金属等材料,而且会危害人体健康,污染环境,因此必须就地无害化处理。目前,硫化氢无害化处理常用的方法为克劳斯(Claus)法,即部分硫化氢燃烧生成二氧化硫,二氧化硫与硫化氢反应生成单质硫和水蒸气。该方法虽然实现了硫化氢的无害化处理,但从原子经济性来看,这种处理方法回收了低附加值的单质硫,却将宝贵的氢转化为水。随着我国高含硫原油加工量的增多,炼油厂用于脱硫的加氢精制单元副产的含硫化氢酸性尾气量逐年增加,处理硫化氢所需的氢气用量也随之增加。目前氢气主要通过烃类重整反应制得,在生产氢气的同时会排放大量二氧化碳。硫化氢直接分解,不仅可以使其无害化,得到高附加值的氢气和可利用的单质硫,而且可以减少制氢带来的二氧化碳排放。硫化氢分解制氢的方法主要有热分解法[1-3]、电化学法[4-6]、光催化法[7-9]和低温等离子体法[10]等。由于硫化氢的热分解反应受热力学平衡限制,所以即使在高温下的平衡转化率也很低,而电化学法与光催化法存在操作步骤多、反应效率低和能源消耗高等缺点。同上述方法相比,低温等离子体法操作简单,能量效率高,反应具有高度的可控性,能在大范围内调节气体流速和组成。此外,由于其高能量密度,可缩短反应时间,实现在较低温度下硫化氢的有效分解,适合于不同规模,布局分散,生产条件多变等场合。
1 等离子体的基本原理和分类
等离子体被称为除固态、液态和气态之外的第四种物质存在形态,是由大量的电子、离子、中性原子、激发态原子、光子和自由基等组成的导电性流体,因正电荷和负电荷电量相等故而宏观上呈现出电中性。等离子体一般分为高温等离子体(主要核能相关)和低温等离子体(含热等离子体-近平衡态和冷等离子体-非平衡态)。由于低温等离子体拥有高电子能量和较低的离子及气体温度,这一非平衡特性对于促进化学反应十分有效,因此在各个领域有着广泛的用途。
目前常用的低温等离子体主要包括电晕放电(corona discharge)、辉光放电(glow discharge)、火花放电(spark discharge)、介质阻挡放电(dielectrical barrier discharge)、滑动弧光放电(gliding arc discharge)、微波等离子体(microwave plasma)以及射频等离子体(radio-frequency plasma)等[11]。
本工作介绍了硫化氢在低温等离子体下分解的基本原理和不同放电形式下的低温等离子体分解硫化氢制氢的研究进展。
2 低温等离子体分解硫化氢制氢的基本原理
因为在等离子体条件下的化学反应复杂多变,且活性粒子运动具有随机性,研究其反应过程的难度大大增加。国内外科研工作者通过原子发射光谱和计算机模拟等手段探索了等离子体分解硫化氢的反应过程[10,12,13]。主要存在的反应见式(1)~(8),可以看出:H2S分子首先在放电区内各种激发态粒子M作用下裂解生成H自由基与HS自由基,H自由基同H2S分子、HS自由基或H自由基发生反应生成H2,而HS自由基之间又可以相互作用得到H2和S2,也可通过式(6)和(7)两步反应生成产物H2和S2;当放电区温度较低时,常常会发生S2分子的聚合反应(8)。

等离子体条件下化学反应实质是通过不同形式的气体放电,在外电场作用下产生空间富集的电子、离子、激发态原子、分子以及自由基等粒子,这些活性粒子之间会发生各种化学反应生成新的化合物。由于等离子体中高能电子对这些活性粒子的产生起了决定作用,能量效率又是制约这些等离子体转化过程的关键因素。为此,通过采用不同的放电形式、合理配置放电结构、优化反应条件以及引入适宜的催化剂等来提高能量效率,降低产氢能耗已成为等离子体分解硫化氢制氢研究中的重点。
3 不同放电形式下的低温等离子体分解硫化氢制氢研究进展
3.1 电晕放电(corona discharge)等离子体
如图1所示,电晕放电常采用非对称电极,高电场强度集中在曲率半径小的区域且更易发生气体电离,可在常压条件下形成电晕。电晕放电类型有多种形式,其中脉冲电晕等离子体(PPCP)是20世纪80年代中期兴起的一种新型低温等离子体,适于常压操作。
Helfritch[14]以线管式脉冲电晕放电等离子体反应器研究了硫化氢分解反应,考察了反应管内径尺寸,硫化氢浓度(氢气为平衡气)以及放电功率等因素对反应的影响,发现利用电晕放电等离子体可有效分解硫化氢,且放电功率大小是影响硫化氢转化率的主要因素。与处理静态气体相比,在处理动态气体时的能量效率更高,且减小反应管内径也能提高反应的能量效率。
Zhao等[15]利用脉冲电晕放电等离子体反应器进行硫化氢分解制氢研究,由于纯硫化氢气体具有高绝缘强度(比空气的绝缘强度高约2.9倍),即使在高达30 kV放电电压条件下,仍难以保持稳定、均匀地放电。当加入绝缘强度较低的气体(如氩气、氦气、氮气、氢气)稀释硫化氢时,稳定放电电压显著降低,而且单原子气体(氩气和氦气)比双原子气体(氮气和氢气)作为稀释气时硫化氢转化效率更高,但在该放电体系下的产氢能耗相对较高,其最低产氢能耗约为17 eV。
John等[16]采用线管式脉冲电晕等离子体反应器,通过改变电功率、脉冲成形电容、放电电压和脉冲频率,考察了硫化氢分解的转化率和能量效率。当电功率为100 W,在低脉冲成形电容、低放电电压和高脉冲频率条件下可以达到最高的能量效率。在以H2S,Ar和N2作为反应气(三种气体体积分数分别为8%,46%和46%),电功率60 W,脉冲成形电容720 pF条件下所需产氢能耗最低,约为4.9 eV,但此时硫化氢转化率仅为30%左右。
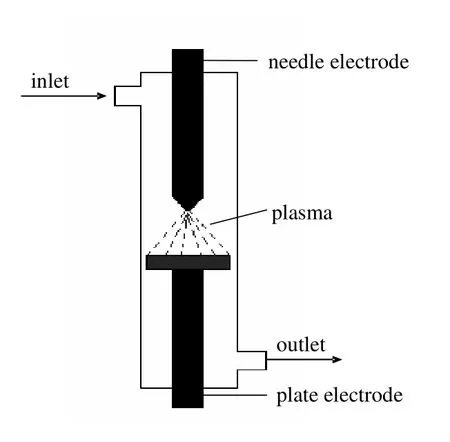
图1 电晕放电示意Fig.1 Schematic diagram of corona discharge
3.2 辉光放电(glow discharge) 等离子体
图2为辉光放电等离子体示意图。辉光放电是一种稳定的自持放电,与电晕放电等离子体相比,辉光放电具有更高的放电电流,同时产生的辉光扩展到两电极之间的整个放电空间,发光明亮,是低温等离子体化学领域广泛采用的一种放电形式。
Traus等[17]利用常压下辉光放电等离子体研究了硫化氢分解制氢反应,两个同心电极处在轴向电场中形成旋转放电,电极材料是无磁性不锈钢,通过循环油加热外部电极以使整个反应温度控制在120 ℃以上,从而保证了分解得到的硫为液态且具有较低黏度。在硫化氢初始浓度10%~100% (以氢气或氩气作为平衡气),气体流量为100 mL/min,外电极温度170 ℃,电功率45~75 W,放电间隙3.5 mm,磁线圈电流5~10 A下进行了一系列硫化氢分解反应实验,发现硫化氢转化率为17%~40%,最低产氢能耗为19 eV。

图2 辉光放电示意Fig.2 Schematic diagram of glow discharge
3.3 滑动弧光放电(gliding arc discharge) 等离子体
如图3所示,和常规的低温等离子体不同,滑动弧光等离子体是一种非稳态的放电等离子体,它产生于气体流经两分开电极的最小间距处。它是一种能量利用率较高的低温等离子体,可达到高电子温度和高电子密度,在化工应用中具有独特的优势。
Dalaine等[18,19]利用滑动弧光放电等离子体研究了硫化氢分解反应,反应气中硫化氢含量为150 mg/m3,硫化氢分解能耗高达500 eV。Nunnally等[20,21]利用旋风滑动弧光放电等离子体反应器进行纯硫化氢气体分解制氢的研究,发现该反应器延长了硫化氢气体的停留时间,且在等离子体中心区域内进行对流传热传质,使反应区与器壁几乎完全隔热,而且在放电过程中由于旋转气流所产生的离心作用使生成的硫原子簇迅速脱离反应区,从而起到猝灭逆反应的作用,提高了硫化氢转化率,此外,降低反应体系的压力有利于硫化氢分解。
3.4 微波等离子体(microwave plasma)
如图4所示,微波等离子体是通过微波放电发生器使气体电离而产生的,一般采用的频率较高,可在较宽的频率和压力范围内操作,生成均匀的、较大体积的低温等离子体。如果微波功率为千瓦级,微波等离子体中的电子密度可接近等离子体频率所确定的临界密度,比一般放电提供更高的电离度和离解度。
Bagautdinov等[22-24]采用微波等离子体反应器研究了硫化氢分解制氢,产氢能耗为0.5~1.0 eV。在实验室研究的基础上建立了微波等离子体中试装置,该装置功率达到1 MW,进料气为硫化氢和二氧化碳的混合气(两者物质的量之比约为0.5~0.6)时,气体流量达到每小时数千立方米,在装置运行过程中,高气速产生的强离心作用起到了分离出产物硫的作用,进而降低了产氢能耗[25]。随着功率增大,反应器内压力由0.03 MPa增至0.10 MPa左右,产氢能耗为1.1~1.4 eV。加拿大Alberta氢研究规划署、原子能署和壳牌有限公司合资建立了类似装置,但能耗相对较高,产氢能耗约4.5 eV[26]。
Harkness等[27]估算了采用微波等离子体反应器分解硫化氢制氢时的产氢能耗,并研究了硫化氢中二氧化碳、水蒸气和甲烷对硫化氢转化率及产氢能耗的影响,发现含有杂质气体时,反应放电的稳定性提高,产氢能耗降低,而且水蒸气可以提高产氢量。
董永治等[28]使用改进型微波等离子体反应器在常压下进行分解硫化氢制氢的实验研究。实验装置主要由进料系统、矩形共振腔反应器系统和分析系统组成,他们通过对反应器腔体形状的优化,进一步将腔体内电场分布集中在硫化氢气体入口处,从而使其更容易离解而生成等离子体,提高了能量效率。在选取腔体狭缝宽度为10 mm时,以H2S和Ar的混合气(两种气体体积分数分别为5%和95%)作为反应气,进气流量为300 mL/min时,产氢率为14.6 mL/min,硫化氢的转化率达到97.3%,但其产氢能耗高达59 eV。
3.5 射频等离子体(radio-frequency plasma)
图5为射频等离子体反应器示意图,射频放电通常在低压下操作,工作频率为1~100 MHz,其优点是放电气体可以不与电极接触。有关射频等离子体反应器应用于硫化氢分解的报道较少。Krasheninnikov等[29]将射频等离子体放电技术应用于硫化氢分解制氢反应。在压力700~900 Pa,电功率0.6~2 kW,气体流量9~24 L/min的条件下经过多级射频等离子体反应器处理,实验所能达到的最低产氢能耗为1 eV。尽管在高能耗下硫化氢的转化率可以接近100%,但极低的操作压力在实际应用中难以实现,且不宜进行高气速的处理。
3.6 介质阻挡放电等离子体
介质阻挡放电是有绝缘介质插入放电空间的一种气体放电,又称无声放电。这种放电分布均匀、弥散和稳定,通常放电空间的气体压强可达1×105Pa或更高。如图6所示,介质阻挡放电反应器主要包含高压电极、电介质和接地极三部分。电介质的存在避免了放电过程中电弧的生成,这对产生大体积稳定的等离子体非常有利。
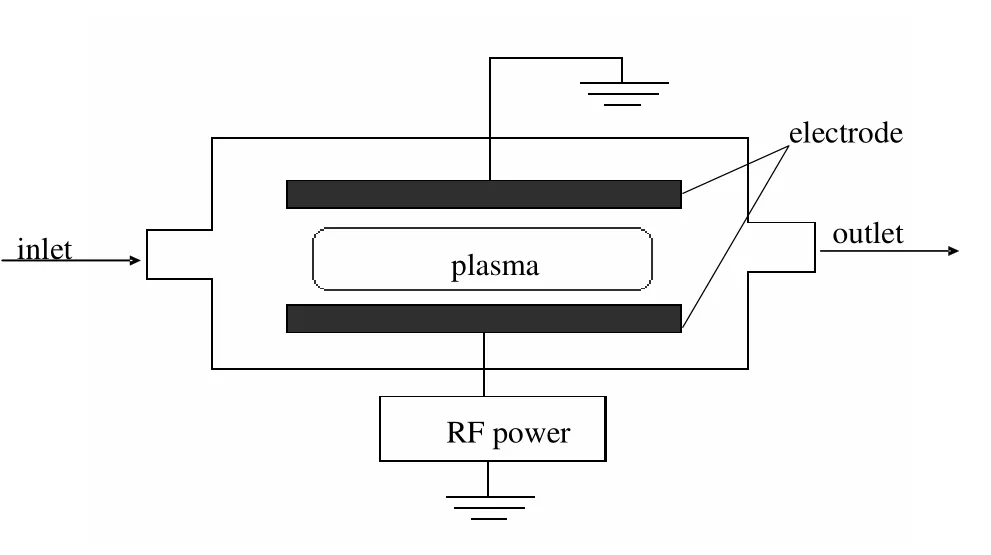
图5 射频等离子体示意Fig.5 Schematic diagram of radio-frequency plasma

图6 介质阻挡放电示意Fig.6 Schematic diagram of dielectrical barrier discharge
Traus等[30]将改进的臭氧发生器应用于硫化氢分解,考察了操作温度,气体流量,输入电压,硫化氢进料浓度,以及不同平衡气等对硫化氢分解制氢反应的影响,发现硫化氢转化率为 0.5%~12%,最低产氢能耗约50 eV。
Subrahmanya等[31]采用介质阻挡放电反应器,以具有催化活性的烧结金属纤维作为内电极,研究注入能量密度,放电频率和气体停留时间对硫化氢分解的影响,发现以H2S和Ar的混合气(两种气体体积分数分别为25%和75%)作为反应气体,在气体停留时间为6 s,体系注入能量密度约1.1 eV时,硫化氢的转化率达到40%,产氢能耗约为2.8 eV。
Linga Reddy等[32,33]以线筒式介质阻挡放电的形式研究了硫化氢分解制氢反应,采用银、铝以及铜等不同材质作为接地极,考察了放电间隙、放电频率、反应温度、硫化氢初始浓度以及反应气停留时间等条件对硫化氢转化率和产氢能耗的影响,发现除接地极材质与放电频率外,其他反应条件的改变对硫化氢转化率和产氢能耗均有较大影响。此外,将陶瓷颗粒或不同形貌的玻璃颗粒填充于放电气隙,可以增加气体的停留时间并且提高了气隙的电场强度,从而提高了硫化氢转化率。与玻璃颗粒相比,陶瓷颗粒表现出更显著的促进硫化氢分解作用。其可能的原因是陶瓷颗粒的介电常数高,并且由于陶瓷颗粒存在更多的锐边和尖角,从而提高了局部的电场强度,利于硫化氢的分解[34]。
王瑶等在常压下利用介质阻挡放电等离子体与光催化剂协同作用分解硫化氢制氢,考察了不同催化剂、不同载体、放电参数、硫化氢初始浓度以及原料气流量等对反应的影响,发现等离子体与光催化剂结合可以更加有效地分解硫化氢, 当采用催化剂CdS/Al2O3,以30 mL/min通入H2S和Ar的混合气(两种气体体积分数分别为20%和80%),注入能量密度为1.38 eV, 硫化氢转化率达到了100%,而此时的产氢能耗仅为6.92 eV,这一能耗值接近工业上烃类重整制氢的产氢能耗(约4 eV)。实现硫化氢的完全分解不但避免了尾气的后续分离,降低了操作成本,而且可以减少制氢带来的二氧化碳排放,而较低的产氢能耗也令其取代烃类重整制氢成为可能。
4 展 望
直接分解硫化氢既可以使其无害化,又可以生产氢气和硫磺,是一条理想的硫化氢资源化利用技术路线。然而硫化氢的分解反应因受热力学平衡限制,在常规的反应条件下转化率很低,而在低温等离子体中,硫化氢会被解离为原子和正负离子,从而打破热力学平衡限制,获得较高的转化率,如果将催化剂引入等离子体反应体系进行硫化氢分解制氢,可显著提高转化率,降低产氢能耗。
尽管低温等离子体用于硫化氢分解制氢的研究较多,但目前还停留在实验研究阶段,要实现工业应用仍有很多理论及工程问题有待解决,如等离子体分解硫化氢制氢的机理研究不完善,需要开发能量效率高的大功率电源和耐压耐腐蚀装置等,另外由于实际生产中的硫化氢气体往往含有诸如氧气、氮气、二氧化碳以及有机气体等,这些杂质气体的存在可能会造成二次污染(如SO2,NOx,CO等)和催化剂失活,也需要进一步研究,因此今后需进一步研究的方向有:(1)优化等离子体反应器结构,开发高效、大功率的反应器,进一步提高能量效率;(2)进行等离子体反应器放大及长期运行稳定性、可靠性的研究;(3)深入研究等离子体与催化剂的协同作用机理,为开发适于等离子体环境下高稳定性、长寿命的催化剂提供指导。
[1]杜礼明, 王树东. 超绝热燃烧技术在硫化氢分解制氢上的应用[J]. 化工进展, 2005, 24(3): 231-235.Du Liming, Wang Shudong. Application of super adiabatic combustion to hydrogen production by decomposition of hydrogen sulfide[J].Chemical Industry and Engineering Progress, 2005, 24(3): 231-235.
[2]Edlund D J, Pledger W A. Thermolysis of hydrogen sulfide in a metal-membrane reactor[J]. Journal of Membrane Science, 1993, 77(2–3):255-264.
[3]Kaloidas V, Papayannakos N. Kinetics of thermal non-catalytic decomposition of hydrogen sulfide[J]. Chemical Engineering Science, 1989,44(11): 2493-2500.
[4]李发永, 曹作刚, 张海鹏, 等. 由硫化氢制取硫磺及氢气扩大实验研究[J]. 化工进展, 2001, (7): 38-41.Li Fayong, Cao Zuogang, Zhang Haipeng, et al. Experimental study on transforming refinery acid tail gas into sulphur and hydrogen[J].Chemical Industry and Engineering Progress, 2001, (7): 38-41.
[5]Mao Z, Anani A, White R E, et al. A modified electrochemical process for the decomposition of hydrogen sulfide in an aqueous alkaline-solution[J]. Journal of The Electrochemical Society, 1991, 138(5): 1299-1303.
[6]Petrov K, Baykara S Z, Ebrasu D, et al. An assessment of electrolytic hydrogen production from H2S in Black Sea waters[J]. International Journal of Hydrogen Energy, 2011, 36 (15): 8936-8942.
[7]Bai X F, Cao Y, Wu W. Photocatalytic decomposition of H2S to produce H2over CdS nanoparticles formed in HY-zeolite pore[J]. Renewable Energy, 2011, 36(10): 2589-2592.
[8]Subramanian E, Baeg J O, Lee S M, et al. Dissociation of H2S under visible light irradiation (lambda >= 420 nm) with FeGaO3photocatalysts for the production of hydrogen[J]. International Journal of Hydrogen Energy, 2008, 33(22): 6586-6594.
[9]Jang J S, Li W, Oh S H, et al. Fabrication of CdS/TiO2nano-bulk composite photocatalysts for hydrogen production from aqueous H2S solution under visible light[J]. Chemical Physics Letters, 2006, 425(4-6): 278-282.
[10]Zaman J, Chakma A. Production of hydrogen and sulfur from hydrogen sulfide[J]. Fuel Processing Technology, 1995, 41(2): 159-198.
[11]许根慧, 姜恩永, 盛 京, 等. 等离子体技术与应用[M]. 北京: 化学工业出版社, 2006.1-43.
[12]Fridman A. Plasma Chemistry[M]. Cambridge University Press, 2008: 738-749.
[13]Nicholas J E, Amodio C A, Baker M J. Kinetics and mechanism of the decomposition of H2S, CH3SH and (CH3)2S in a radio-frequency pulse discharge [J]. Journal of the Chemical Society, Faraday Transactions,1979, 1(75): 1868-1875.
[14]Helfritch J. Pulsed corona discharge for hydrogen sulfide decomposition[J]. IEEE Transactions on Industry Applications, 1993, 29(5):882-886.
[15]Zhao G B, John S, Zhang J J, et al. Production of hydrogen and sulfur from hydrogen sulfide in a nonthermal-plasma pulsed corona discharge reactor[J]. Chemical Engineering Science, 2007, 62(8): 2216-2227.
[16]John S, Hamann J C, Muknahallipatna S S, et al. Energy efficiency of hydrogen sulfide decomposition in a pulsed corona discharge reactor [J].Chemical Engineering Science, 2009, 64(23): 4826-4834.
[17]Traus I, Suhr H, Harry J E, et al. Application of a rotating high-pressure glow discharge for the dissociation of hydrogen sulfide[J]. Plasma Chemistry and Plasma Processing, 1993, 13(1): 77-91.
[18]Dalaine V, Cormier J M, Lefaucheux P, A gliding discharge applied to H2S destruction[J]. Journal of Applied Physics, 1998, 83(5):2435-2442.
[19]Dalaine V, Cormier J M, Pellerin S, et al. H2S destruction in 50 Hz and 25 kHz gliding arc reactors[J]. Journal of Applied Physics, 1998, 84(3):1215-1221.
[20]Nunnally T, Gutsol K, Rabinovich A, et al. Dissociation of H2S in non-equilibrium gliding arc “tornado” discharge[J]. International Journal of Hydrogen Energy, 2009, 34(18): 7618-7625.
[21]Gutsol K, Nunnally T, Rabinovich A, et al. Mechanisms of non-equilibrium dissociation of hydrogen sulfide in low-temperature plasma[C]//2010 IEEE 37th International Conference on Plasma Sciences. Norfolk, Virginia: 2010.
[22]Bagautdinov A Z, Zhivotov V K, Kalachev I A, et al. Dissociation of hydrogen sulfide in a mixture with carbon dioxide gas in a high-power microwave discharge[J]. Soviet Physics-Technical Physics, 1991, 36(4): 488-490.
[23]Bagautdinov A Z, Jivotov V K, Eremenko J I, et al. Plasmachemical hydrogen production from natural gases containing hydrogen sulfide[C]//13th World Hydrogen Energy Conference. Beijing: 2000.
[24]Bagautdinov A Z, Jivotov V K, Eremenko J I, et al. Plasma chemical production of hydrogen from H2S-containing gases in MCW discharge [J].International Journal of Hydrogen Energy, 1995, 20(3): 193-195.
[25]Jivotov V, Rusanov V. Energy cost of plasmachemical hydrogen from hydrogen sulfide is actually not more than about one kWh per cubic meter[J]. International Journal of Hydrogen Energy, 1999, 24(1): 83-84.
[26]Bernie G C, Patrick F C, Barry B P. Economics of thermal dissociation of H2S to produce hydrogen [J]. International Journal of Hydrogen Energy, 1998, 23(7): 531-544.
[27]Harkness J B L, Gorski A J, Daniels E J. Hydrogen sulfide waste treatment by microwave plasma dissociation [C]/ / Proceedings of the 25th Intersociety Energy Conversion Engineering Conference. New York: 1990.
[28]董永治, 王涵慧, 俞稼镛. 微波等离子体方法分解H2S制氢[J]. 太阳能学报, 1997, 18(2):142-145.Dong Yongzhi, Wang Hanhui, Yu Jiayong. Hydrogen production by H2S microwave plasma dissociation[J]. Acta Energiae Solaris Sinica, 1997,18(2): 142-145.
[29]Krasheninnikov E G, Rusanov V D, Sanyuk S V, et al. Dissociation of hydrogen sulfide in an RF discharge[J]. Soviet Physics-Technical Physics, 1986, 31(6): 645-648.
[30]Traus I, Suhr H. Hydrogen sulfide dissociation in ozonizer discharges and operation of ozonizers at elevated temperatures[J]. Plasma Chemistry and Plasma Processing, 1992, 12(3): 275-285.
[31]Subrahmanyam C H, Renken A, Kiwi-minsker L. Non-thermal plasma catalytic reactor for hydrogen production by direct decomposition of H2S[J]. Journal of Optoelectronics and Advanced Materials, 2008, 10(8): 1991-1993.
[32]Linga Reddy E, Biju V M, Subrahmanyam CH. Production of hydrogen and sulfur from hydrogen sulfide assisted by nonthermal plasma[J].Applied Energy , 2012, 95: 87-92.
[33]Linga Reddy E, Biju V M, Subrahmanyam CH. Production of hydrogen from hydrogen sulfide assisted by dielectric barrier discharge[J].International Journal of Hydrogen Energy, 2012, 37(3): 2204-2209.
[34]Linga Reddy E, Biju V M, Subrahmanyam CH. Hydrogen production from hydrogen sulfide in a packed-bed DBD reactor[J]. International Journal of Hydrogen Energy, 2012, 37(10): 8217-8222.
Research Progress on Direct Decomposition of Hydrogen Sulfide by Non-Thermal Plasma for Hydrogen Production
Zhao Lu1, Wang Yao1,2, Li Xiang1,2, Wang Anjie1,2
(1. State Key Laboratory of Fine Chemical, Dalian University of Technology, Dalian 116024, China;2. Liaoning Key Laboratory of Petrochemical Technology and Experiment, Dalian 116024, China)
In this paper, research progress on hydrogen sulfide decomposition under non-thermal plasma was reviewed (including corona discharge, glow discharge, gliding arc discharge, microwave plasma, radio-frequency plasma and dielectric barrier discharge). Up to now, the study of decomposition of hydrogen sulfide in non-thermal plasma is still in laboratory stage, and there are many issues needed to be solved. Overall, how to improve the conversion of hydrogen sulfide and reduce the energy consumption are the keys for hydrogen sulfide decomposition process to be industrialized.
hydrogen sulfide; decomposition; hydrogen production; non-thermal plasma
TQ116.29;O646.9 文献标识码:A
1001—7631 ( 2012 ) 04—0364—07
2012-07-12;
2012-08-14
赵 璐(1985—),男,博士研究生;王 瑶(1965—),女,副教授,通讯联系人。E-mail: wangyao@dlut.edu.cn
国家自然科学基金资助项目(20973030,21073022,21173033)
