新型对二苯醌衍生物的合成与晶体结构
2012-01-09韩笑梅王建辉
韩笑梅, 王建辉
(天津大学 理学院 化学系,天津 300072)
新型对二苯醌衍生物的合成与晶体结构
韩笑梅, 王建辉
(天津大学 理学院 化学系,天津 300072)
主要报道了三苯基硼引发的2-烷基取代苯酚双锂盐的自由基偶联反应,生成了硼取代的对二苯醌化合物。有机硼化合物被认为参加自由基反应,以有机硼化合物作为自由基引发剂,并应用于芳烃化合物。我们发现当三苯基硼与2-烷基取代苯酚的双锂盐反应时,促进2-烷基取代苯酚的自由基偶联,生成了一种新型的对二苯醌衍生物,是一种收率较高的对二苯醌衍生物新型制备方法。产物的结构经元素分析、红外光谱和X-射线单晶衍射确定。
自由基历程;对二苯醌衍生物;自由基偶联;晶体结构
前 言
对有机硼烷参与自由基反应的研究始于1967年,硼烷的这一反应特点是由Davies和Roberts发现的,随后又被Brown和Suzuki应用于合成[1]。随着自由基反应在有机合成应用中的飞速发展[2~5],有机硼化合物被广泛用于各种新颖有应用价值的反应中[6~7]。有机硼化合物可以参与很多的自由基反应,比如自动氧化生成烷基硼酸酯[8],对α,β-不饱和羰基化合物的1,4加成反应[9],硫基化合物自由基反应[10],以及烯丙基碘或芳基碘在过量有机硼化合物作用下的偶联反应等[11]。
对二苯醌化合物通常是由2,6-二取代的苯酚经活化的MnO2,CrO3或者其它过渡金属氧化剂氧化制备[12~14]。苯醌衍生物具有广泛的用途,艾地苯醌是新型抗老年性痴呆特效药和脑功能代谢及精神症状改善剂,具有多重药理作用[15]。苯醌化合物在医学研究中也有重要意义,例如应用苯醌处理白血病细胞,探索苯诱导的细胞病变机制。此外,萘醌等同体或衍生物通过结构修饰,赋予合成色素(染料)更优异的染色性能和防紫外性能[16]。
本文以有机硼烷作为自由基引发剂,并将其应用于芳基化合物,发现三苯基硼在与2-溴-6-烷基苯酚的双锂盐反应时,可作为芳烃化合物的自由基引发剂,使2-溴-6-烷基苯酚双锂盐发生原位偶联反应,生成了一种新型的对二苯醌化合物(见下面3a,3b)。本文为硼取代的对二苯醌化合物提供了一种新型的合成方法[17],对产物进行了元素分析,红外光谱表征,X-射线单晶衍射测定。实验所需的2-溴-6-烷基苯酚1由溴代二甲胺与2-烃基苯酚制得。溴代二甲胺可由二甲胺和溴反应生成。1在正丁基锂作用下生成苯酚的双锂盐2,然后将三苯基硼的乙醚溶液加入到2中,生成最终的对二苯醌化合物3,a代表叔丁基,b代表甲基。
合成路线如下:
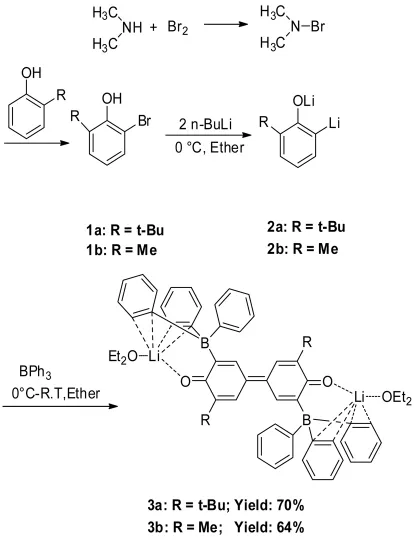
1 实验部分
1.1 实验原料及仪器
无水乙醚预处理:在氮气保护下加入金属钠,二苯甲酮加热回流至溶液变成深蓝色,然后蒸馏而得;邻叔丁基苯酚,邻甲基苯酚,甲苯,溴素,33%二甲胺水溶液,氢氧化钠,石油醚,无水硫酸镁,均为分析纯试剂,天津江天化工有限公司。
采用Perkin-Elemer 240元素分析仪进行元素分析;Nicolet-170 SXFT-IR型红外光谱仪进行红外光谱表征,扫描范围400~4000 cm-1,KBr压片;采用BRUKER SMART 1000 CCD X射线衍射仪对晶体结构进行测定。
1.2 对二苯醌化合物的合成
1.2.1 2-溴-6-烷基苯酚(1a)的合成[18]
向装有恒压滴液漏斗,磁力搅拌子的500 mL单口反应瓶中加入13 mL二甲胺33%水溶液和NaOH水溶液(17mL,10 mol/L)。在搅拌条件下,通过冰盐浴将反应液冷却至-15℃。将溴素慢慢滴加到混合液中,滴加完毕后,再反应1 h后用甲苯萃取,分离有机层并用无水硫酸镁干燥得到溴代二甲胺的甲苯溶液。将此甲苯溶液滴加到含有4.02 g邻叔丁基苯酚的40 mL甲苯溶液中,控制温度在-15℃,反应8 h后,缓慢升至室温再反应2 h,浓缩除去溶剂甲苯,过柱提纯,展开剂为石油醚,最后得产品4.41 g2-溴-6-叔丁基苯酚(1a),收率72%。
1.2.2 2-溴-6-烷基苯酚(1b)的合成
合成方法同上,最后得产品4.33 g2-溴-6-甲基苯酚(1b),收率67%。
1.2.3 对二苯醌化合物(3a)的合成
将50 mL的Schlenk瓶连接在真空线上,抽空,用酒精灯加热除去水蒸气,冷却后充入N2气,并在N2保护下,用注射器加入溶于3 mL绝对乙醚的0.58 g2-溴-6-叔丁基苯酚,搅拌,用冰盐浴将反应液冷却至-15℃,用注射器缓慢滴加n-BuLi的己烷溶液(N=1.85,2.7 mL),在 -15℃搅拌 2 h后,缓慢升至室温,并在室温下搅拌3 h,得到黄色溶液(2a)。
在N2气保护下称取0.61 g三苯基硼,加入20 mL绝对乙醚使三苯基硼完全溶解。在室温下,用注射器将此三苯基硼的乙醚溶液缓慢滴加到上述黄色的双锂盐溶液中,并在室温下搅拌过夜。开始时是黄色溶液,最后变成红色的溶液,减压浓缩,放置一个星期,有红色晶体3a析出,称重,1.67 g,收率70%。测其晶体结构。IR(KBr)(ν/cm-1):3060,2971,2885,1611,1555(-C=O),1483,1455,1427,1361,1262,1185,1092,1066,1032,916,888,848,737,708。元素分析:化学式C64H72B2Li2O4,相对分子质量:940.72,计算值(质量分数%,下同)C 81.71,H 7.71;其试验测定值:C81.87,H 7.56。
1.2.4 对二苯醌化合物(3b)的合成
将50 mL的Schlenk瓶连接在真空线上,抽空,用酒精灯加热除去水蒸气,冷却后充入N2气,并在N2保护下,用注射器加入溶于3 mL绝对乙醚的0.42 g2-溴-6-甲基苯酚,搅拌,通过冰盐浴将反应液冷却至-15℃,用注射器缓慢滴加n-BuLi的己烷溶液(N=2.2475,2.0 mL),在 -15℃搅拌 2 h 后,缓慢升至室温,并在室温下搅拌3 h,得到黄色溶液(2b)。
在N2气保护下称取0.54 g三苯基硼,加入20 mL绝对乙醚使三苯基硼完全溶解。在室温下,用注射器将此三苯基硼的乙醚溶液缓慢滴加到上述黄色的双锂盐溶液中,在室温下搅拌过夜。开始时是黄色溶液,最后变成红色的溶液,减压浓缩,放置一个星期,有红色晶体3b析出,称重,1.22 g,收率64%。测其晶体结构。(KBr)(ν/cm-1):3058,2975,2887,1712,1602,1551(-C=O),1480,1427,1340,1245,1160,1102,1065,1036,919,840,706,587,521,490.元素分析:化学式C58H60B2Li2O4,相对分子质量:856.58。计算值(质量分数%,下同)C 81.32,H 7.06;其试验测定值:C81.27,H 6.95。
1.3 对二苯醌化合物3a与3b晶体结构的测定
在显微镜下选取0.16 mm×0.14 mm×0.12mm大小的单晶在低温下进行X-射线衍射试验。在Bruker Smart 1000 CCD面探衍射仪上,用经石墨单色器单色化的Mo-Kα射线 (λ=01071073 nm)收集衍射点,结构的衍射数据使用SADABS程序进行吸收校正。晶体结构由TREF法结合差值Fourier合成解出。全部计算用SHELXL-97程序完成。其晶体学参数见表1,表2。

θ角范围/°限制指数衍射点独立衍射点最适性系数残差因子权重残差因子2.20≤θ≤27.84-12≤h≤12,-34≤k≤26,-14≤l≤14107665985[R(int)=0.0430]1.0110.06450.1693

表1 对二苯醌化合物3a的晶体学数据参数Table1 Crystal data and structure refinement of diphenoquinone 3a
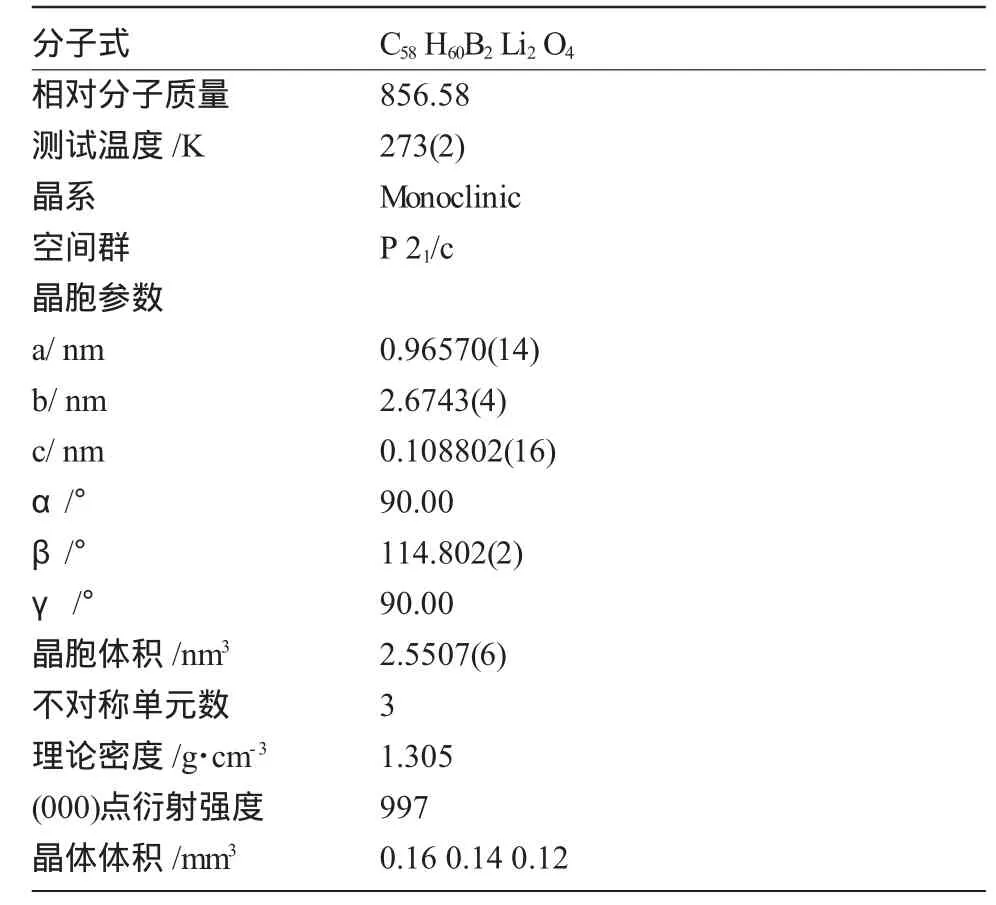
表2 对二苯醌化合物2的晶体学数据参数Table2 Crystal data and structure refinement for diphenoquinone 3b
2 结果与讨论
2.1 晶体结构探讨
对二苯醌化合物3a(C64H72B2Li2O4)及对二苯醌化合物3b(C58H60B2Li2O4)的晶体结构见下图1。

图1 对二苯醌化合物3a和3b的晶体结构Fig.1 Molecular structure of 3 a and 3b(For clarity,the atoms on the other half of the molecular 3b was not labeled).
从图1中可以清楚地看到对二苯醌化合物3a和3b是具有完全对称结构的化合物单晶,图1清楚地表示出了苯酚对位两个碳原子的偶联。3a和3b晶体结构十分相似,它们都是以C4-C4A键中心点作为对称中心,另一半结构可由该中心对称转化得到。B与四个苯环相连,单晶分子结构中存在两分子的乙醚溶剂分别与单晶结构中的两个Li络合,Li原子周围有四个配位基团,Li原子分别和对二苯醌羰基的氧原子,乙醚分子中的氧原子络合,还与两个邻近的苯环的π键配位形成两个金属π键,共四个配位键。

表3 对二苯醌化合物3a和3b部分键长(nm)Table 3 Selected bond lengths(nm)of diphenoquinone 3a and 3b
从表3中键长数据可以看出,C(4)-C(4A)在3a中键长为0.1396(3)nm与3b中0.1396(4)nm相同,键长表明了两个碳原子形成的是双键。在3a和3b中,C(1)-C(2),C(3)-C(4),C(4)-C(5),和 C(1)-C(6)的键长近乎单键键长;C(2)-C(3),和C(5)-C(6)为双键。在3a和3b中,C(1)-O(1)键长近乎相等,键长数据表明了羰基的存在。在3a中C(1)-C(6)-C(5)-C(4)扭转角是3.7(2)o,在3b中 C(1)-C(6)-C(5)-C(4)扭转角是-172.73(19)o,说明在化合物3a和3b中,两个醌环几乎是共平面的。通过对晶体结构分析可知,对二苯醌化合物3a和3b是具有高度对称结构的化合物。
2.2 反应机理
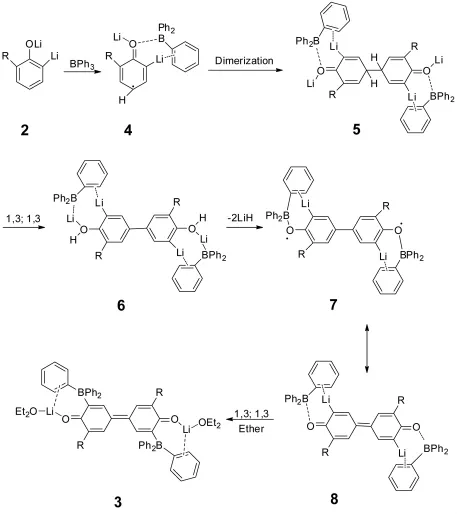
我们探索了反应的机理。向苯酚双锂盐2中加入一化学当量的4-甲氧基-2,2,6,6-四甲基哌啶氧自由基(TEMPO),一种很好的自由基抑制剂,我们发现双锂盐黄色溶液逐渐变黑,没有偶联产物3生成。
该反应与所选取的溶剂密切相关,当使用THF作为反应溶剂时,没有偶联产物生成,这是因为在四氢呋喃溶液中,Li原子与THF中氧原子的络合能力大于与乙醚中氧原子的络合能力,在四氢呋喃中,Li以游离态形式存在,从而使苯环上电子云密度增加,不利于自由基4的生成,也就不能发生偶联反应。
由上述实验可知这个反应是三苯基硼促进的芳烃的自由基的偶联反应。当三苯基硼滴加到2-取代苯酚的双锂盐的黄色溶液时,生成了一个苯酚二锂盐的自由基4,在这个自由基中B与氧原子络合,这个苯酚双锂盐的自由基很不稳定,很快二聚成5,然后5通过1,3-σ氢迁移形成更稳定的结构式6,LiH分子从6中脱掉生成双自由基中间体7,7的共振体8是对二苯醌结构,然后在8中由于B是缺电子的,B与富电子的苯环作用,生成最后的对二苯醌化合物3。
3 结论
合成了硼取代的对二苯醌化合物,该化合物在空气中十分稳定。在该化合物中,B的周围有四个苯环,由于四配位的硼化合物可作为优质的电子传导和接受体,该化合物具有一定的工业生产应用价值。此外,该合成方法可用于硼取代的对二苯醌化合物的设计合成及相关研究领域。
[1]BROWN H C,MIDLAND M M.Organic syntheses via free-radical displacement reactions of organoboranes[J].Angew Chem Int Ed Engl,1972,11:692~700.
[2]GIESE B.Radicals in Organic Synthesis:Formation of Carbon-Carbon Bonds[M].Pergamon:Oxford,1986.
[3]MOTHERWELL W B,CRICH D.Free Radical Chain Reactions in Organic Synthesis[M].London :Academic Press,1992.
[4]FOSSEY J,LEFORT D,SORBA J.Free Radicals in Organic Synthesis[M].Wiley:Chichester,1995.
[5]RENAUD P,SIBI M P.Radicals in Organic Synthesis[M].Weinheim,Germany:Wiley-VCH,2001.
[6]YORIMITSU H,OSHIMA K.In Radicals in Organic Synthesis[M].Weinheim,Germany :Wiley-VCH,2001.
[7]OLLIVIER C,RENAUD P.Organoboranes as a Source of Radicals[J].Chem Rev,2001,101:3415~3434.
[8]BROWN H C,MIDLAND M M.Organoboranes for synthesis.A convenient,general synthesis of alkylhydroperoxides via autoxidation of organoboranes[J].Tetrahedron,1987,43:4059~4070.
[9]BROWN H C,KABALKA G W.Oxygen-induced reactions of organoboranes with the inert .alpha.,.beta.-unsaturated carbonyl derivatives.convenient new aldehyde and ketone synthesis via hydroboration[J].J Am Chem Soc,1970,92(3):714~716.
[10]MCPHEE D J,CAMPERDON M,LESAGE M,et al.Reactions of the tert-butylthiyl radical with organometallic compounds and alkenes[J].J Am Chem Soc,1989,111:7563~7567.
[11]SUZUKI A,NOZAWA S,HARADA M,et al.Oxygen-induced reaction of trialkylboranes with alkyl iodides.Facile coupling of benzylic and allylic iodides via triethyl borane[J].J Am Chem Soc,1971,93:1508~1509.
[12]TAKAAKI S,HISATOMO Y,CHYONGJIN P.Catalytic activities of CuSO4/Al2O3in dehydrogenation of arenes by dioxygen[J].J Org Chem,1997,62:3194~3199.
[13]OMURA K.Electron transfer between protonated and unprotonated phenoxyl radicals[J].J Org Chem,2008,73 (3):858~867.
[14]MUSIE G T,WEI M,SUBRAMANIAM B,et al.autoxidation of substituted phenols catalyzed by cobalt schiff base complexes in supercritical carbon dioxide[J].Inorg Chem,2001,40:3336~3341.
[15]南开大学.艾地苯醌琥珀酸单酯及其制备方法:CN,102153471A[P].2011-08-17.
[16]贾丽霞.萘醌类天然色素等同体的合成、修饰与应用性能研究[D].上海:东华大学,2011.
[17]OMURA K.Mechanistic approach to the reaction of 2,6-di-tertbutylphenol with an iodinating agent in methanol:electrophilically assisted solvolysis of intermediary 4-iodocyclohexa-2,5-dienones[J].J Org Chem,1996,61:2006~2012.
[18]GRUZA M M,CHAMBRON J C,ESPINOSA E,et al.Synthesis and stereochemical properties of“extended”biphenols bridged by ortho-,meta-,and para-phenylene spacers[J].Eur J Org Chem,2009:6318~6327.
Synthesis and Crystal Structure of Novel Diphenoquinones
HAN Xiao-mei,WANG Jian-hui*
(Department of Chemistry,College of Science,Tianjin University,Tianjin 300072,China)
This paper mainly reported the radical coupling reaction of 2-alkyl-phenolate initiated by triphenylborane to form boron substituted diphenoquinones crystals.Organoboranes were recognized to participate in free-radical processes.Herein,the concept of using organoboranes as a radical initiator has been extended to aromatic compounds.Organoboranes promoted radical coupling reaction of 2-alkyl-phenolate was observed during its reaction with dilithium phenolate,generating novel diphenoquinones,and leading to a new syntheticmethod for the preparation of diphenoquinone derivatives with good yields.The products were characterized by IR,elemental analysis and X-ray diffraction.
Free-radical processes;diphenoquinone derivatives;radical coupling reaction;crystal structure
TQ244.6
A
1001-0017(2012)04-0031-05
2012-03-04
韩笑梅(1986-),女,河北邢台人,硕士研究生,研究方向:有机合成及过渡金属催化的碳氢活化。Email:hanxiaomei12@126.com
