固体钙指示剂的配比研究
2012-01-09宋秀丽
宋秀丽 易 伟
(太原师范学院 化学系,山西 太原 030031)
固体钙指示剂的配比研究
宋秀丽 易 伟
(太原师范学院 化学系,山西 太原 030031)
研究固体钙指示剂的最佳配制比例,对不同配比的固体钙指示剂在一定条件下测定钙离子的实验结果进行比较.实验结果表明:固体钙指示剂的最佳配比是钙指示剂与氯化钠的质量比为1∶100,此比例下终点变色敏锐,准确度显著提高,稳定性好.在该配比下测定了样品的含量,其回收率在99.9%~107.7%的范围内,相对标准偏差在1.53%以内,测定结果与用国家标准方法所测结果一致.该方法可用于测定含钙试样,对产品质量进行监控.
钙指示剂;EDTA;钙测定;最佳配比
0 引言
目前,测定钙含量的分析方法主要有乙二胺四乙酸二钠(EDTA)络合滴定法、高锰酸钾法、三溴偶氮胂双波长分光光度法、原子吸收光谱法、电位滴定法及电感耦合等离子体原子发射光谱法等[1].其中以EDTA络合滴定法适用范围最广也最常见,具有操作简便、分析结果可靠性高、耗材少等优点.就EDTA络合滴定法而言,其所用指示剂有紫尿酸铵[2]、CMP混合指示剂(钙黄绿素-甲基百里香酚蓝-酚酞混合指示剂的简称)、K-B混合指示剂(酸性铬蓝K-萘酚绿B混合指示剂的简称)、铬黑T、二甲酚橙(XO)指示剂、钙指示剂(NN)等,其中以钙指示剂最为常用.
钙指示剂化学名称为2-羟基-1(2-羟基-4-磺基-1-萘偶氮)-3-萘甲酸,英文名为Calconcarboxylic acid sodium salt,又称钙红、NN指示剂、钙试剂羧酸钠盐,分子式:C21H13N2NaO7S,分子量为460.39,是经典钙离子测定所用指示剂之一.由于钙指示剂的水溶液稳定性较差,通常将其配制成固体指示剂使用,而其配比尤为关键,指示剂的配比不仅影响终点颜色的判断,而且还会导致终点滞后和终点提前等问题的产生[3].现报道并沿用的固体钙指示剂的比例为:20%[4],50%[5],100%[6]等,比例不统一,且某些比例下存在着终点变色不敏锐、准确度不高、甚至无明显颜色变化等问题.
1 实验部分
1.1 主要仪器与试剂
仪器 50 m L碱式滴定管(天波仪器有限公司);25 m L移液管(天波仪器有限公司);5 m L吸量管(天波仪器有限公司);电子分析天平(FA2004型,上海良平仪器仪表有限公司);1 000 m L容量瓶(太原玻璃仪器厂);研钵(TX11型);漏斗(晶花);电热套(山东邺城县光华联合制造厂);烧杯(晶花);500 m L聚乙烯塑料试剂瓶;250 m L碘量瓶(乔兴GG-17型);水质净化系统(MUL-9000系列,昆山總馨机械有限公司).
试剂 葡萄糖酸钙片(0.1 g/片,<标示量9 mg/片>,长沙康尔佳制药有限公司汉寿制药厂,批号:20100519);乙二胺四乙酸二钠(北京北化精细化学品有限公司,批号:20040405);基准碳酸钙(50 g,天津市光复科技发展有限公司,批号:20100322);钙试剂羧酸钠盐(北京化工厂,批号:770915);三乙醇胺(天津市光复精细化工研究所,批号:20060310);NaCl(天津市光复精细化工研究所,批号:20060306);MgCl2·6H2O(北京红星化工厂,批号:800617-1);NaOH(北京华腾化工有限公司,批号:20100216);pH试纸(天津市金达化学试剂有限公司);所用试剂均为分析纯,实验用水为超纯水(MUL-9000水质净化系统制).
1.2 实验方法
1.2.1 试剂的配制
1.2.1.1 钙标准溶液的配制[4]
将CaCO3基准试剂置于120℃ 烘箱中,干燥2 h,稍冷后,置于干燥器中冷却至室温.在电子天平上准确称取1.999 1 g基准碳酸钙于250 m L的烧杯内(烧杯上盖一表面皿,防止加入浓盐酸时溶液溅出),加水适量,逐滴加入浓盐酸5 m L使之溶解后,转入1 L容量瓶中,用洗瓶旋流多次冲洗烧杯内壁、表面皿,并将冲洗后的溶液全部转入容量瓶中,用水稀释至刻度定容,摇匀配成浓度为0.019 97 mol/L的钙标准溶液.
1.2.1.2 EDTA 标准溶液的配制[7]
在电子天平上称取4.0 g EDTA于一洁净的500 m L烧杯内,加入小米粒大小MgCl2·6 H2O晶体一颗[6],加水搅拌使之完全溶解,用水稀释至500 m L刻度处,转入500 m L聚乙烯白色塑料试剂瓶内,拧紧瓶盖,配成浓度为0.02 mol/L的EDTA溶液.
1.2.1.3 NaOH 溶液的配制
在电子天平上称取40.0 g NaOH固体于一500 m L烧杯中,加水至500 m L刻度处,搅拌使其完全溶解,转入聚乙烯塑料试剂瓶中(盖好瓶盖防止空气中的CO2等气体进入),配成浓度为2.0 mol/L的NaOH溶液.
1.2.1.4 固体钙指示剂的配制[8]
固体钙指示剂与 NaCl分别以1∶10,1∶30,1∶50,1∶70,1∶90,1∶100,1∶110,1∶150,1∶200的质量比混合磨匀至粉末状,装入100 m L广口瓶中,贴标签,避光保存待用.
2.2.2 EDTA标准溶液的标定
准确移取25.00 m L钙标准溶液于250 m L碘量瓶中,加水100 m L,用2.0 mol/L的NaOH溶液调节pH值至13(加入约5 m L),加入3 m L三乙醇胺,加入50 mg的1∶100固体钙指示剂,摇匀,用EDTA溶液滴定至溶液颜色由淡酒红色变为天青色即为滴定终点,记录EDTA溶液的用量并计算其准确浓度.
2 实验结果与讨论
2.1 实验条件
2.1.1 pH值、温度、杂质离子等对钙指示剂的影响
2.1.1.1 pH 值对指示剂的影响
pH值过大时,OH-与Ca2+形成Ca(OH)2沉淀,易对指示剂形成吸附,影响测定结果,现探讨如下:Ca(OH)2溶解度为1.2 g/L,假设测定前溶液体积为150 m L则:
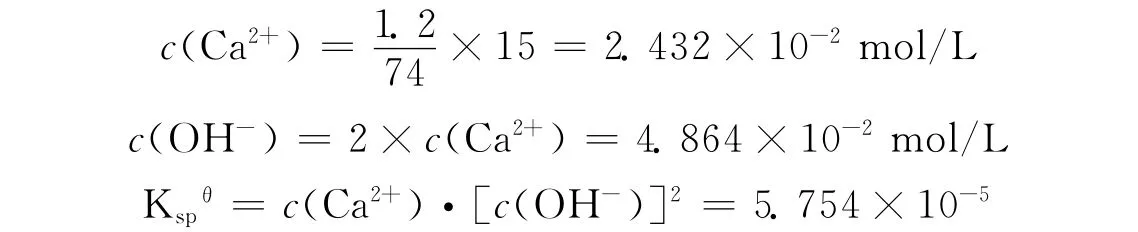
当c(Ca2+)·[C(OH-)]2> Ksp时则有 Ca(OH)2沉淀生成,反之则无.试样溶液中c(Ca2+)≈0.02 mol/L,量取25.00 m L试样溶液,在150 m L溶液中c(Ca2+)=3.333×10-3mol/L,此时溶液中pH 值控制在钙指示剂使用最佳pH 值(11~13),设pH 值为13,则c(OH-)=10-1mol/L,则:C(Ca2+)·[c(OH-)]2=3.333×10-5<KCsp,故无沉淀产生,即实验中需加入水100 m L,2.0 mol/L NaOH 5.0 m L.
2.1.1.2 温度对指示剂的影响
Heilen Arce、Mavis L Montero等研究了Ca—EDTA络合物在不同温度下的热稳定性,结果表明:“羟基磷灰石结构使得Ca—EDTA络合物在不同pH值下,温度低于140℃时异常稳定[9]”.
一般而言,络合滴定反应大多在常温下进行,故测定中无需考虑温度对实验结果的影响.
2.1.1.3 杂质离子对指示剂的影响
溶液中阳离子有:Ca2+,Mg2+(极微量),Fe3+(极微量),K+(极微量),Na+(极微量),H+;阴离子有:OH-,Cl-,I-(极微量).
由于K+,Na+所带电荷少,离子半径与络合所需半径不合适,不易与EDTA,钙试剂生成络合物,对整个络合反应没有影响.Fe3+能与EDTA形成稳定的络合物,实验中加入三乙醇胺[10]掩蔽;OH-能与Ca2+形成Ca(OH)2沉淀,故应严格控制溶液的pH值;Mg2+在pH=13的条件下已形成沉淀,对测定无干扰;I-离子半径很大,也不易与Ca2+形成稳定络合物,对实验无影响.
根据路易斯软硬酸碱原则:络合反应实质是酸碱中和反应,硬酸和硬碱易反应,形成稳定络合物;软酸和软碱易反应,形成稳定络合物;硬酸和软碱不易反应,形成的络合物不稳定.故:溶液中有较浓的盐酸易引起指示剂分解,因此要在调节pH值至11~13后再加入指示剂;Ca2+是一种硬酸,I-属于软碱,形成络合物也不稳定,由此判定溶液中I-对Ca2+的测定无干扰.
2.2 指示剂的用量
在上述条件下,选择固体钙指示剂的用量分别为10 mg,50 mg,100 mg,按照上述标定EDTA标准溶液,观察滴定终点前后溶液的颜色的变化情况和滴定终点溶液的颜色随时间变化等,通过比较选择指示剂用量为50 mg,其结果见表1.

表1 指示剂用量测定结果
2.3 钙指示剂的配比
2.3.1 指示剂配比的定性实验
在上述条件下,改变固体钙指示剂的配比,按照上述标定EDTA标准溶液,记录滴定前溶液的颜色和滴定终点溶液的颜色并进行比较,结果见表2.

表2 不同指示剂配比下溶液颜色的变化
从表2可以看出:固体钙指示剂与氯化钠质量配比为1∶10~1∶50时,溶液颜色过深,紫红色—蓝紫色的颜色变化过程肉眼不易辨别,甚至无法观察,需加入衬色剂[11]改善终点颜色.而且加入过量的EDTA后溶液颜色仍无明显加深.
固体钙指示剂与氯化钠质量配比为1∶70~1∶100时,颜色变化明显易于判断.
固体钙指示剂与氯化钠质量配比为1∶110~1∶200时,颜色过淡甚至看不出颜色变化.而且加入过量的EDTA后,溶液颜色仍无明显变化.
2.3.2 钙指示剂配比对测定结果的影响
准确移取25.00 m L钙试样溶液于一250 m L碘量瓶中,加水100 m L,用2.0 mol/L的NaOH溶液调节pH值至13(加入约5 m L),加入3 m L三乙醇胺,改变钙指示剂与NaCl的配比,以EDTA标准溶液对钙试样溶液进行滴定分析,以mg/片计,计算钙含量平均值及相对标准偏差,结果见表3.
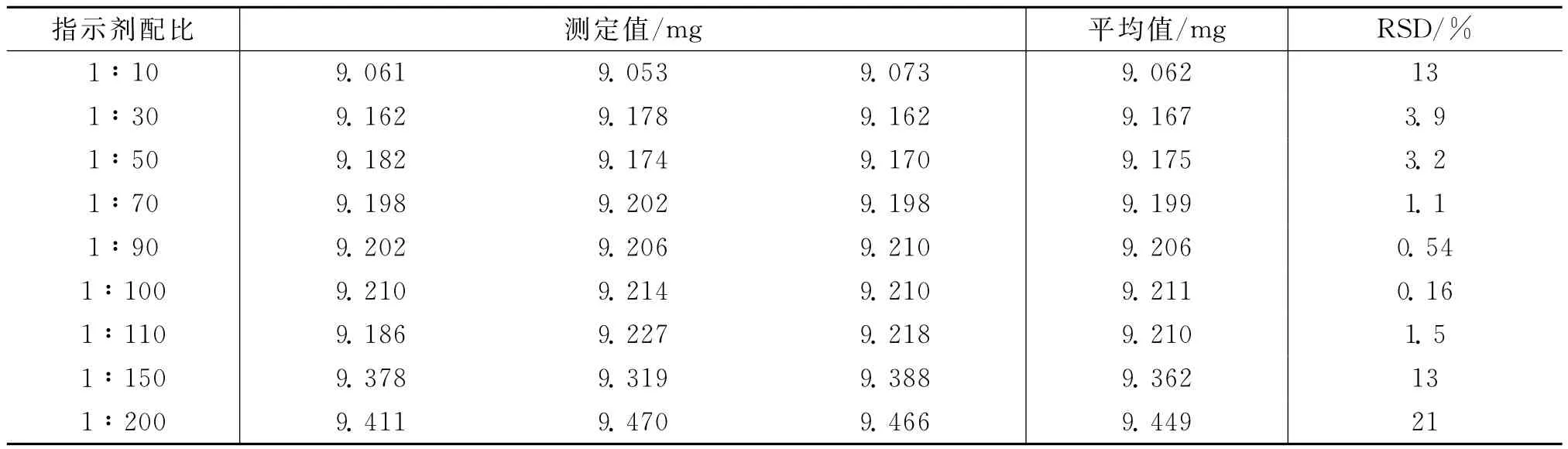
表3 指示剂配比及实验结果
从表3可以看出:
固体钙指示剂与氯化钠质量配比为1∶10,1∶30,1∶50时,滴定终点提前,测定Ca2+含量的相对标准偏差较大,精密度较差.
固体钙指示剂与氯化钠质量配比为1∶70,1∶90,1∶100,1∶110时,测定Ca2+含量的相对标准偏差较小,重现性较好.
固体钙指示剂与氯化钠质量配比为1∶150,1∶200时,滴定终点严重拖尾,精密度极差.
2.4 光线对滴定终点判断的影响[12]
侧光(或背光)用黑色衬底和白色衬底时,终点滴定值较为稳定,不受观察视角的影响,并且两种滴定结果扣除对应的空白值,结果一致.而采用直射光时,因操作者观察视角不同,所测得结果不一样,并且结果偏低.基于本实验的要求,采用白色衬底利用侧光进行观察.
3 反应机理的探讨
3.1 钙指示剂的结构、变色原理及与Ca2+的作用原理[13]
当pH<8时,钙指示剂中有2个-OH,其分子中π-π*跃进能量高,吸收能量较高的短波长光而显紫红色;
当pH为8~13时,其分子中1个-OH以-O-形式存在,由于-O-的强烈斥电子作用,使电子云密度增加,因而降低了π*成键轨道的能级,从而使π-π*跃进能量降低,吸收峰红移,即吸收能量较低的红色光而显蓝色;
当pH>13时,分子中2个-OH都以-O-形式存在,它们对萘环的斥电子作用同时增加且大小相同,其结果就使-N=N-上的电子云密度未发生改变π-π*跃进能量回到pH<8时的能量,故其溶液仍呈现紫红色.
3.2 钙指示剂与EDTA的反应过程
当Ca2+与钙指示剂结合时,溶液的pH<8时Ca2+并未与钙指示剂反应,溶液的颜色是钙指示剂自身的颜色紫红色;
当溶液中pH值为8~13时,指示剂与钙发生络合反应,同时由于钙离子的强离子作用使得另一个-OH离解成-O-并与之形成离子键,结构如图1所示.
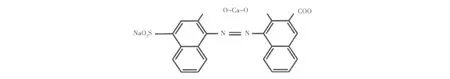
图1 钙试剂羧酸钠盐Ca2+络合物结构式
在pH值为8~13时,当以EDTA进行滴定,Ca2+与EDTA形成正八面体络合物(结构式如图2所示),其稳定常数相对于图1所示的结构而言高出许多倍,故EDTA能“夺”出与指示剂络合的钙,从而指示滴定终点.钙指示剂变色原理如图3所示.
4 样品的测定及回收率实验
4.1 样品的测定
4.1.1 试样溶液的配制[14]
取葡萄糖酸钙片90片,在电子天平上准确称取其质量并记录,将90片药片放入研钵中研磨至粉末状,在电子天平上准确称取该粉末9.713 6 g于250 m L洁净的且用水润湿的烧杯中(烧杯上盖一表面皿,防止加入浓盐酸时溶液溅出),搅拌下缓慢逐滴加入10 m L浓盐酸,加水50 m L,在电热套上加热除去多余的盐酸,趁热过滤溶液于1 000 m L容量瓶中,用少量热水多次冲洗烧杯内壁、表面皿,并将冲洗后的溶液全部滤入容量瓶中,待瓶内溶液冷至室温,用水稀释至刻度定容,摇匀配成钙试样溶液.
4.1.2 样品测定
准确移取25.00 m L钙试样溶液于250 m L碘量瓶中,加水100 m L,用2.0 mol/L的NaOH溶液调节pH值至13(加入约5 m L),加入3 m L三乙醇胺,钙指示剂与NaCl的配比为1∶100,用EDTA标准溶液对钙试样溶液进行滴定分析,计算钙含量及相对标准偏差,以mg/片计.最后将测定的结果与药典法[15]进行比较,测定结果见表4.

表4 本法与药典法的比较结果
葡萄糖酸钙片的标示量为:9 mg/片,测定值为:9.211 mg/片,为标示量的:102.3%(在 95.0%~105.0%之间),表明测定样品合格.
4.2 回收率实验
在上述条件下,加入钙标准溶液5.00 m L,改变固体钙指示剂的配比,以EDTA标准溶液对加标后的钙试样溶液进行滴定分析,计算钙回收率及标准偏差,以mg/片计,测定结果见表5.

表5 指示剂配比及实验结果
从表中结果可知:钙试剂羧酸钠盐与氯化钠质量比为1∶50,1∶100,1∶150时回收率较好,但质量比为1∶50,1∶150时,相对标准偏差大(见表3),重现性较差.
5 结论
综上可以得出:
该试剂与NaCl的质量比为1∶10~1∶90及1∶110~1∶200时,滴定终点颜色不易判断,测定结果的相对标准偏差较大,回收率差.
该试剂与NaCl的 质量比为1∶100时,终点颜色变化敏锐,测定结果的相对标准偏差较小,回收率好.在该条件下试样测定结果与用国家标准方法测定结果一致,测定方法可用于葡萄糖酸钙片中钙含量的测定.
[1]黎瑞珍,王开强,林宏凤.钙的检测方法[J].琼州大学学报,2004,11(2):40-41
[2]卫生部.饮用天然矿泉水检验方法(GB/T8538)[S].北京:中国标准出版社,1995,20-22
[3]李红霞,李国江,张俊杰,等.EDTA络合滴定钙镁指示剂的改进[J].河北理工学院学报,2003,25(4):141-150
[4]李栋婵,孙 柏,邓天龙.EDTA容量法测定钙方法的优化研究[J].广东微量元素科学,2007,14(1):56-59
[5]何彩虹.测定水中 Ca2+含量方法中钙指示剂的改进[J].华南预防医学,2004,30(2):59
[6]赵树宝.EDTA络合滴定法测定铁矿石中钙和镁[J].冶金分析,2009,29(11):76-80
[7]武汉大学主编.分析化学实验[M].第四版.北京:高等教育出版社,2001,184-187
[8]朱云勤,陈 玲,夏文品.EDTA测定钙的指示剂选择[J].贵州大学学报(自然科学版),1999,16(1):30-34
[9]Heilen Arce,Mavis L Montero,Alejandro Sáenzb,et al.Effect of pH and temperature on the form of hydroxyapatite at low temperatures by decomposition of a Ca—EDTA complex[J].Polyhedron,2004,23(11):1 897-1 901
[10]程春萍,张丽娜.连续滴定法测定蛋壳中钙、镁离子的含量[J].内蒙古石油化工,2010,8(1):35
[11]李炳焕,刘会媛,马炳存.表面活性剂对钙指示剂影响的研究[J].无机盐工业,2007,39(12):50
[12]李 敏.EDTA配位滴定法测定CaO终点判断初探[J].云南建材,1998,4(1):45
[13]王久庆.钙含量测定原理及过程分析[J].中国氯碱,2010,8(2):28-29
[14]夏黎明,王宏青.EDTA 络合滴定钙、镁方法的改进[J].湖南化工,2009,28(2):43-45
[15]国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2010,932
Study on the Ratio of Solid Calcium Indicator
Song Xiuli Yi Wei
(Department of Chemistry,Taiyuan Normal University,Taiyuan 030031,China)
To study the best ratio of solid calcium indicator.Experimental results under certain conditions have been compared from the determination of calcium iron with different ratio solid calcium indicator.Experimental results showed that the best mass ratio was 1:100 of solid calcium indicator and sodium chloride.At this ratio the sharp color changed in end point,the accuracy was significantly improved.This method has been applied to the determination of calcium sample with satisfactory result.The determination results was the same as national standard method consistent with the recovery of 99.9% ~107.7%RSD was less than 1.53%.So this method can be used to determine the calcium sample and monitor the quality products.
calcium indicator;EDTA;calcium determination;best ratio
张丽萍】
1672-2027(2012)01-0117-06
O652
A
2011-06-20
宋秀丽(1973-),女,山西长治人,太原师范学院化学系副教授,太原理工大学在读博士,主要从事药物分析研究.
