肌醇与牛血清白蛋白相互作用的荧光光谱研究
2012-01-08王志军梁瑞瑞雷海英
王志军,梁瑞瑞,雷海英
(1.长治学院 化学系,山西 长治046011; 2.长治学院 生物科学与技术系,山西 长治046011)
肌醇与牛血清白蛋白相互作用的荧光光谱研究
王志军1*,梁瑞瑞1,雷海英2
(1.长治学院 化学系,山西 长治046011; 2.长治学院 生物科学与技术系,山西 长治046011)
应用荧光光谱研究了肌醇与牛血清白蛋白(BSA)分子间的相互作用;求出了猝灭常数,讨论了肌醇对BSA构象的影响,并依据能量转移理论确定了肌醇与蛋白的最近距离.结果表明,肌醇与BSA两者间的相互作用为单一的动态猝灭过程.
肌醇;牛血清白蛋白;相互作用;荧光光谱
血清白蛋白是血浆中最丰富的载体蛋白,它能与许多内源和外源性化合物结合,起到存储和转运的作用[1].肌醇,又称为环己六醇(结构式见图1),是维生素B族中的一种.肌醇和胆碱一样是亲脂肪性的维生素,它有9种立体异构体,其中有医用价值的内消旋体,可促进细胞新陈代谢、助长发育、增进食欲,用于治疗肝脂肪过多症、肝炎、肝硬化症等[2].有关肌醇与血清白蛋白相互作用的研究尚未见报道.作者利用荧光光谱研究肌醇与牛血清白蛋白(BSA)的相互作用.
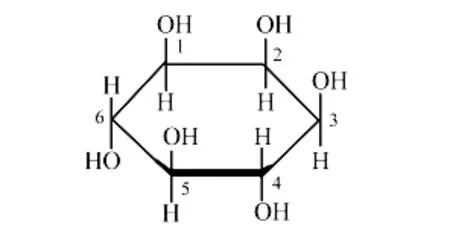
图1 肌醇的结构式Fig.1 Structure of inositol
1 实验部分
1.1 仪器与试剂
F-4600荧光分光光度计(日本日立公司),U-3900紫外分光光度计(日本日立公司),电子天平(上海越平科学仪器有限公司),牛血清白蛋白(北京奥博星生物技术有限责任公司),肌醇(国药集团化学试剂有限公司),实验所用试剂均为分析纯;水为二次蒸馏水.
1.2 实验方法
准确移取1.0mL用pH =7.4Tris-HCl缓冲溶液配置好的BSA溶液(1.0×10-6mol/L)于比色皿中,固定荧光激发波长为290nm,扫描其荧光光谱,所用液池为1cm石英池,入射狭缝为5.0nm,出射狭缝为1.0nm,此外分别设置Δλ=60nm和Δλ=15nm,扫描加入不同量肌醇时蛋白质溶液的同步荧光光谱.
2 结果与讨论
2.1 肌醇与BSA相互作用的荧光光谱
肌醇自身存在很小的荧光,与BSA相比几乎可以忽略.固定荧光激发波长为290nm,25℃下的BSA荧光光谱图以及在肌醇作用下的BSA荧光猝灭光谱图见图2.从图2可以看出,固定BSA的量,向其中加入不同量的肌醇溶液,随着肌醇量的增加,BSA在340nm处的荧光特征发射峰强度明显降低,峰形无明显变化,说明肌醇对BSA的荧光有猝灭作用,二者之间存在相互作用.
2.2 猝灭机理的确定和猝灭常数的测定
荧光猝灭分为静态猝灭和动态猝灭[3].静态猝灭是因为猝灭剂分子和荧光物质分子间形成了非荧光性的复合物;动态猝灭是因为猝灭剂分子和荧光物质的激发态分子之间相互碰撞而导致荧光猝灭.动态猝灭常数随着温度升高而增强,静态猝灭正好相反.假设该猝灭过程是动态猝灭,应符合Stern-Volmer方程[3-5],即

式中,F0和F分别为不加入和加入肌醇时BSA的荧光强度;KSV为动态猝灭常数;[Q]为猝灭剂的浓度.
根据不同温度下的荧光猝灭图(图3),按式(1)可以求出3个温度下的KSV,数据见表1,从中可以看出猝灭常数随温度的升高而增大,由此结果可知,肌醇猝灭BSA荧光的过程是动态猝灭过程.
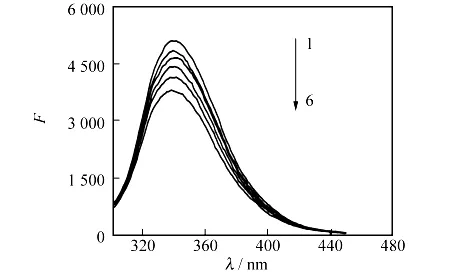
图2 肌醇-BSA的荧光猝灭光谱图Fig.2 Fluorescence quenching spectra of BSA in the presence of inositol
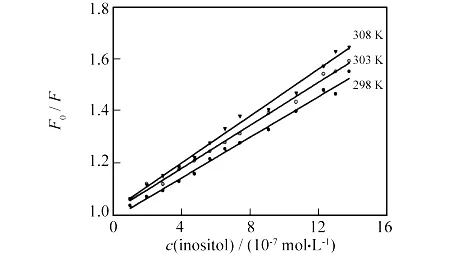
图3 肌醇对BSA荧光猝灭的Stern-Volmer曲线Fig.3 Stern-Volmer curves of BSA quenched by inositol

表1 肌醇与BSA结合的Stern-Volmer方程及常数Table 1 Stern-volmer quenching constants at different temperature
2.3 肌醇与BSA的结合距离
Förster偶极-偶极无辐射能量转移理论认为:供体能发荧光,供体的荧光发射光谱与受体的吸收光谱有足够的重叠,供体与受体足够接近,且最大距离不超过7nm时,将发生非辐射能量转移,从而导致荧光体的荧光猝灭现象.因此,可以求得小分子与蛋白质大分子的结合位置相对于发射荧光的基团之间的距离r和能量转移效率E.根据此理论,非辐射能量转移效率E、供体与受体之间的结合距离r及临界能量转移距离R0之间有下列关系[6]:

式中:F和F0分别为存在和不存在受体时供体的荧光发射强度;K2为供体-受体各项随机分布的取向因子,取平均值2/3;N为介质的折射指数,取水和有机物平均值1.336;φ为供体的荧光量子产率,取0.118;J为供体的荧光发射光谱和受体的吸收光谱之间的光谱重叠积分;Fλ为供体在波长λ处的荧光强度;ελ为受体在波长λ处的摩尔吸光系数.

图4 BSA的荧光光谱(a)和肌醇的吸收光谱(b)Fig.4 Fluorescence emission spectrum of BSA (a)and absorption spectrum of inositol(b)
293K下,在300~500nm波段,肌醇的吸收光谱及BSA的荧光光谱见图4.将图4中光谱重叠部分积分,求得光谱的重叠积分J=2.28×10-14cm3·L·mol-1,计算求得BSA体系的能量转移效率E=0.23,结合距离r=4.9nm.
据Förster非辐射能量转移理论,当供体的荧光发射光谱与受体的吸收光谱有足够的重叠,且供体与受体之间的最大距离不超过7nm时,将会发射非辐射能量转移,导致供体荧光猝灭.所以,肌醇与牛血清白蛋白分子之间发生的是非辐射能量转移.
2.4 肌醇对BSA构象的影响
同步荧光光谱可以反映小分子对蛋白质构象的影响.对于蛋白质的同步荧光光谱,当Δλ=15nm时只显示酪氨酸残基的光谱特征,而当Δλ=60nm时仅表现色氨酸残基的光谱特征[7].因残基的最大吸收波长与其所处的环境的极性有关,故而由发射波长的改变可以判断蛋白质构象的变化.若最大发射波长红移,表明残基所处环境的极性增加,蓝移则疏水性增加.BSA的同步荧光光谱图见图5.由图5可知,当Δλ=60nm时,色氨酸荧光显著猝灭,而酪氨酸残基发射的荧光猝灭不明显,表明肌醇与牛血清白蛋白结合位点更接近于色氨酸残基;酪氨酸残基的发射波长没有改变,色氨酸残基的发射波长稍微有点蓝移,说明形成的复合物使色氨酸的生色团疏水结构变紧密,肽链的伸展程度减少,疏水性增加[7],因此,肌醇的结合使BSA构象发生了一定的变化.
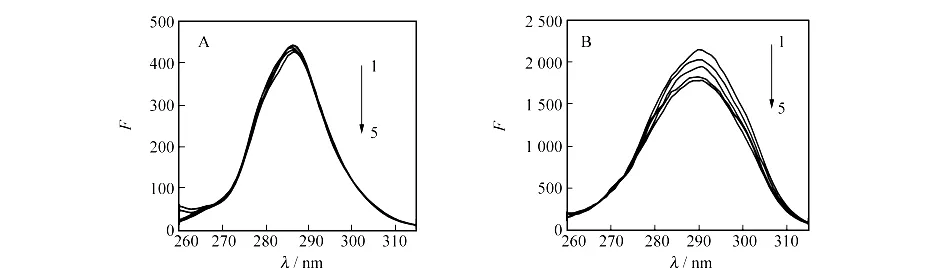
图5 肌醇对BSA同步荧光光谱的影响Fig.5 Synchronous fluorescence spectra of BSA quenched by inositol
3 结论
用荧光光谱探讨了肌醇对牛血清白蛋白荧光猝灭的机理.研究结果表明,肌醇与牛血清白蛋白之间的相互作用属于动态猝灭.同步荧光光谱表明肌醇的加入增加了牛血清白蛋白内部色氨酸残基所处环境的疏水性.
[1]肖厚荣,盛良全,施春华,等.水杨酸与牛血清蛋白相互作用的荧光光谱研究[J].光谱学与光谱分析,2004,24(1):78-81.
[2]陈 威.肌醇[J].生物学通报,1997,32(10):26.
[3]赵 芳,梁 慧,程 惠,等.大黄酸铜(Ⅱ)配合物与牛血清白蛋白的相互作用[J].高等学校化学学报,2011,32(6):1277-1283.
[4]尚永辉,孙家娟,刘 静.水飞蓟素与牛血清白蛋白相互作用的荧光光谱研究[J].化学研究,2011,22(2):1-3.
[5]丁 玲,李 曦,张超灿.磁性微球与牛血清白蛋白的相互作用[J].化学研究,2010,21(1):19-22.
[6]杨曼曼,杨 频,张立伟.荧光法研究咖啡酸类药物与白蛋白的作用[J].科学通报,1994,39(1):31-35
[7]张晓威,赵风林,李克安.环丙沙星与牛血清白蛋白相互作用的研究[J].高等学校化学学报,1999,20(7):1063-1067.
Fluorescence spectrometric study of the interaction between inositol and bovine serum albumin
WANG Zhi-jun1*,LIANG Rui-rui1,LEI Hai-ying2
(1.DepartmentofChemistry,ChangzhiUniversity,Changzhi046011,Shanxi,China;2.DepartmentofBiologicalSciencesandBiotechnology,ChangzhiUniversity,Changzhi046011,Shanxi,China)
The interaction between inositol and bovine serum albumin (BSA)at different temperature was investigated by means of fluorescence spectrometry.Quenching constant was obtained,and the effect of inositol on the conformation of BSA was discussed.Moreover,the shortest distance between inositol and BSA was determined based on energy transfer theory.Results show that only dynamic quenching exists between inositol and BSA.
inositol;bovine serum albumin;interaction;fluorescence spectrometry
O 657.39
A
1008-1011(2012)01-0064-03
2011-08-16.
山西省高校科技开发项目(20081042)和长治学院校级资助项目(2011116).
王志军(1980-),男,副教授,博士,主要从事生物无机化学研究工作.*
.
