锌离子对缓冲液中槲皮素和牛血清白蛋白相互作用的影响
2012-01-08付彩霞王继超高宗华
付彩霞,王继超,高宗华
(滨州医学院 化学教研室,山东 烟台264003)
锌离子对缓冲液中槲皮素和牛血清白蛋白相互作用的影响
付彩霞,王继超,高宗华
(滨州医学院 化学教研室,山东 烟台264003)
采用荧光光谱法和紫外光谱法研究了Zn2+离子对槲皮素(Qct)和牛血清白蛋白(BSA)在pH=7.4的Tris-HCl缓冲溶液中相互作用的影响;根据荧光猝灭双倒数图计算了Qct和BSA之间的结合常数和结合位点数.结果表明,Qct和Zn2+离子都可以使BSA的荧光强度发生猝灭;Qct和BSA之间的结合常数为3.17×107L·mol-1·s-1,结合位点数为1.32.定量计算表明,加入Zn2+离子后,Qct与BSA间的结合常数显著降低、结合位点数减小,表明Zn2+离子参与了Qct与BSA的结合过程.
锌离子;槲皮素;牛血清白蛋白;相互作用
槲皮素(Quercetin,Qct,结构见图1)是存在于多种植物中的多羟基黄酮类化合物,具有防治心血管疾病、增强免疫、抗癌、抗菌、抗炎、抗病毒等功能[1-5],受到人们的广泛关注.Zn2+离子是较强的Lewis酸,其含量在生物体内微量金属中居第二位,它对蛋白质的物质转运、结构支撑等有直接作用.人体缺锌会引起伤口不易愈合、皮肤及黏膜溃疡、嗅觉迟钝、发育不良,并直接影响骨骼发育.
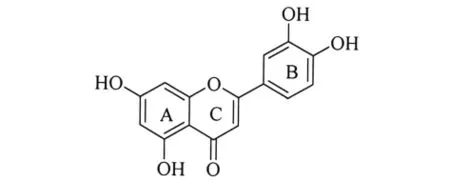
图1 Qct的化学结构Fig.1 Chemical structure of quercetin
作者在模拟人体生理pH条件下,用荧光光谱法和紫外光谱法研究Qct与BSA相互作用,探讨了Zn2+离子存在下Qct与BSA间结合常数的变化,阐明了Zn2+的浓度对Qct和BSA结合作用的影响.这对于更全面地了解药物在体内与白蛋白的结合情况具有重要意义.
1 实验部分
1.1 仪器与试剂
pH-3C酸度计(上海逸龙科技有限公司);电热恒温水浴锅(上海实验仪器厂有限公司);KQ-500B型超声波清洗器(昆山市超声仪器有限公司);电子分析天平(美国奥豪斯OHAUS电子天平,AR1140);LS-55荧光分光光度计(美国,PE公司);TU-1901双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司).
牛血清白蛋白(生化试剂,中国医药集团上海化学试剂公司),槲皮素(国药集团化学试剂有限公司).用0.1mol·L-1pH =7.4的Tris-HCl(内含0.1mol·L-1NaCl维持离子强度)缓冲溶液配制浓度为1.18×10-6mol·L-1的牛血清白蛋白溶液;Qct用无水乙醇溶解配制成1.00×10-3mol·L-1的储备溶液;配制浓度为0.01mol·L-1的硫酸锌溶液,备用.实验用水为二次蒸馏水,经检测均无荧光杂质.
1.2 实验方法
1.2.1 荧光光谱测定方法
在1cm比色皿中加入3.00mL 1.18×10-6mol·L-1的BSA溶液,用微量注射器逐次加入1.00×10-4mol·L-1的Qct溶液进行荧光滴定,摇匀,静置5min,21℃下扫描荧光光谱,激发波长为280nm.固定BSA和Zn2+离子的浓度,改变Qct的浓度,扫描荧光光谱.
1.2.2 紫外光谱测定方法
固定Qct的浓度为1.00×10-4mol·L-1,改变Zn2+离子的量,以试剂空白为参比,记录21℃下在200~400nm待测溶液的紫外吸收光谱.
2 结果与讨论
2.1 Qct和Zn2+离子对BSA的猝灭作用
以λex=280nm,在300~500nm范围内,在BSA溶液中分别加入相同浓度的Zn2+离子和Qct溶液后,BSA的最大荧光峰位置没有发生变化,但荧光强度均有一定程度的降低(见图2),其中Zn2+的加入使BSA荧光降低的程度较缓,而相同浓度的Qct使BSA的荧光显著降低,Zn2+离子与Qct共同存在下BSA的荧光强度下降得更加明显.表明Qct和Zn2+离子分别与BSA发生了相互作用.

图2 Zn2+和Qct存在下BSA的荧光光谱Fig.2 Fluorescence spectra of BSA in the presence of Qct and Zn2+
2.2 Qct和BSA的结合作用
由表1可见随着Qct浓度的增大,F0/F的数值也增大,即BSA的最大荧光发射峰强度逐渐降低,表明Qct的加入对BSA有荧光猝灭作用.
荧光猝灭作用因猝灭机制不同可分为动态猝灭、静态猝灭.动态猝灭和静态猝灭作用可分别用Stern-Volmer方程计算[6-7],即F0/F=1+KSV[Q]=1+Kqτ0c(Qct),式中F0和F为猝灭剂不存在和存在时蛋白的荧光强度(单位a.u.),c(Qct)为猝灭剂浓度(单位 mol·L-1),KSV为猝灭常数(单位L·mol-1),τ0为蛋白荧光寿命(单位s),生物大分子的平均寿命约为10-8s[8],Kq为双分子猝灭过程的速率常数(单位L·moL-1·s-1).以F0/F对c(Qct)作出Qct对BSA的荧光猝灭图.

表1 Qct对BSA荧光强度的影响Table 1 Effect of Qct on fluorescence intensity of BSA
图3中曲线有很好的线性关系.文献表明,各类猝灭剂对生物大分子荧光的作用,其最大动态荧光猝灭速率常数约为2.0×1010L·mol-1·s-1[9].根据实验所得KSV=5.17×105L·mol-1,可以算出 Qct对BSA的荧光猝灭速率常数Kq=5.17×1013L·mol-1·s-1,远大于2.0×1010L·mol-1·s-1.由此可推断,Qct对BSA荧光的猝灭不是动态碰撞引起的,而是由于药物和蛋白形成了配合物而导致的静态猝灭,表明Qct与BSA分子间形成了二元配合物.这一结论,与文献报道一致[10].
根据静态猝灭理论和lg((F0-F)/F)=lgK+nlgc(Qct),K为药物与白蛋白分子的结合常数(单位L·mol-1),n为结合位点数.以lg((F0-F)/F)对lgc(Qct)作图,得图4.由图4斜率得结合常数为K=3.17×107L·mol-1·s-1,结合位点数n=1.32,线性相关系数R=0.986 8,可见 Qct和BSA之间具有较强的结合作用.
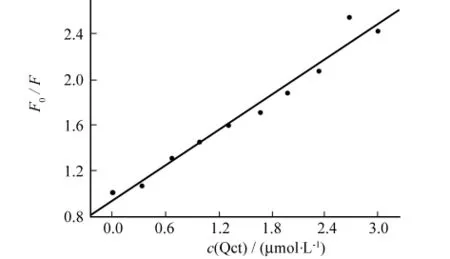
图3 Qct对BSA的Stern-Volmer荧光猝灭曲线Fig.3 The Stern-Volmer curves of fluorescence quenching of BSA by Qct

图4 lg((F0-F)/F)对lgc(Qct)的关系图Fig.4 The plot of lg((F0-F)/F)against lg c(Qct)
2.3 Zn2+离子存在下Qct对BSA荧光的影响
为了进一步探讨Zn2+离子对Qct与BSA结合作用的影响,研究了在三种不同浓度Zn2+离子的存在下Qct与BSA之间的结合常数K和结合位点数n的变化情况,结果见表2.
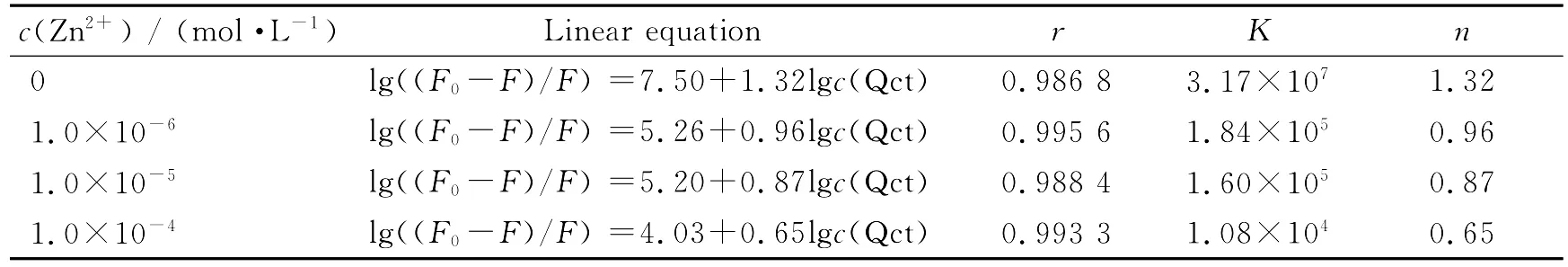
表2 不同浓度Zn2+离子存在下Qct与BSA的结合常数及结合位点数Table 2 Binding constants(K)and number of binding sites(n)of Qct and BSA in the presence of different concentration of Zn2+ion(pH =7.4;c(BSA)=1.0×10-6 mol·L-1)
表2结果表明,随着Zn2+离子浓度的增大,Qct与BSA的结合常数和结合位点数均显著降低.这可能由以下两个原因所导致:(1)Zn2+离子能够与BSA的氨基酸残基发生结合,部分占据了Qct与BSA原来结合的位点.(2)Qct充当了Zn2+离子的配体,与Zn2+离子发生结合,生成了锌配合物,所形成的配合物具有不同于Qct所拥有的分子构型、体积、刚柔性、亲水疏水性等性质,使其难以进人BSA的疏水腔而与色氨酸残基结合,从而导致了与BSA的结合常数、结合位点数变小.
2.4 Zn2+与Qct溶液的紫外光谱
上述结果表明,在Tris-HC1缓冲溶液体系中Zn2+离子显著影响Qct与BSA的结合.为探明在Qct与BSA的作用过程中Zn2+离子仅仅发挥了协同作用还是与Qct形成了新的配合物而产生的影响,采用紫外吸收光谱法进一步探索了Zn2+离子与Qct的结合.Qct在紫外区均有2个吸收带:375nm和255nm,前者是由B环(图1)桂皮酰基的电子跃迁引起的吸收,后者是由A环(图1)苯甲酰基的电子跃迁引起的吸收[11].从图5可以看出Zn2+离子的加入使Qct的紫外吸收带发生了红移,光谱形状也发生了较大的变化.该结果表明,Zn2+与Qct发生了结合,形成了Qct-Zn2+配合物.
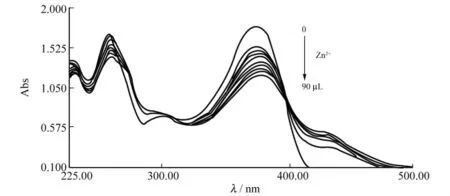
图5 Zn2+离子存在下Qct的紫外光谱变化Fig.5 Variation of the ultraviolet spectra of Qct(100μmol·L-1)in the presence of Zn2+ion
3 结论
用荧光法较详尽地研究了Zn2+离子存在下Qct与BSA的相互作用.结果表明,Qct和Zn2+离子都能使BSA的荧光发生猝灭,并且Zn2+离子的加入则进一步导致了BSA的荧光猝灭.定量计算表明,加人Zn2+离子后Qct与BSA间的结合常数显著降低、结合位点数减小,并且随着Zn2+离子浓度的增大,Qct和BSA的结合能力减弱.紫外光谱显示,Zn2+离子与Qct发生了配位反应,形成了新的配合物.可以推断,在Zn2+离子存在下,Qct与BSA的结合在很大程度上是Qct的锌配合物与其相互作用.
[1]吕 蔡,张 杰.槲皮素的药理作用[J].国外医药-植物药分册,2005,20(3):108-112.
[2]宋玉乔,姚凌云,曹 蔚,等.槲皮素的药理作用研究近况[J].西北药学杂志,2002,17(1):40-42.
[3]王艳芳,王 新,朱宇同,等.槲皮素药理作用研究进展[J].天然产物研究与开发,2003,15(2):171-173.
[4]廖卫平,司芝坤.荧光光谱法研究槲皮素与牛血清白蛋白的相互作用[J].烟台大学学报:自然科学与工程版,2006,19(1):20-24.
[5]王 春,吴秋华,王 志,等.槲皮素与牛血清白蛋白相互作用的研究[J].光谱学与光谱分析,2006,26(9):1672-1675.
[6]陈国珍,黄贤智,郑朱梓,等.荧光分析法,第2版[M].北京:科学出版社.1990:64-86.
[7]杨曼曼,席小莉,杨 频.变温下荧光猝灭和加强理论公式合理性的比较[J].化学学报,2006,64(14):1437-1445.
[8]邓世星,杨季冬.荧光法研究酚藏花红与牛血清白蛋白的相互作用[J].分析测试学报,2007,26(3):360-364.
[9]吴根华,汪 婕,郭 畅,等.荧光光谱法研究氟咯沙星-锌(Ⅱ)-牛血清白蛋白的三元配合[J].光谱学与光谱分析,2007,27(4):765-768.
[10]王 玲,屈凌波,杨 冉,等.槲皮素和芦丁与牛血清白蛋白相互作用研究[J].分析科学学报,2006,22(6):719-722.
[11]陈旭龙,杨晓占,李瑞霞,等.槲皮素-Sn(II)配合物荧光、紫外及红外光谱的测量与分析[J].光散射学报,2007,19(4):369-373.
Effect of zinc ion on interaction between quercetin and bovine serum albumin in buffer solution
FU Cai-xia,WANG Ji-chao,GAO Zong-hua
(TeachingandResearchSectionofChemistry,BinzhouMedicalCollege,Yantai264003,Shandong,China)
The effect of Zn2+ion on the interaction between quercetin(Qct)and bovine serum albumin(BSA)in Tris-HCl buffer solution(pH = 7.4)was investigated by means of fluorescence spectrometry and ultraviolet spectrometry.The binding constant(K)and number of binding sites(n)of Qct and BSA were calculated according to Stern-Volmer equation and double-reciprocal equation.Results show that both quercetin and Zn2+ion can quench the fluorescence intensity of BSA.In the system of binary complex of Qct and BSA,K=3.17×107L·mol-1·s-1andn=1.32.Quantitative calculation shows that the binding constant and the number of binding sites of Qct and BSA decrease in the presence of Zn2+ion.This indicates that Zn2+ion has taken part in the combining process between Qct and BSA.
zinc ion;quercetin;bovine serum albumin;interaction
O 657.3
A
1008-1011(2012)01-0060-04
2011-08-12.
山东省教育厅科技计划项目(J08LG15).
付彩霞(1963-),女,副教授,硕士,主要从事金属有机化合物的合成与研究.
