凡纳滨对虾翻译控制肿瘤蛋白Fortilin的毕赤酵母表达及其对血细胞免疫反应的影响*
2012-01-08张文兵麦康森
周 怡,张文兵,麦康森
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
凡纳滨对虾翻译控制肿瘤蛋白Fortilin的毕赤酵母表达及其对血细胞免疫反应的影响*
周 怡,张文兵**,麦康森
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
翻译控制肿瘤蛋白Fortilin是1种多功能蛋白,参与重要的细胞活动。并且,对虾fortilin通过抑制病毒复制干扰病毒感染。参照Genbank中fortilin基因序列设计引物,PCR扩增得到凡纳滨对虾fortilin目的基因片段,EcoR I/Xba I双酶切插入表达载体pGAPZαA,转化大肠杆菌,经博来霉素(Zeocin)抗性筛选及测序分析,获得分泌型重组酵母表达载体pGAPZαA-F。酶切线性化后,经电穿孔法转入毕赤酵母细胞X-33,经Zeocin抗性筛选,得到阳性转化子。表达产物的上清液经SDS-PAGE电泳和质谱分析,表明在酵母中成功表达fortilin。以体外原代培养的对虾血细胞检测重组蛋白的免疫活性,结果显示重组蛋白显著提高了血细胞酚氧化酶和超氧化物歧化酶活性。该结果为下一步研究重组fortilin在对虾养殖中的应用奠定了基础。
凡纳滨对虾;fortilin;毕赤酵母;血细胞;免疫
翻译控制肿瘤蛋白(translationally controlled tumor protein,TCTP),是1种高度保守,大量表达的真核蛋白,最初在小鼠艾氏腹水肿瘤细胞和红白血病细胞中发现[1-2]。Gross等将其命名为“翻译控制肿瘤蛋白”,是因为这种蛋白在肿瘤细胞中的表达量要高于正常细胞,并且蛋白表达在翻译水平上受到高度的调控[3]。Li等把在人类中发现的1种TCTP命名为fortilin,是一类新的抗凋亡蛋白质[4]。研究表明,翻译控制肿瘤蛋白fortilin具有重要的生物学功能,包括调节细胞周期进程和恶性转移[5]、钙结合功能[6-7]、细胞外组胺释放活性[9-11]、抗凋亡[4]及抗疟疾作用[12]等。
迄今为止已克隆得到多种对虾的TCTP/fortilin基因,包括斑节对虾Penaeus monodon、凡纳滨对虾Litopenaeus vannamei、日本囊对虾Marsupenaeus japonicus和中国明对虾Fenneropenaeus chinensis等[13-15]。研究表明,对虾fortilin具有相似的钙结合以及抗凋亡活性,并且,fortilin参与对虾抗病毒反应,能够保护对虾抵抗病毒感染[15-17]。然而,这些结果都是在“离体”研究或者是通过肌肉注射fortilin的实验中得到的。在对虾的集约化养殖中,通过口服(饲料)途径导入活性制剂是1种高效、可行和节约成本的方式。为了实现在对虾饲料中的应用,批量制备fortilin及其制剂是必备的基础条件。
本研究拟构建凡纳滨对虾fortilin分泌表达载体,并探索在毕赤酵母Pichia pastoris中的表达。同时,分析表达物对血细胞免疫反应的影响,为进一步研究fortilin的功能,以及开发重组fortilin酵母工程菌株应用于对虾饲料提供基础数据。
1 材料与方法
1.1 材料
1.1.1 动物材料 凡纳滨对虾,购于青岛宝荣水产科技发展有限公司,暂养于循环水系统,选取体长8.0~10.0cm的健康对虾为材料。
1.1.2 质粒与菌种 表达质粒pGAPZαA和毕赤酵母X-33(Invitrogen)由中国水产科学研究院黄海水产研究所宋晓玲研究员惠赠。E.coli Competent Cells DH5α购自TaKaRa公司。
1.1.3 试剂 PrimeScript反转录酶,Pyrobest高保真DNA聚合酶,T4DNA连接酶,限制性内切酶EcoR I,XbaI,BlnI(AvrII),核酸分子量标准(DL2000),低分子量蛋白标准,DNA凝胶回收试剂盒,质粒纯化试剂盒等均购自TaKaRa公司。Trizol试剂、博来霉素(Zeocin)购自Invitrogen公司。酵母提取物、蛋白胨和琼脂为BBI公司产品。葡萄糖为AMRESCO公司产品。Leibovitz’s L-15培养基、胎牛血清购自Gibco公司。其他均为国产分析纯试剂。
1.1.4 引物设计 根据GenBank的凡纳滨对虾fortilin基因序列(GenBank ID:DQ231062)设计引物fortilin-F、Fortilin-R,并依据pGAPZαA载体上的酶切位点以及fortilin基因序列的酶切特性,分别在正向引物中引入限制性内切酶EcoRI识别位点(GAATTC),在反向引物引入限制性内切酶Xba识别位点(TCTAGA),引物(5′-3′)序列如下:Fortilin-F:CCGGAATTCATGAAG GTCTTCAAGGACATGCTCACAGGT,Fortilin-R:GCTCTAGATTATAGCTTCTCCTCTGTTAGACCGTATTTTGG。另外,按照Invitrogen公司pGAPZ手册提供的引物序列(5′-3′),合成一对载体引物pGAP-F:GTCCCTATTTCAATCAATTGAA,3′AOX1:GCAAATGGCATTCTGACATCC,以上引物均由上海博尚生物技术有限公司合成。
1.2 方法
1.2.1 Fortilin基因的PCR扩增 取凡纳滨对虾肝胰脏,Trizol法提取总RNA,反转录合成cDNA,以引物对Fortilin-F/Fortilin-R进行PCR扩增,反应总体积50μL,反应循环参数为:94℃预变性2min,94℃变性30s、57.5℃退火30s、72℃延伸1min,32个循环,72℃延伸10min。使用DNA凝胶回收试剂盒回收纯化目的基因片段。
1.2.2 重组表达载体的构建 对空质粒载体和fortilin基因PCR产物分别进行EcoRI和XbaI双酶切,切胶纯化后T4DNA连接酶于16℃连接过夜,转化感受态大肠杆菌DH5α,在含25μg/mL Zeocin的LB培养基上培养,PCR扩增鉴定阳性克隆,并选取阳性克隆委托上海博尚生物技术有限公司测序,将鉴定正确的重组质粒命名为pGAPZαA-F。
1.2.3 重组表达载体转化酵母 纯化重组质粒pGAPZαA-F及空质粒pGAPZαA,BlnI酶切使之线性化。参照Invitrogen公司毕赤酵母操作手册制备酵母X-33感受态细胞。线性化质粒电击转化酵母,涂布Zeocin(100μg/mL)抗性YPDS平板,筛选阳性转化子。提取酵母基因组DNA,以引物对pGAP-F/3′AOX1进行PCR鉴定,阳性重组酵母命名为X-33/pGAPZαAF,转空白质粒pGAPZαA的酵母作为对照。
1.2.4 重组子X-33/pGAPZαA-F的表达与分析 挑取重组酵母单克隆至10mL YPD培养基中,30℃振荡过夜培养。取0.1mL过夜培养物接种至50 mLYPD培养基中,30℃振荡培养72h。培养物13 500r/min离心2min,收集上清进行SDS-PAGE电泳检测,表达蛋白委托广州慧晶生物科技有限公司进行串联飞行时间质谱分析进一步鉴定。
1.2.5 凡纳滨对虾血细胞的原代培养 取健康凡纳滨对虾,75%酒精消毒体表,用1mL注射器吸取抗凝剂(10mmol/L EDTA Na2,450mmol/L NaCl,10 mmol/L KCl,10mmol/L HEPES,pH=7.3,调节渗透压至850mOsm/kg)[18],等比从对虾腹血窦抽取血淋巴。400r/min离心10min,用培养基重悬血细胞,血球计数板计数,调整细胞密度为1×106,加入96孔细胞培养板,28℃恒温培养。基础培养基为2×Leibovitz's L-15,并添加20%胎牛血清,100IU/mL青霉素和100μg/mL链霉素。
1.2.6 重组表达产物对血细胞免疫活性的检测 重组子表达上清液真空冷冻干燥以进行活性检测,同时空质粒重组子酵母培养上清液同样冷冻干燥作为对照处理,重组子X-33/pGAPZαA-F及空质粒酵母上清液冻干粉分别命名为F和P。血细胞接种于96孔细胞培养板培养24h使细胞贴壁,然后分别加入100、200、500μg/mL的F和P,继续孵育24h。每个浓度设置4个重复。同时,以相同体积的培养基作为对照。样品孵育后的血细胞一部分直接进行呼吸爆发活性检测,另一部分收集后0℃超声破碎,5 000r/min离心10min,上清用于免疫酶活检测。
呼吸爆发活性:参考Song等的方法[19],血细胞中加入100μL 0.3%NBT,37℃温育30min,温育结束,560r/min,4℃离心10min,去除上清,加入200μL纯甲醇终止反应。10min后,700r/min,4℃离心10min,去除上清,70%甲醇洗涤3次,离心去除上清后,室温晾干。干燥后,加入120μL 2mol/L KOH和140μL DMSO,充分溶解,测定溶液在波长630nm下的吸光值。呼吸爆发活性表示为OD630。
酚氧化酶活性:参考Hernández-López等的方法略作改动[20]。取50μL上述血细胞上清液与50μL胰蛋白酶溶液(0.1mg/mL溶于CAC缓冲液)(CAC缓冲液:10mmol/L二甲胂酸钠10mmol/L CaCl2,pH=7.0)加入96微孔板中,室温下温育10min,然后加入50μL L-DOPA溶液(3mg/mL溶于CAC缓冲液),室温下温育10min后,立刻放入酶标仪中,在492nm波长下测定酶活动力学。以实验条件下,每分钟每毫升血细胞上清液OD492增加0.001为1个酶活力单位。
超氧化物歧化酶(SOD)活性和一氧化氮合酶(NOS)活性均使用南京建成试剂盒测定。SOD活性定义为每mL反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活力单位;NOS酶活力定义为每mL样品每分钟生成1nmol NO为1个酶活力单位。
1.2.7 统计分析 用SPSS统计软件对实验各处理的数据进行方差分析,当不同处理之间存在显著差异(P<0.05)时,采用Tukey多重比较。所有数值用平均值±标准差表示。
2 结果
2.1 目的基因扩增及重组质粒鉴定
以凡纳滨对虾肝胰腺cDNA为模板进行PCR扩增,琼脂糖凝胶电泳检测获得507bp左右的预期条带(见图1),经与质粒载体pGAPZαA双酶切、连接、转化大肠杆菌,挑选阳性转化子测序,结果表明,阅读框插入正确,无移码错配,即组成型重组表达载体pGAPZαA-F构建成功。
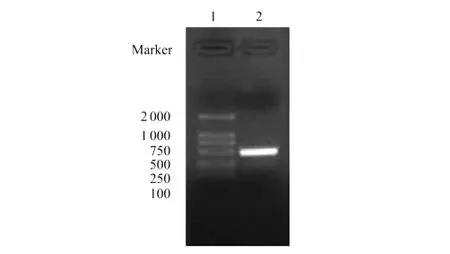
图1 凡纳滨对虾fortilin基因电泳图Fig.1 PCR amplification of fortilingene of Litopenaeus vannamei
2.2 重组酵母表达产物的SDS-PAGE检测
选择阳性酵母菌株的发酵上清进行SDS-PAGE电泳检测,考马斯亮蓝染色结果如图2所示。对比空载质粒的酵母发酵上清,重组酵母发酵上清中明显存在大小约为30KDa目的蛋白电泳条带。进一步的质谱鉴定得到fortilin阳性肽段序列,由此说明fortilin在毕赤酵母中成功表达并分泌到发酵上清中。

图2 重组酵母发酵上清的SDS-PAGE电泳Fig.2 SDS-PAGE analysis of fusion protein expression in P.pastoris
2.3 重组蛋白免疫活性检测
重组fortilin对凡纳滨对虾原代培养的血细胞的呼吸爆发活性、酚氧化酶、超氧化物歧化酶以及一氧化氮合酶活性产生了不同程度的影响(见表1)。各浓度重组fortilin对呼吸爆发活性和一氧化氮合酶活性均没有显著影响(P>0.05);与对照和空质粒酵母组相比,100、500μg/mL重组fortilin显著提高了血细胞酚氧化酶活性(P<0.05);3个浓度的重组fortilin处理组的血细胞超氧化物歧化酶活性显著提高(P<0.05),但200、500μg/mL处理组与相同浓度的空质粒酵母组无显著差异(P>0.05)。

表1 不同浓度重组蛋白对凡纳滨对虾血细胞免疫活性的影响(平均值±标准误)1Table 1 Effects of fusion proteins on immune responses of hemocytes of Litopenaeus vannamei(mean±S.E.)
3 讨论
病害流行,尤其是病毒病的爆发给世界对虾养殖业造成了巨大的损失,抗病毒蛋白或多肽的研究和开发具有重要意义。Fortilin是1种多功能蛋白,参与多种细胞活动[5]。研究表明,fortilin的表达在受到白斑病毒刺激时发生上调[15]。并且,有学者利用昆虫Sf9细胞研究了fortilin和病毒基因之间的相互作用,结果显示fortilin抑制WSSV早期基因(DNA聚合酶基因)和晚期基因(VP15和VP28基因)的表达,表明fortilin通过Ca2+信号和转录控制干扰WSSV增殖[21]。本研究利用毕赤酵母表达系统进行了凡纳滨对虾fortilin的体外表达,为进一步研究fortilin在对虾体内的功能奠定了基础。
Fortilin被证实可以引发嗜碱性白细胞组胺释放,随后研究表明,fortilin具有更广泛的细胞因子样活性,可促进嗜碱性粒细胞分泌IL-4、IL-8、IL-13等促炎性细胞因子[22-23]。Fortilin自身也可以被某些细胞因子诱导,同时也是1种B细胞生长因子,可促进B细胞的增殖、抗体和干扰素的分泌,在哺乳动物的免疫系统中可能具有重要作用[24]。一般认为包括对虾在内的甲壳动物不具备特异性免疫系统,而对虾的防御反应是由循环血细胞以及存在于或从细胞释放到血浆中的多种因子的活性而产生的。因而,对虾的血细胞既是细胞免疫的担当者,又是体液免疫因子的提供者。本研究以体外培养的凡纳滨对虾血细胞为模型研究了重组fortilin的免疫活性。结果表明,重组fortilin显著提高了血细胞酚氧化酶和超氧化物歧化酶活性。甲壳类动物的酚氧化酶原系统在异物识别等免疫反应中起关键作用[20],该系统被激活后可以促进血细胞的吞噬,介导凝集和凝固,产生杀菌物质,参与疾病抵抗[25]。对虾超氧化物歧化酶活性与其免疫能力也有直接的关系,超氧化物歧化酶活性升高,能及时清除机体免疫压力下产生的活性氧,从而保障免疫细胞内氧化还原反应的动态平衡、信号的正常传导及免疫相关基因的正常转录表达,提高了对虾对病原的抵抗能力[26]。因此,本研究认为重组fortilin可能通过相关信号途径激活酚氧化酶和超氧化物歧化酶,从而调节免疫反应。同时,本实验中fortilin处理组呼吸爆发和一氧化氮合酶活性较对照组均有升高趋势,但没有显著差异,表明fortilin可能不参与活性氧生成途径。揭示fortilin在对虾体内调节免疫反应的具体机制,对于利用fortilin有效增强对虾免疫能力很有必要,值得进一步的研究。
在实际生产中,人们更多的关注如何将相关研究转化为方便可行的技术,应用于对虾养殖,以期控制对虾各种疾病。研究者已经进行了多种应用方式的尝试,例如:中和抗体、重组蛋白疫苗、DNA疫苗等,但是这些研究大多是通过注射手段实现的。显然,对于对虾养殖生产而言,注射费时费力,而通过饲料途径添加无疑是一种更好的选择。毕赤酵母表达系统具有表达量高、遗传稳定性好、具备翻译后加工修饰功能、自身分泌蛋白少以及易进行高密度发酵等优点,是1个被广泛应用的高效真核表达系统。本研究成功构建了fortilin重组质粒,并实现了其在酵母的分泌表达,为fortilin作为饲料添加剂在对虾养殖生产中的应用奠定了基础。今后将进一步优化表达条件以提高重组蛋白产量,并通过养殖实验评估其免疫促进特性和抗病功能。
[1] Bohm H,Benndorf R,Gaestel M,et al.The growth-related protein P23of the Ehrlich ascites tumor:translational control,cloning and primary structure[J].Biochemistry International,1989,19(2):277-286.
[2] Yenofsky R,Cereghini S,Krowczynska A,et al.Regulation of mRNA utilization in mouse erythroleukemia cells induced to differentiate by exposure to dimethyl sulfoxide[J].Mol Cell Biol,1983,3(7):1197-1203.
[3] Gross B,Gaestel M,B hm H,et al.cDNA sequence coding for a translationally controlled human tumor protein[J].Nucleic Acids Res,1989,17(20):8367.
[4] Li F,Zhang D,Fujise K.Characterization of fortilin,a novel anti-apoptotic protein[J].J Biol Chem,2001,276:47542-47549.
[5] Bommer U A,Thiele B J.The translationally controlled tumor protein(TCTP)[J].Int J Biochem Cell Biol,2004,36(3):379-385.
[6] Sanchez J C,Schaller D,Ravier F,et al.Translationally controlled tumor protein:aprotein identified in several nontumoral cells including erythrocytes[J].Electrophoresis,1997,18:150-155.
[7] Xu A,Bellamy A R,Taylor J A.Expression of translationally controlled tumor protein is regulated by calcium at both the transcriptional and post transcriptional level[J].Biochemistry Journal,1999,342(3):683-689.
[8] Kim M,Jung Y,Lee K,et al.Identification of the calcium binding sites in translationally controlled tumor protein[J].Arch Pharm Res,2000,23:633-636.
[9] MacDonald S M,Rafnar T,Langdon J,et al.Molecular identification of an IgE dependent histamine releasing factor[J].Science,1995,269(5224):688-690.
[10] Nielsen H V,Johnsen A H,Sanchez J C,et al.Identification of a basophil leukocyte interleukin-3-regulated protein that is identical to IgE-dependent histamine-releasing factor[J].Allergy,1998,53(7):642-652.
[11] Gnanasekar M,Rao K V,Chen L,et al.Molecular characterization of a calcium binding translationally controlled tumor protein homologue from the filarial parasites Brugia malayi and Wuchereria bancrofti[J].Molecular and Biochemical Parasitolo-gy,2002,121(1):107-118.
[12] Bhisutthibhan J,Pan X Q,Hossler P A,et al.The plasmodium falciparum translationally controlled tumor protein homolog and its reaction with the antimalarial drug artemisinin[J].J Biol Chem,1998,273(26):16192-16198.
[13] Bangrak P,Graidist P,Chotigeat W,et al.Molecular cloning and expression of a mammalian homologue of a translationally controlled tumor protein(TCTP)gene from Penaeus monodon shrimp[J].J Biotechnol,2004,108:219-26.
[14] Chen D D,He N H,Lei K Y,et al.Genomic organization of the translationally controlled tumor protein(TCTP)gene from shrimp Marsupenaeus japonicus[J].Mol Biol Rep,2009,36(5):1135-1140.
[15] Wang S,Zhao X F,Wang J X.Molecular cloning and characterization of the translationally controlled tumor protein from Fenneropenaeus chinensis[J].Mol Biol Report,2008,36(7):1683-1693.
[16] Graidist P,Fujise K,Wanna W,et al.Establishing a role for shrimp fortilinin preventing cell death[J].Aquaculture,2006,255:157-164.
[17] Moltira T,Benjamas N,Manasawan S,et al.The role of Pmfortilinin protecting shrimp from white spot syndrome virus(WSSV)infection[J].Fish Shell?sh Immunol,2008,25:633-637.
[18] Vargas A F,Guzman M A.An anticoagulant solution for haemolymph collection and prophenoloxidase studies of penseid shrimp(Penaeus californiensis)[J].Comp Biochem Physiol,1993,106A(1):209-303.
[19] Song H L,Hsieh Y T.Immunostimplation of tiger shrimp(Penaeus monodon)hemocytes for generation of microbicidal substances:analysis of reactive oxygen specied[J].Dev Comp Immuno,1994,18(3):201-209.
[20] Hern ndez L J,Gollas GTS,Vargas A F.Activation of the prophenoloxidase system of the brown shrimp(Penaeus californiensis Holmes)[J].Comp Biochem Physiol C,1996,113:61-66.
[21] Nupan B,Phongdara A,Saengsakda M,et al.Shrimp Pm-fortilininhibits the expression of early and late genes ofwhite spot syndrome virus(WSSV)in an insect cell model[J].Dev Comp Immunol,2011,doi:10.1016/j.dci.2010.11.0.
[22] Yoneda K,Rokutan K,Nakamura Y,et al.Stimulation of human bronchial epithelial cells by IgE-dependent histamine2releasing factor[J].AmJ Physiol Lung Cell Mol Physiol,2004,286(1):174-181.
[23] Schroeder J T,Lichtenstein L M,MacDonald S M.Recombinant histamine-releasing factor enhances IgE-dependent IL-4and IL-13 secretion by human basophils[J].J Immunol,1997,159(1):447-452.
[24] Kang H S,Lee M J,Song H,et al.Molecular identification of IgE-dependent histamine-releasing factor as a B cell growth factor[J].J Immunol,2001,166:6545-6554.
[25] Dziarski R.Peptidoglycan recognition proteins(PGRPs)[J].Mol Immunol,2004,40:877-886.
[26] Campa-C rdova A I,Hernandez-Saavedra,N Y,Ascencio F.Superoxide dismutase as modulator of immune function in American white shrimp(Litopenaeus vannamei)[J].Comp Biochem Physiol C Toxicol Pharmacol,2002,133(4):557-565.
Secretion Expression of Fortilin in Yeast Pichia pastoris and Its Effects on Immune Responses of Hemocytes in White Shrimp Litopenaeus vannamei
ZHOU Yi,ZHANG Wen-Bing,MAI Kang-Sen
(The Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao 266003,China)
Fortilin is a multifunctional protein involved in important cellular activities.In addition,shrimp fortilin may interfere with viral infection,probably by inhibiting viral replication.The fortilin coding sequence(GenBank ID:DQ231062)was amplified by PCR from shrimp(Litopenaeus vannamei)hepatopancreas cDNA.The purified PCR fragments were cloned into the EcoR I/Xba I sites of the pGAPZαA vector.Sequences analysis verified whether the target genes were correctly inserted in right reading frame.The construct was linearized and was integrated into the yeast Pichia pastoris X-33by electroporation under the selection of Zeocin.The expressed proteins were identified by SDS-PAGE and characterized by matrix-assisted laser desorption ionisation-time of flight mass spectrometry(MALDITOF MS).Then the culture supernatants of recombinant yeasts were lyophilized for analysis of immune responses of cultured hemocytes of white shrimp.Results showed that Fortilin fusion proteins significantly improved the activities of phenoloxidase and superoxide dismutase of cultured hemocytes.The present study made the first step for application of Fortilin protein in shrimp feeds.
Litopenaeus vannamei;fortilin;Pichia pastoris;hemocytes;immunity
S945.1
A
1672-5174(2012)1-2-54-05
国家公益性行业(农业)科研专项(201103034)资助
2011-03-22;
2011-04-27
周 怡(1982-),女,博士生。E-mail:zyjc1314@yahoo.com.cn
**通讯作者:E-mail:wzhang@ouc.edu.cn
责任编辑 王 莉
