抑制尖刀镰孢菌(Fusarium oxysporum)南极细菌的筛选及Psychrobacter sp.P4-11-07-1的生长特性*
2012-01-06王红梅何培青林学政董永胜
王红梅,何培青,林学政*,董永胜
(1.山东轻工业学院 食品与生物工程学院,山东 济南250353;2.国家海洋局 第一海洋研究所,山东 青岛266061;3.国家海洋局 海洋生物活性物质重点实验室,山东 青岛266061)
抑制尖刀镰孢菌(Fusarium oxysporum)南极细菌的筛选及Psychrobactersp.P4-11-07-1的生长特性*
王红梅1,2,3,何培青2,3,林学政2,3*,董永胜1
(1.山东轻工业学院 食品与生物工程学院,山东 济南250353;2.国家海洋局 第一海洋研究所,山东 青岛266061;3.国家海洋局 海洋生物活性物质重点实验室,山东 青岛266061)
以植物病原真菌尖刀镰孢菌(Fusarium oxysporum)为指示菌,采用平板扩散法从实验室极地微生物资源库中筛选到12株具有明显抑菌作用的活性菌株。分子鉴定与系统发育分析表明,7株活性菌株属于假交替单胞菌(Pseudoalteromonas)、3株属于嗜冷杆菌(Psychrobacter)、1株属于假单胞菌(Pseudomonas)、1株属于伦黑墨氏菌(Rheinheimera)。抑菌谱测定结果表明,不同活性菌株的抑菌谱也有所不同,12株活性菌株对尖刀镰孢菌、辣椒疫霉(Phytophthora copsici)、大丽轮枝菌(Verticillium dahliae)、瓜亡革菌(Thanatephorus cucumeris)均有一定的抑制作用,而对葡枝根霉(Rhizopus stolonifer)均没有抑制作用;除菌株1-Z11,1-Z18,4-Z11,4-Z18,IS-010-07-1,P3-11-10-1,Z18-3外,其余5株菌株均对水稻纹枯病菌(Rhizoctonia solani)有抑制作用。对一株具有较强抑菌活性的菌株Psychrobactersp.P4-11-07-1生长条件的研究表明,当培养温度为5~30℃,培养基盐度为0~45,初始pH值为5.0~11.0时,菌株P4-11-07-1均可生长并产生抑菌活性物质,对应抑菌活性最高的培养条件分别是:培养温度为25℃,培养基盐度为0,初始pH为7.0。
南极细菌;抑菌活性;分子鉴定;生长特性
植物病原真菌侵染及病害是限制农作物产量的重要因素之一,随着病原菌对已有抗生素耐药性的增强以及新病害的出现,客观上要求不断开发高活性和新颖的抗生素。微生物源农药的研究除了强化常规资源的筛选和研发外,深远海(极地)等极端环境特殊微生物资源及其生物活性物质的研究与开发,在未来科技和经济竞争中也占据着重要地位[1]。极地具有独特的地理、气候与环境特征,生存于其中的微生物由于低温、高盐、强紫外线辐射等环境因子的胁迫,被赋予了独特的适应机制与代谢方式,可产生许多新型的抑菌活性物质[2]。国内外学者已利用这一特性,开展了一系列研究,主要涉及到产抑菌物质活性菌株的分离、筛选及其活性产物的研究,如Giudice等[3]从南极海水中分离到能抑制其它南极海洋细菌(Arthrobacter和Corynebacterium)的菌株Actinobacteria;Bruntner等[4]从一株南极链霉菌Streptomyces griseusNTK97的代谢产物中分离到一种能抑制革兰氏阳性菌的新型angucyclinon类抗生素frigocyclinone。而针对抑制植物病原菌或具杀虫作用的菌株及活性物质的研究也已开始,目前已从南极海洋细菌Marinomonassp.BSwl0005的发酵液中发现了对植物病原真菌具有明显抑制作用的抑菌物质,并初步判定为胺类物质[5];田黎等[6]发现南极真菌Gliocladium catenulatumT31发酵液对小菜蛾具有杀虫作用。
尖刀镰胞菌(Fusarium oxysporum)是一种世界性分布的土传植物病原真菌,其寄主范围广泛,可引起瓜类、香蕉、茄科、棉花、豆科及花卉等100多种植物枯萎病的发生[7]。本研究以尖刀镰胞菌作为指示菌,对分离自南极海水、海冰及海洋沉积物等样品中的细菌进行了抑菌活性菌株的筛选,并对其进行了分子鉴定与系统发育分析及抑菌谱测定;研究了培养温度、培养基盐度及初始pH值等对抑菌活性较强的活性菌株P4-11-07-1生长和产抑菌活性物质的影响,以期为极地农用微生物资源的深入研究和开发提供基础资料。
1 材料和方法
1.1 菌 株
供试菌:南极海洋细菌,来自国家海洋局海洋生物活性物质重点实验室分离保存的极地微生物资源库。
指示菌:尖刀镰孢菌(Fusarium oxysporum)、葡枝根霉(Rhizopus stolonifer)、辣椒疫霉(Phytophthora copsici)、大丽轮枝菌(Verticillium dahliae)、水稻纹枯病菌(Rhizoctonia solani)和瓜亡革菌(Thanatephorus cucumeris),由实验室保存。
1.2 培养基
Zobell 2216E液体培养基(蛋白胨5g,酵母膏1g,过滤陈海水1L)用于南极细菌培养。PDA培养基用于植物病原真菌的培养。
1.3 南极细菌抑菌活性的筛选及抑菌谱测定
取100μL由甘油管保存的南极细菌接种于含5mL Zobell 2216E液体培养基的试管中,于10℃,150 r/min振荡培养7d。取1mL发酵液在4℃,12 000r/min下离心20min除去菌体,留上清液备用。
取一块尖刀镰孢菌的菌丝体加至含5mL无菌生理盐水的试管中充分振荡,用2层灭菌纱布过滤菌丝后,孢子液用二倍稀释法稀释至约1×105个/mL,得尖刀镰孢菌孢子悬浮液。
将PDA培养基融化后冷却至45~50℃,倒入尖刀镰胞菌孢子悬浮液,快速混匀后倒入灭好菌的平板中,每板30mL,用孔径为7.0mm的打孔器打孔,每孔加100μL南极细菌发酵上清液,25℃培养48h,测量抑菌圈直径,将具有抑菌作用的菌株进一步复筛和纯化,测定抑菌圈的直径,每菌的抑菌圈设3个重复,计算平均值。
分别取初步筛选获得的活性菌株的发酵上清液100μL,测定其对6种不同植物病原菌的抑制作用,确定抑菌谱。
1.4 活性菌株的分子鉴定及系统发育分析
细菌总DNA提取,16SrRNA基因序列的扩增参考徐国英等[8]研究,测序工作由上海桑尼生物科技有限公司完成。将所测定的12株活性菌株的16SrRNA基因序列与GenBank数据库(http:∥www.ncbi.nlm.nih.gov/blast/blast.cgi)进行相似性比较分析,选取与实验菌株亲缘关系较近者及南极常见细菌用BioEdit软件的多序列比对排列(Clustalw multiple alignment)进行序列比对,采用MEGA4.1软件的邻接法(neighbor-joining method)进行系统发育分析,构建系统发育树。
1.5 培养条件对P4-11-07-1生长及抑菌活性影响的测定
以尖刀镰孢菌为指示菌,分别测定了不同培养温度(5,10,15,20,25,30℃)、培养基的不同盐度(0,15,30,45)和不同初始pH 值(5.0,7.0,9.0,11.0)对菌株P4-11-07-1生长及抑菌活性影响。
2 结果与分析
2.1 南极细菌活性菌株的筛选
以植物病原菌尖刀镰孢菌为指示菌,采用平板扩散法,对730株南极细菌发酵上清液进行了抑菌活性研究,经多次筛选、分离纯化和活性验证,共筛选出12株具有明显抑菌作用的活性菌株,占筛选细菌总数的1.6%。12株活性菌株主要来源于南极水样和磷虾组织,其中来源于水样的活性菌株为Z19,P4-11-07-1,1-Z11,1-Z18,4-Z11,4-Z18,IS-010-07-1,P3-11-10-1和Z18-3,来源于磷虾组织的活性菌株为97,Linxia-4和Z27-2(表1)。
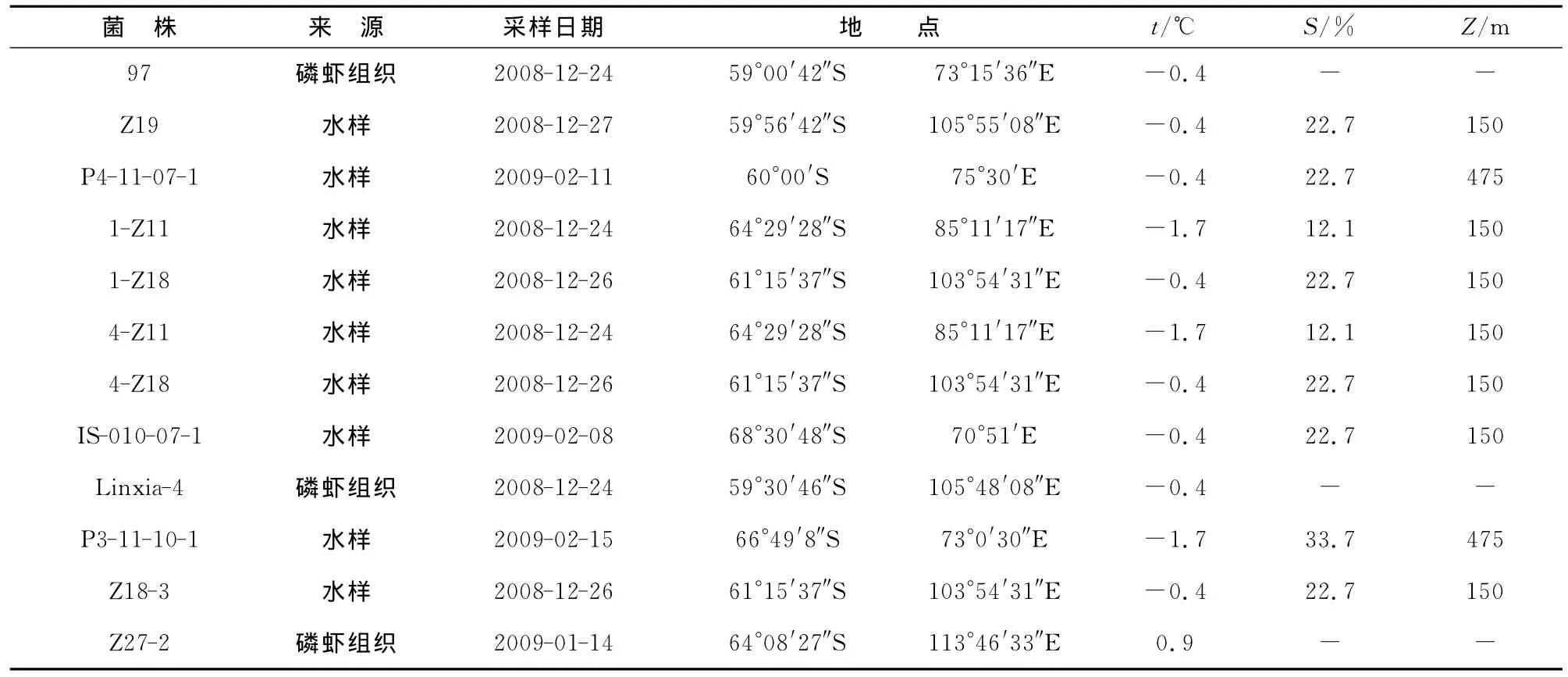
表1 南极抑菌活性菌株及其生境Table 1 Antarctic antifungal bacteria and their living environments
2.2 活性菌株抑菌谱的测定
由12株活性菌株对6种植物病原真菌的抑菌谱(表2)可以看出,所筛选到的12株活性菌株均对葡枝根霉没有抑制作用。菌株97,Z19,P4-11-07-1,Linxia-4和Z27-2对其余5种植物病原菌均有较好的抑菌效果,但抑菌效果有所不同,97,Z19,P4-11-07-1和Z27-2对尖刀镰孢菌的抑菌效果最明显,Linxia-4对瓜亡革菌的抑菌效果最明显,抑菌圈直径均在28.00mm 以上。菌株1-Z11,1-Z18,4-Z11,4-Z18,IS-010-07-1,P3-11-10-1和Z18-3除对葡枝根霉没有抑制作用外,对水稻纹枯病菌也无抑制作用;菌株1-Z11,1-Z18,4-Z11,4-Z18,IS-010-07-1和Z18-3对辣椒疫霉的抑菌效果最明显,抑菌圈直径均在23.00mm 以上;P3-11-10-1对瓜亡革菌的抑菌效果最明显,抑菌圈直径可达30.25mm。
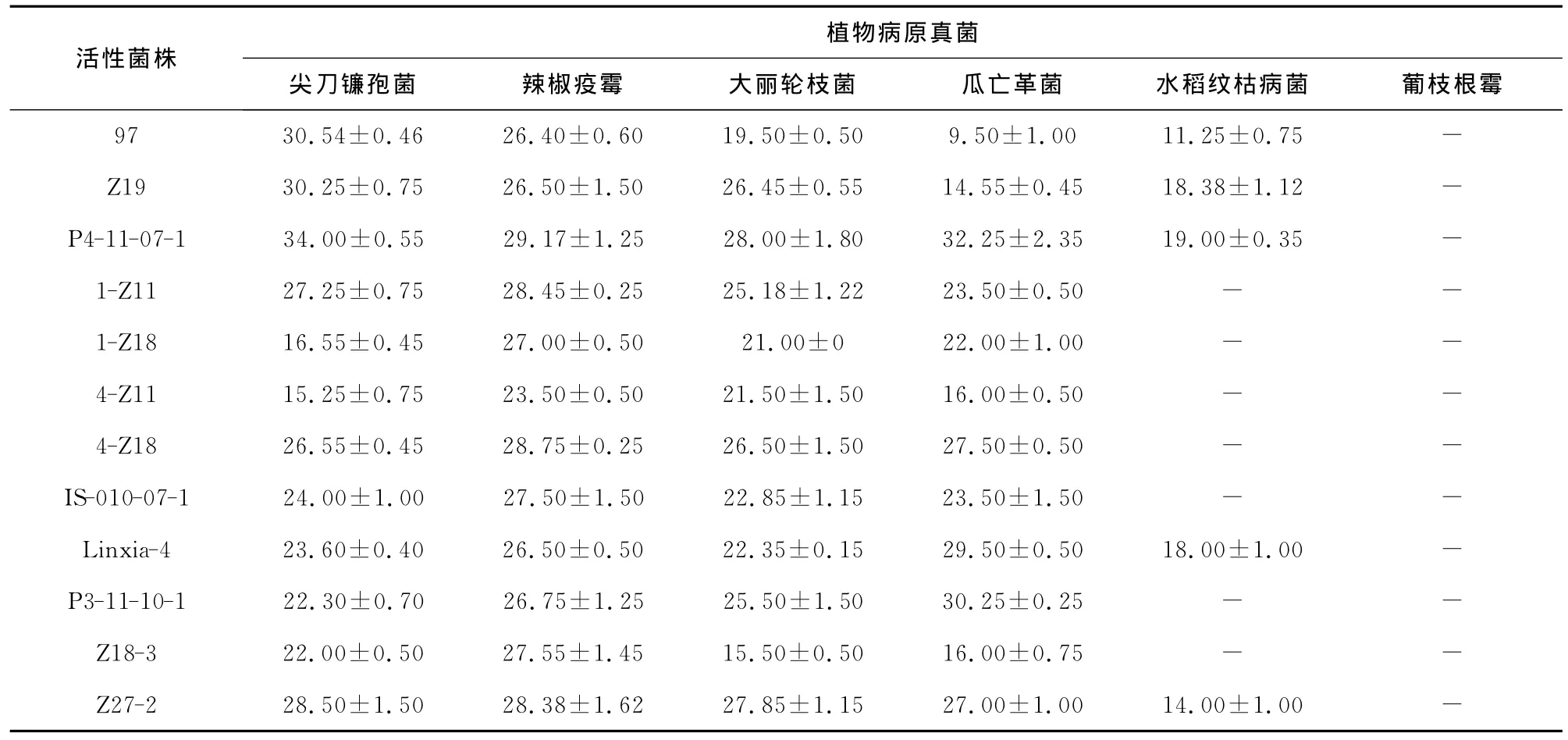
表2 12株南极细菌对植物病原真菌的抑菌谱Table 2 Antifungal spectrum of 12strains of Antarctic bacteria against plant pathogenic fungi
菌株P4-11-07-1对所试验病原真菌的抑菌效果均强于其他活性菌株,其中对尖刀镰孢菌和瓜亡革菌的抑制作用最强,抑菌圈直径分别达34.00,32.25mm;其次,对辣椒疫霉和大丽轮枝菌也有较强的抑制作用,抑菌圈直径分别为29.17,28.00mm;对水稻纹枯病菌的抑制作用较弱,但抑菌圈直径却达19.00mm。
2.3 南极细菌16SrRNA序列分析
利用细菌16SrRNA通用引物对筛选到的12株具有抑制植物病原真菌的南极细菌基因组RNA进行扩增,获得了长度约为1.4kb的16SrRNA序列,经比对分析后将其提交GenBank数据库,获得注册号分别为:HM059656,HM059659,HM641834,HM584477~HM584481,HM584483~HM584486(表3)。

表3 12株抑菌活性菌株16SrRNA序列同源性比较Table 3 Homology comparisons of 16SrRNA sequences of 12antifungal strains
将获得的12株活性菌株的16SrRNA基因序列与GenBank数据库中相似性较高菌株的16SrRNA序列进行比对,并利用MEGA4.1软件进行系统发生学分析并构建了系统发育树(图1),图中进化树距离的计算采用Kimura双参数计算模型,分支上的数字为1 000次bootstrap分析所得值,线段代表0.02进化距离单位,括号中的代码代表序列在数据库中的登录号。结果表明,所分离到的12株活性菌株与GenBank数据库已有菌株的16SrRNA序列均具有很高的相似性,均在99%以上;分别属于假交替单胞属(Pseudoalteromonas)、嗜冷杆菌属(Psychrobacter)、假单胞菌属(Pseudomonas)、伦黑墨氏菌属(Rheinheimera),均为细菌域(Bacteria)变形杆菌门(Proteobacteria)的γ-变形杆菌(γ-Proteobacteria)。7株活性菌株(1-Z11,1-Z18,4-Z11,IS-010-07-1,Linxia-4,P3-11-10-1和 Z18-3)属于交替单胞菌目(Alteromonadales)假交替单胞菌科(Pseudoalteromonadaceae)的假交替单胞属,占总筛选活性菌的58.3%,为优势种群;3株活性菌株(Z19、P4-11-07-1、4-Z18)属于假单胞菌目(Pseudomonadales)、莫拉菌科(Moraxellaceae)的嗜冷杆菌属,占总筛选活性菌的25%;1株活性菌株(97)属于着色菌目(Chromatiales)着色菌科(Chromatiaceae)的伦黑墨氏菌属;占总筛选活性菌的8.3%;1株活性菌株(Z27-2)属于假单胞菌目(Pseudomonadales)假单胞菌科(Pseudomonadaceae)的假单胞菌属,占总筛选活性菌的8.3%。

图1 抑制植物病原真菌的南极活性菌株的系统发育分析Fig.1 Phylogenetic analysis of Antarctic antifungal bacteria
2.4 培养条件对菌株P4-11-07-1生长及抑菌活性的影响
2.4.1 培养温度对菌株P4-11-07-1生长及抑菌活性的影响
培养温度对活性菌株P4-11-07-1生长及抑菌活性的影响如图2所示。可以看出,菌株在5~30℃之间均能生长并产生抑菌活性物质。5,10℃培养时,菌株分别于培养24,12h进入指数生长期,60,48h进入稳定期,之后菌体量基本维持平衡;15,20,25,30℃下培养12h进入对数生长期,24h进入稳定期,之后分别于96,72,60,48h进入衰亡期。该菌株最适生长温度为5℃,此温度下抑菌活性最低,而培养温度为25℃时,抑菌活性最高,其次为30℃。在各培养温度下,菌株发酵上清液的抑菌活性均随着培养时间的增加呈上升趋势,表明该菌株产生的抑菌物质在测试时间范围内正逐步积累。

图2 培养温度对菌株P4-11-07-1生长(a)及抑菌活性(b)的影响Fig.2 Effect of culture temperature on the growth(a)and antifungal activity(b)of strain P4-11-07-1
2.4.2 培养基盐度对菌株P4-11-07-1生长及抑菌活性影响
培养基盐度对菌株P4-11-07-1生长及抑菌活性影响见图3。可以看出,菌株在培养基盐度为0~45时均能生长并产抑菌活性物质。当培养基盐度为0时菌株生长达最大值,此时抑菌活性也达最大值,随着盐度的增加菌株生长和抑菌活性均呈下降趋势。
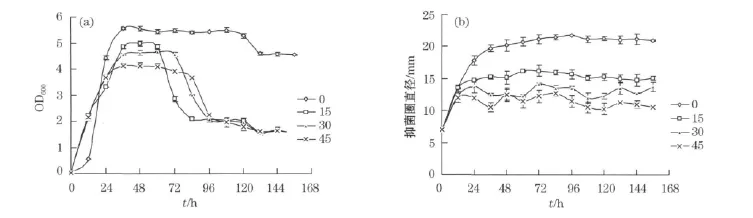
图3 培养基盐度对菌株P4-11-07-1生长(a)及抑菌活性(b)的影响Fig.3 Effect of medium salinity on the growth(a)and antifungal activity(b)of strain P4-11-07-1
2.4.3 培养基初始pH 值对P4-11-07-1生长及抑菌活性影响
培养基初始pH值对P4-11-07-1生长及抑菌活性影响见图4。可以看出,当培养基初始pH值在5.0~11.0之间时菌株均能生长并产生抑菌活性物质。当培养基的初始pH值为8.0时最适合菌株生长,其次为9.0;当培养基的初始pH值为7.0时,抑菌活性达最大值,其次为8.0;当培养基初始pH值为11.0时,菌株生长量和抑菌活性均最低。

图4 培养基初始pH 值对菌株P4-11-07-1生长(a)及抑菌活性(b)的影响Fig.4 Effect of medium initial pH on the growth(a)and antifungal activity(b)of strain P4-11-07-1
3 讨 论
本研究通过平板扩散法筛选到12株具有明显抑制植物病原真菌作用的南极细菌,占总分离数的1.6%,小于姜健等[9]和朱鹏等[10]从常规海洋细菌筛选到的活性菌株的比例,其原因可能为:1)筛选模式不同。本研究只选用一种植物病原菌尖刀镰孢菌作为指示菌,而姜健等[9]和朱鹏等[10]采用多种指示菌进行筛选,有些南极细菌对尖刀镰孢菌没有抑制活性,但对其它病原菌可能会有活性,这样就可能会造成筛选活性菌株的减少;2)环境条件的影响。微生物次级代谢产物的产生会受环境的影响,生活在南极的微生物会产生某种特殊的物质以适应周围环境,这些微生物一旦离开原来的生境,可能就不再产生这种物质;3)培养条件的影响。微生物代谢产物的产生受培养条件的限制,本论文只采用Zobell 2216E一种培养基培养南极细菌,可能影响某些细菌产生抑菌物质。
对分离到的活性菌株的分子鉴定及系统发育分析表明,筛选到的南极活性细菌分别属于假交替单胞菌属(Pseudoalteromonas)、嗜冷杆菌属(Psychrobacter)、假单胞菌属(Pseudomonas)和伦黑墨氏菌属(Rheinheimera),其中假交替单胞菌属为优势种群。目前已有关于假单胞菌属(Pseudomonas)、假交替单胞菌属(Pseudoalteromonas)产抑菌活性物质的报道,如Isnansety等[11]分离到一株海洋细菌Pseudoalteromonas phenolicasp.nov.O-BC30,能产生一类抑制耐甲氧西林金黄色葡萄球菌(Staphylococcus aureus)和肠球菌(Enterococcus)的含酚的抗生素 MC21[12-13];Jayatilake等[14]从一株南极细菌Pseudomonas aeruginosa代谢产物中分离到6种二酮类吡嗪类化合物、2种吩嗪生物碱类抗生素,其代谢产物能抑制革兰氏阳性菌生长。而嗜冷杆菌属、伦黑墨氏菌属细菌产生抑菌活性物质尚未见报道。
菌株P4-11-07-1具有较广的温度、盐度和pH适应性,在培养温度5~30℃,培养基盐度0~45及初始pH值5.0~11.0范围内,均能生长并产生抑菌活性物质,该特性与郭少华等[14]报道的南极海单胞菌Marinomonassp.BSwl0005相似,其可在常温(28℃)、低盐度(5)条件下培养。这表明尽管这些活性菌株生长于极地海洋环境,它们仍可以适应低盐和较高温度的培养条件,从而基本上避免了大规模培养时低温培养条件的限制,低盐需求也可使发酵设备免受侵蚀,从而更有利于实际生产。笔者将对菌株P4-11-07-1产活性物质的分离纯化及结构鉴定展开进一步研究。
(References):
[1]LIU J N,YU X Y,ZHANG C Z,et al.Progress in the studies of marine agriactive compound for insecticide[J].Entomolgical Knowledge,2004,41(5):409-413.刘济宁,余向阳,张存政,等.海洋生物源杀虫活性物质研究进展[J].昆虫知识,2004,41(5):409-413.
[2]ZENG Y X,CHEN B,ZOU Y,et al.Polar microorganism,apotential source for new natural medicines-a review[J].Acta Microbiologica Sinica,2008,48(5):695-700.曾胤新,陈波,邹扬,等.极地微生物——新天然药物的潜在来源[J].微生物学报,2008,48(5):695-700.
[3]GIUDICE L A,BRILLI M,BRUNI V,et a1.Bacterium-bacterium inhibitory interactions among psychrotrophic bacteria isolated from Antarctic awamr[J].JFEMS Microbiology Ecology,2007,60(3):383-396.
[4]BRUNMER C,BINDER L,PATHOMAREE W,et a1.Frigocyclinone,a novel an gucyclinone antibiotic produced by aStreptomyces griseusstrain from Antarctica[J].J Antibito(Tokyo),2005,58(5):346-349.
[5]REN X Y,WANG W,GUO S H,et al.Bioactive substance ofMarinomonassp.BSw10005from Antarctic ocean and its effects on plant pathogens[J].Acta Phytopatholagica Sinica,2007,37(6):654-659.任雪芸,王伟,郭少华,等.南极海单胞菌BSw10005代谢活性物质及对植物病原菌抑制作用[J].植物病理学报,2007,37(6):654-659.
[6]NIE D Q,TIAN L,ZHOU J Y,et al.A study on insecticidal activity of antarctic epiphyteGliocladium catenulatumT31[J].Chinese Journal of Polar Research[J],2007,19(2):131-138.牛德庆,田黎,周俊英,等.南极生境真菌Gliocladium catenulatumT31菌株杀虫活性的研究[J].极地研究,2007,19(2):131-138.
[7]ZHU Y Q,CHE Y J,XIAO R F,et al.Growth characteristics ofFusarium oxysporumSchl.[J].Chinese Agricultural Science Bulletin,2007,23(8):373-376.朱育菁,车建美,肖荣凤,等.尖孢镰刀菌(Fusarium oxysporumSchl.)的生长特性[J].中国农学通报,2007,23(8):373-376.
[8]XU G Y,LIN X Z,WANG N F,et al.Screening of cold-active protease strains from polar microorganism and partial characteristics of crude protease excreted byPseudoalteromonassp.QI-1[J].Chinese Journal of Bioprocess Engineering,2010,8(2):55-60.徐国英,林学政,王能飞,等.产低温蛋白酶极地菌株的筛选及Pseudoalteromonassp.QI-1产蛋白酶粗酶性质[J].生物加工过程,2010,8(2):55-60.
[9]JIANG J,YANG B L,YUAN Q,et al.Isolation and identification of marine bacteria with antimicrobial activity[J].Biotechnology,2004,14(6):28-30.姜健,杨宝灵,元起,等.具有抑菌活性的海洋细菌的分离与鉴定[J].生物技术,2004,14(6):28-30.
[10]ZHU P,ZHENG L,LIN J,et al.Screening and characterization of marine bacteria with antibacterial and cytotoxic activities,and existence of PKSⅠand NRPS genes in bioactive strains[J].Acta Microbiologica Sinica,2007,47(2):228-234.朱鹏,郑立,林晶,等.抗菌和细胞毒活性海洋细菌的筛选及其次生代谢基因证据[J].微生物学报,2007,47(2):228-234.
[11]XI Y,ZHU D H,LIU H T,et al.Advances onPseudoalteromonasspecies and their extracellular bioactive compounds[J].Microbiology,2005,32(3):108-112.席宇,朱大恒,刘红涛,等.假交替单胞菌及其胞外生物活性物质研究进展[J].微生物学通报,2005,32(3):108-112.
[12]ISNANSETYO A,KAMEI Y.Pseudoalteromonas phenolicasp.nov,a novel marine bacterium that produces phenolic anti-methicillinresistantStaphylococcusaureus substances[J].Int.J.Syst.Evol.Microbiol.,2003,53(2):583-588.
[13]ISNANDETYO A,KAMEI Y.MC21-A,a bactericidal antibiotic produced by a new marine bacterium,Pseudoalteromonas phenolicasp.nov.O-BC30,against Methicillin-resistantStaphylococcus aureus[J].Antimicrobial Agents and Chemotherapy,2003,47(2):480-488.
[14]JAYATILAKE G S,THOMTON M P,LEONARD A C,et al.Metabolites from an Antarctic sponge-associated bacterium,Pseudomonas aeruginosa[J].Journal of Natural Products,1996,58(3):293-296.
[15]GUO S H,WANG W,LI Y G,et al.The growth characteristic of antarctic marine bacterium BSw10005[J].Microbiology,2006,33(1):38-41.郭少华,王伟,李元广,等.南极海洋细菌 BSwl0005生长特性研究[J].微生物学通报,2006,33(1):38-41.
Screening of Antarctic Bacteria With Antifungal Activity AgainstFusarium oxysporumand Growth Characteristics ofPsychrobactersp.P4-11-07-1
WANG Hong-mei1,2,3,HE Pei-qing2,3,LIN Xue-zheng2,3,DONG Yong-sheng1
(1.School of Food and biological Engineering,Shandong Institute of Light Industry,Jinan 250353,China;2.First Institute of Oceanography,SOA,Qingdao 266061,China;3.Key Laboratory of Marine Bioactive Substances,SOA,Qingdao 266061,China)
The 12strains of Antarctic bacteria with antifungal activity against plant pathogenic fungi were screened withFusarium oxysporumas indicator by method of agar diffusion.Phylogenetic analysis and antifungal spectrum of antifungal strains were studied.Molecular identification and phylogenetic analysis showed that seven antifungal strains belonged to genera ofPseudoalteromona,three strains were members ofPsychrobacter,and the rest two strains belonged to genus ofPseudomonasandRheinheimera,respectively.Antifungal spectrum test displayed that the antifungal strains had different antifungal spectrum.All of the 12strains had a certain antifungal activity onFusarium oxysporum,Phytophthora copsici,Verticillium dahliae,Thanatephorus cucumeris,and no activity onRhizopus stolonifer.Except strain 1-Z11,1-Z18,4-Z11,4-Z18,IS-010-07-1,P3-11-10-1and Z18-3,the others had antifungal activity onRhizopus stolonifer.The results of growth conditions ofPsychrobactersp.P4-11-07-1with stronger antifungal activity demonstrated that it could grow and produce antifungal substances as the culture temperature was 5~30℃,the medium salinity was 0~45and initial pH was 5.0~11.0.The corresponding highest antifungal activity was detected at 25℃,salinity 0,and pH 7.0.
Antarctic bacteria;antifungal activity;molecular identification;growth characteristics
October 28,2010
Q935
A
1671-6647(2012)01-0102-09
2010-10-28
国家海洋局海洋公益性行业科研专项经费项目——深远海(极地)微生物生物农药的研制与中试示范(201005032-2);国家高新技术研究发展计划项目——极地特殊海洋微生物资源利用的关键技术研究(2007AA091905)
王红梅(1986-),女,山东济宁人,硕士,主要从事极端环境微生物方面研究.E-mail:wanghongmei0711@126.com
*通讯作者,研究员,E-mail:linxz@fio.org.cn
(王佳实 编辑)
