多条溶出曲线评价氨氯地平阿托伐他汀钙分散片的质量
2012-01-06戈文兰苗燕飞张根元陈国广
戈文兰,高 盼,苗燕飞,张根元,陈国广,
(南京工业大学 1.江苏省药物研究所有限公司,2.药学院,江苏 南京 210009)
多条溶出曲线评价氨氯地平阿托伐他汀钙分散片的质量
戈文兰1,高 盼2,苗燕飞2,张根元1,陈国广1,2
(南京工业大学 1.江苏省药物研究所有限公司,2.药学院,江苏 南京 210009)
目的 比较自制氨氯地平阿托伐他汀钙分散片与参比制剂在不同溶出介质中溶出曲线的相似性。方法 分别以水、pH 1.0盐酸溶液、pH 4.5醋酸盐缓冲液和pH 6.8磷酸盐缓冲液为溶出介质,测定自制制剂与参比制剂的体外溶出曲线,采用f2相似因子法考察其相似性。结果 在不同pH值的溶出介质中,自制制剂中的氨氯地平和阿托伐他汀钙的溶出曲线与参比制剂比较,f2相似因子均大于50。结论 在不同pH值的溶出介质中,自制制剂和参比制剂的体外溶出行为相似。
苯磺酸氨氯地平;阿托伐他汀钙;氨氯地平阿托伐他汀钙分散片;溶出曲线;f2相似因子
氨氯地平阿托伐他汀钙片由辉瑞公司研制开发,2004年在美国上市,商品名为Caduet(多达一),其成分为长效钙通道阻断剂苯磺酸氨氯地平(Amlodipine Besylate)和HMG-CoA还原酶抑制剂阿托伐他汀钙(Atorvastatin Calcium)。它是全球首个既可以很好的控制血压又可以控制血脂的一种新型复方制剂,突破了单纯降压药治疗冠心病获益不足的瓶颈,实现了降压降胆固醇双管齐下的目的[1]。
因氨氯地平和阿托伐他汀钙均为难溶性药物,多达一的处方中不仅加入了表面活性剂吐温80,而且还采用阿托伐他汀钙湿法制粒、干燥后研磨成粉,然后与氨氯地平混合,全粉末直接压片的工艺来提高溶出速率[2-3]。为了解决全粉末直接压片流动性差的问题,以及达到与多达一的溶出基本一致的目的,我们采用能适合工业化大生产的湿颗粒法压片的工艺,研制了氨氯地平阿托伐他汀钙分散片。本文以国外上市的多达一为参比制剂,考察自研制剂在不同溶出介质中的溶出情况,并采用f2相似因子法评价自研制剂的内在质量。
1 仪器与试药
安捷伦1260高效液相色谱仪(安捷伦科技有限公司);ZRS-8G溶出仪(天大天发科技有限公司)。
苯磺酸氨氯地平对照品(中国药品生物制品检定所,批号:100374-200903,含量:99.4%)、阿托伐他汀钙(中国药品生物制品检定所,批号:100590-200802,含量:95.0%);氨氯地平阿托伐他汀钙片(辉瑞制药有限公司,批号:1002663,规格:5 mg/10 mg以氨氯地/平阿托伐他汀计);氨氯地平阿托伐他汀钙分散片(自制,批号:20110926,规格:5 mg/10 mg以氨氯地/平阿托伐他汀计);甲醇(TEDIA,色谱纯);其它试剂为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱:Kromasil C18色谱柱(250 mm ×4.6 mm,5 μm);流动相:0.05 mol/L醋酸铵缓冲液(冰醋酸调pH 值5.20 ±0.05)-甲醇(30∶70);流速:1.0 mL/min;柱温:30℃;检测波长:240 nm;进样量:20 μL。
2.2 对照品溶液的制备
精密称取苯磺酸氨氯地平对照品14 mg,阿托伐他汀钙对照品22 mg,置同一100 mL量瓶中,加少量50%乙腈溶液,超声溶解,稀释至刻度,摇匀,作为对照品储备液。精密吸取对照品储备液5 mL,置100 mL量瓶中,用相应溶出介质稀释至刻度,摇匀,作为对照品溶液。
2.3 供试品溶液的制备
在不同时间点,每次取样5 mL,经微孔滤膜滤过,作为供试品溶液。
2.4 专属性实验
分别取空白辅料溶液、对照品溶液和样品溶液注入液相色谱仪,记录色谱图,见图1。由图1可见,辅料在氨氯地平和阿托伐他汀钙主峰处无色谱峰出现,表明辅料无干扰。
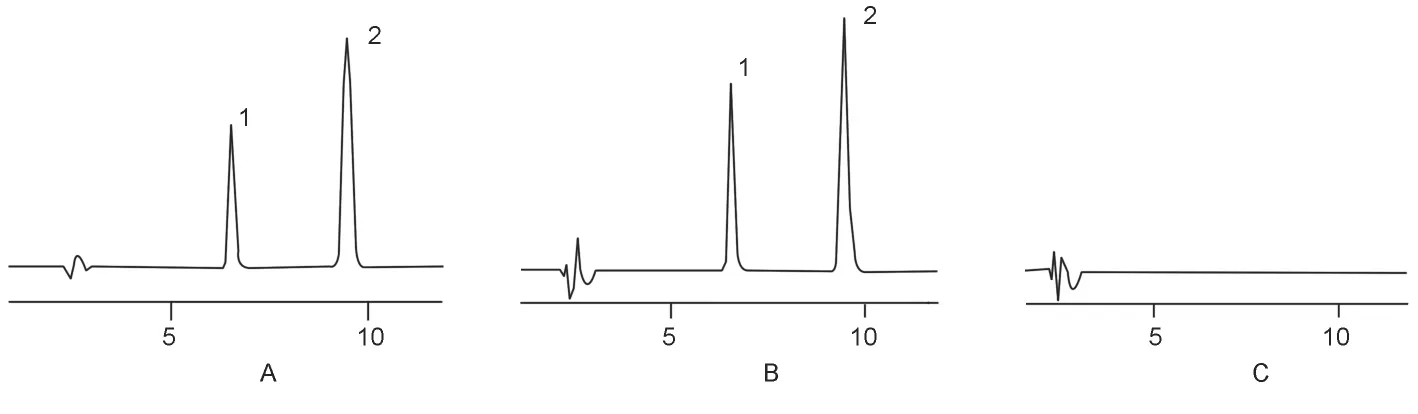
图1 对照品溶液(A)、样品溶液(B)和空白辅料(C)的高效液相色谱图
2.5 线性关系考察
精密吸取 2.2 项下对照品储备液 2.0,3.0,4.0,5.0,6.0 mL,分别置 100 mL 量瓶中,分别加入50%乙腈溶液 4.0,3.0,2.0,1.0,0 mL,再加入同一溶出介质至刻度,摇匀,制成苯磺酸氨氯地平浓度(C1)为 2.970,4.455,5.940,7.425,8.910 μg/mL和阿托伐他汀钙浓度(C2)为 4.422,6.633,8.844,11.055,13.266 μg/mL 的溶液,同法制备不同溶出介质的溶液。
按2.1项下色谱条件测定,得苯磺酸氨氯地平和阿托伐他汀钙峰面积分别为A1和A2,以浓度为横坐标,峰面积为纵坐标,进行线性回归,结果见表1。结果表明,苯磺酸氨氯地平和阿托伐他汀钙于不同介质中,在2.970 ~8.910 μg/mL 和 4.422 ~13.266 μg/mL范围内,线性关系良好。
2.6 溶液稳定性试验
取不同溶出介质的供试品溶液,于 0,2,4,6,8 h分别进样,测定其峰面积,并计算RSD,结果表明,除阿托伐他汀钙在pH 1.0盐酸溶液中易降解(1 h降解约50%)不稳定外,其他供试品溶液在8 h内稳定。结果见表2。
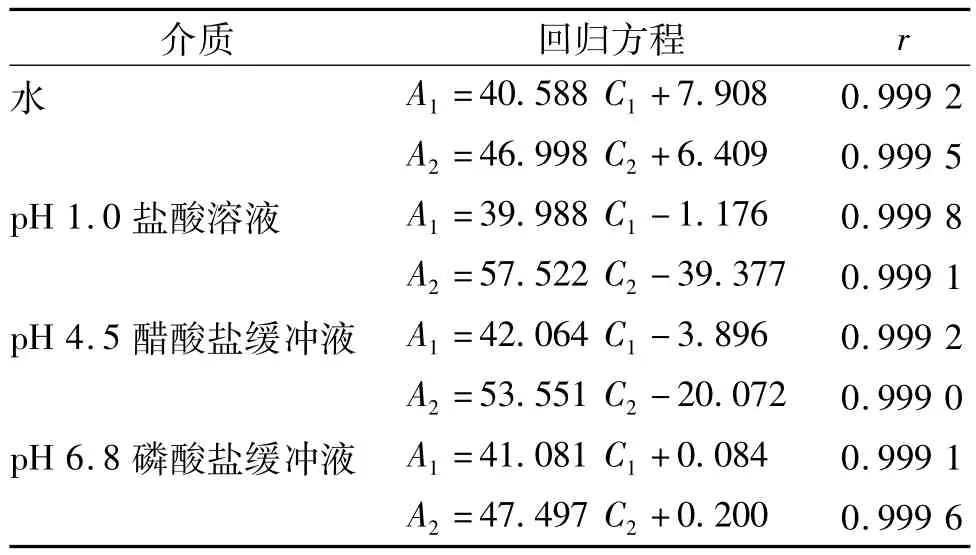
表1 氨氯地平和阿托伐他汀钙在不同溶出介质中的线性回归方程
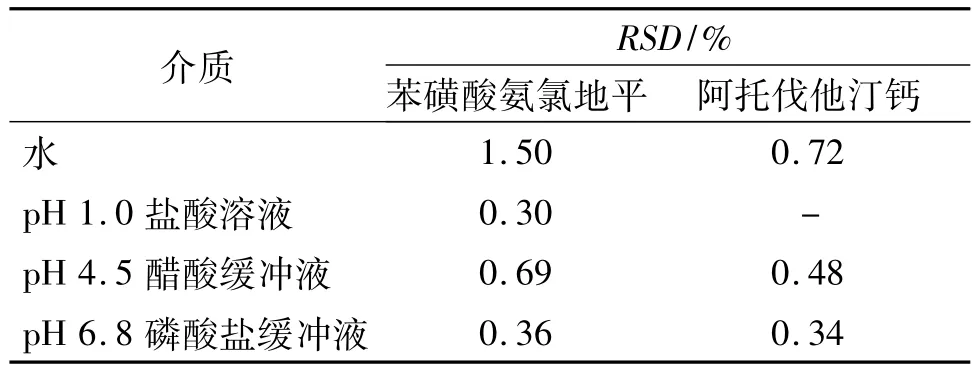
表2 样品在不同溶出介质中稳定性试验结果
2.7 溶出介质和转速的确定
[4-5],照中国药典2010年版(二部)附录XC法第二法,溶出介质体积为900 mL,测定溶出度,取样时间酸性介质为2 h,其他介质为6 h,如溶出度小于90%时,则放宽溶出条件直至溶出度大于90%,并以此确定溶出介质和转速。经试验,确定水、pH 1.0盐酸溶液、pH 4.5醋酸缓冲液为介质时的转速为50 r/min;pH 6.8磷酸盐缓冲液为75 r/min。
2.8 溶出曲线测定
根据文献[4],于 5,10,15,30,45,60,90,120 min(当连续两点溶出率均达90%,且差值小于5%时,试验可提前结束)分别取样,作为供试品溶液。取2.2项下对照品溶液,按2.1项下方法测定,记录色谱图,按外标法以峰面积分别计算出每片中氨氯地平和阿托伐他汀钙在不同时间点的溶出度,并计算累积溶出量。参比制剂和自制制剂中氨氯地平和阿托伐他汀钙在不同pH值溶出介质中的溶出曲线见图2。

图2 参比制剂与自制制剂在不同溶出介质中的溶出曲线
2.9 参比制剂与自制制剂溶出曲线的评价
采用 f2相似因子法[4,6],评价参比制剂与受试制剂的溶出度差异。
若50≤f2<100,则表示受试制剂与参比制剂溶出行为相似;当参比制剂与仿制制剂15 min内溶出量达85%以上,无需进行曲线比较可认为两者相似。根据谢沐风报道[6],选取合适时间点计算4种溶出介质中的溶出曲线间的f2值。结果见表3。

表3 不同溶出介质中溶出曲线的相似性比较
3 讨论
鉴于阿托伐他汀钙在pH 1.0盐酸溶液中极不稳定,易降解,故试验时对阿托伐他汀钙及其降解物的峰面积作定量研究,计算出降解物相对于阿托伐他汀钙峰面积的校正因子予以折算,从而建立了易降解药物阿托伐他汀钙在pH 1.0盐酸溶液中溶出度的测定方法。
在pH 4.5醋酸盐缓冲液和pH 6.8的磷酸盐缓冲液中,15 min时,自制制剂和参比制剂中的氨氯地平和阿托伐他汀钙的溶出度均达到85%以上,因此,可以认定为自制制剂和参比制剂溶出行为相似。
以水为溶出介质,氨氯地平及阿托伐他汀钙的f2相似因子分别为61和73;pH 1.0盐酸溶液中,15 min时,氨氯地平的溶出度达到85%以上,阿托伐他汀钙f2相似因子为58,可以认定为自制制剂和参比制剂溶出行为相似。
测定不同pH溶出介质中的溶出曲线是先进国家药物审评机构评价口服固体制剂内在质量的一种重要手段[7]。试验结果表明,自制制剂和参比制剂在不同pH值的溶出介质中,氨氯地平和阿托伐他汀钙溶出曲线基本一致,自制制剂和参比制剂的体外溶出行为具有相似性。
参考文献:
[1] 刘钰华.氨氯地平阿托伐他汀钙片治疗高血压并高血脂的疗效[J].实用医学杂志,2010,19(2):3614-3615.
[2] 阿拉尼L,克汉S U,麦克奈尔T M,等.氨氯地平和阿托伐他汀的药物组合物:中国,1617717A[P].2005-5-18.
[3] Pfizer Inc.The rapeutic combination:US,6455574B1[P].2002-9-24.
[4] 张启明,谢沐风,宁保明,等.采用多条溶出曲线评价口服固体制剂的内在质量[J].中国医药工业杂志,2009,40(12):946-955.
[5] 国家食品药品监督管理局.JX20070048,氨氯地平阿托伐他汀钙片进口注册标准[S].
[6] 谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308-311.
[7] 谢沐风.改善溶出度评价方法,提高固体药物制剂水平[J].中国医药工业杂志,2005,36(7):447-451.
Evaluation of the quality of Amlodipine and Atorvastatin Calcium dispersible tablets by dissolution curves in different mediums
GE Wen-lan1,GAO Pan2,MIAO Yan-fei2,ZHANG Gen-yuan1,CHEN Guo-guang1,2
(1.Jiangsu Provincial Institute of Material Medica Co.,Ltd.,2.School of Pharmacy,Nanjing University of Technology,Nanjing 210009,China)
Purpose To compare the dissolution curves of reference preparation and self-prepared preparation in different dissolution media.Methods In different pH dissolution media(water,pH 1.0 hydrochloric acid,pH 4.5 acetate buffer and pH 6.8 phosphate buffer),the dissolution curves of reference preparation and self-prepared preparation are determined while the similarity is investigated according to the f2factor method.Results In different pH dissolution media,the dissolution curves of amlodipine and atorvastatin calcium from self-prepared preparation compared with reference preparation and similarity factors(f2)are all more than 50.Conclusion In different pH dissolution media,the dissolution behavior of self-prepared preparation and reference preparation is similar.
Amlodipine Besylate;Atorvastatin Calcium;Amlodipine Besylate and Atorvastatin Calcium dispersible tablet;dissolution curve;f2similarity factor
R944.4
A
1005-1678(2012)06-0811-03
2012-07-23
戈文兰,副研究员,主要从事药物新剂型的研究与开发,E-mail:gwlan@sina.com。
