半夏中一种抗癌蛋白的纯化及其抗癌活性研究
2012-01-05范汉东王雪蔡永君郭建军杨一兵邹国林
范汉东,王雪,蔡永君,郭建军,杨一兵,邹国林
(1.江西省科学院微生物研究所,江西 南昌,330029;2.武汉大学生命科学学院,湖北 武汉,430072;3.湖北大学生命科学学院,湖北 武汉,430062)
半夏是一种天南星科多年生草本植物,作为已在临床使用两千多年的传统中药,具有能降逆止呕、燥湿化痰、和胃安神、消肿排脓等功效.生半夏有毒,须炮制后使用,且现代药理学实验也证明半夏具有镇咳、祛痰、止吐、镇静催眠等作用[1].
由于临床发现鲜半夏浆液在治疗宫颈癌上有很好的疗效,对半夏抗肿瘤有效成分的研究引起很多研究者的兴趣[2].近年来的研究表明半夏总蛋白具有抗肿瘤作用.孙光星等发现半夏的总蛋白能抑制卵巢癌细胞,且对人脐带血干细胞却没有明显的毒副作用[3-4].付芸等发现半夏蛋白中30%硫酸铵沉淀部分对Bel-7402细胞生长具有明显抑制作用[5].但是,这些研究者都只是研究半夏总蛋白或其中部分组分的抗癌活性,对于这些组分中到底是哪一个或几个蛋白有抗癌作用依然未知,因此,为进一步寻找其有效成分,减少其他无效成分的副作用,促进半夏在抗癌中的应用,本研究拟从新鲜半夏总蛋白中分离纯化具有抗肿瘤活性的蛋白,并用Sarcoma 180作为模型细胞系研究其抗肿瘤作用,同时用MTT(噻唑兰)实验与载瘤小鼠实验评价APPT 抗肿瘤效果,用流式细胞仪研究其抗肿瘤的活性.
1 材料与方法
1.1材料鲜半夏(Pinelliaternata)采自湖北荆门并经湖北省中医药大学陈克力教授鉴定;环磷酰胺购自武汉大学中南医院;PHE Sepharose Cl-4B与DEAE Sepharose Fast Flow购自法玛西亚公司 (Pharmasia,Sweden);MTT购自Sino-American Biotechnology 公司;RPMI 1640购自HyClone (USA);小鼠购自武汉大学医学院动物实验中心,同时动物实验也在该中心完成;Sarcoma 180细胞系购自武汉大学典型培养物保藏中心,其他试剂均为分析纯.
1.2仪器二氧化碳培养箱、分光光度计及蛋白质谱仪均为美国热电公司产品,流式细胞仪为贝克曼公司产品.
1.3蛋白纯化纯化过程共分为3步.第一步:将100 g半夏鲜块茎匀浆,浆液以8 000 r/min离心40 min,取上清,加入硫酸铵直到饱和度为40%,冰箱静置过夜,再以8 000 r/min离心40 min,取沉淀并用Tris-HCl 缓冲液(20 mmol/L Tris-HCl pH 7.4)溶解,将可溶部分装入透析袋中透析,透析液为含1.5 mol/L硫酸胺的 Tris-HCl 缓冲液 (20 mmol/L Tris-HCl pH 7.4),以上操作均在4 ℃条件下进行;第二步—疏水层析:将装有PHE Sepharose Cl-4B的层析柱(Φ25 mm×L160 mm)先用含1.5 mol/L硫酸胺的 Tris-HCl 缓冲液 (20 mmol/L Tris-HCl pH 7.4)平衡,然后将第一步中经透析的蛋白上样,用含硫酸铵的Tris-HCl 缓冲液 (20 mmol/L Tris-HCl pH 7.4)梯度洗脱,其中硫酸铵的浓度梯度由0 mol/L到1.5 mol/L,280 nm 监测蛋白吸收值.跟踪检测并收集活性部分,再用Tris-HCl 缓冲液(20 mmol/L Tris-HCl pH 7.4)进行透析,最后用超滤的方法离心浓缩到合适体积;第三步―阴离子交换柱层析:先将装有DEAE-Sepharose Fast Flow 的层析柱 (Φ25 mm×L160 mm)用20 mmol/L Tris-HCl (pH 7.4) 缓冲液进行预平衡,取第二步中浓缩的样品上样,用含NaCl 的20 mmol/L Tris-HCl (pH 7.4) 缓冲液进行梯度洗脱,其中NaCl的浓度梯度为0 mol/L到0.3 mol/L.收集活性部分,用双蒸水透析除盐并用超滤法离心浓缩.用考马斯亮蓝法测定蛋白质浓度[6-7],用12% SDS-PAGE分析蛋白质组分及纯度[8],同时用蛋白质谱仪测定蛋白质分子量.
1.4中性糖测定以葡萄糖为参照,用苯-硫酸法测定中性糖含量,具体方法参照Malzberg等[9].
1.5MTT实验MTT实验方法基本参照Chen Wei等[10-11],其中Sarcoma 180细胞培养条件为:含10%小牛血清、100 mg/L 链霉素以及100 mU/L青霉素的RPMI 1640培养基、37 ℃及5% CO2.细胞接种量为1×105,细胞先在96孔板中培养36 h,然后分别加入磷酸缓冲液(PBS),终浓度为11、22、33、44和55 μg/mL的APPT,其中PBS做阳性对照,每个浓度重复4次.分别再培养24 h后分别于每个样品中加入MTT (5 mg/mL) 并且再培养4 h,然后加入100 μL DMSO终止反应,于490 nm下测定吸收值.
1.6流式细胞仪测定细胞周期实验实验中细胞培养与APPT 处理的方法与MTT实验相同,基本方法参照Chen Wei等[10],在用不同浓度的APPT处理12 h或24 h后,离心收集细胞并用冷的PBS洗两次,然后用75%酒精重悬,-20 ℃冰箱固定过夜,固定过的细胞600 r/min离心回收,再用冰预冷的PBS洗涤2次,然后用溶于PBS的100 μg/mL RNase A在37 ℃处理1 h,最后避光4 ℃冰箱PI (20 μg/mL)处理30 min,最后上机测定.
1.7载瘤小鼠实验实验中所用小鼠为ICR鼠,选择60只体重在20~22 g雄性昆明ICR鼠,随机分成5组,每组12只,ICR鼠在无菌室中养殖3 d后于每只鼠的左侧前腿腋部接种Sarcoma 180细胞[12],接种量为每只小鼠接种细胞密度约为2.5×106cells/mL用PBS溶解的细胞悬液0.2 mL[10].24 h后,对阴性对照组每两天注射0.2 mL PBS,阳性对照组每天按20 mg/kg注射环磷酰胺,实验组分别按3.25、2.30及0.85 mg/kg 体重的量注射APPT.在第11天处死小鼠,手术分离肿瘤与脾脏并对其称重.
抑制率的计算方法为:抑制率/% =[(C-T)/C]×100,其中C为阴性组的肿瘤平均质量,T是实验室中各APPT处理组及阳性对照组的肿瘤平均质量[13].器官系数=器官质量/体质量.
2 结果
2.1APPT的纯化与分子量的测定联合疏水层析与阴离子交换层析从半夏中纯化一种具有抗肿瘤选用100 g新鲜的半夏块茎,凝集素活性的测定方法参照1.3.
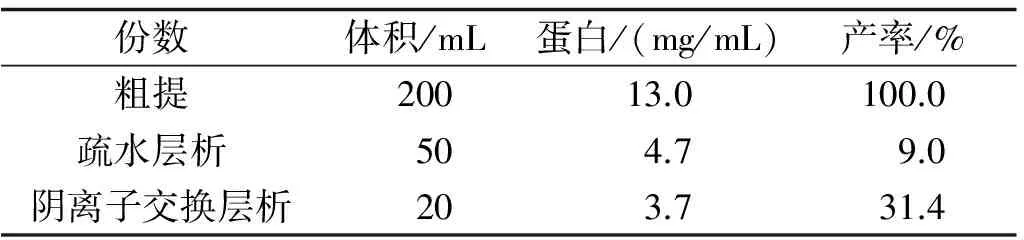
表1 半夏块茎凝集素活性的测定
活性的蛋白,各步采用MTT实验跟踪检测其活性组分并对其进行收集透析等处理,各步回收产率见表1,最后的蛋白用SDS-PAGE检测为一条带,说明APPT 达到电泳纯,结果见图1A.经蛋白飞行质谱测定APPT的分子量大小为12.09 ku,结果见图1B.
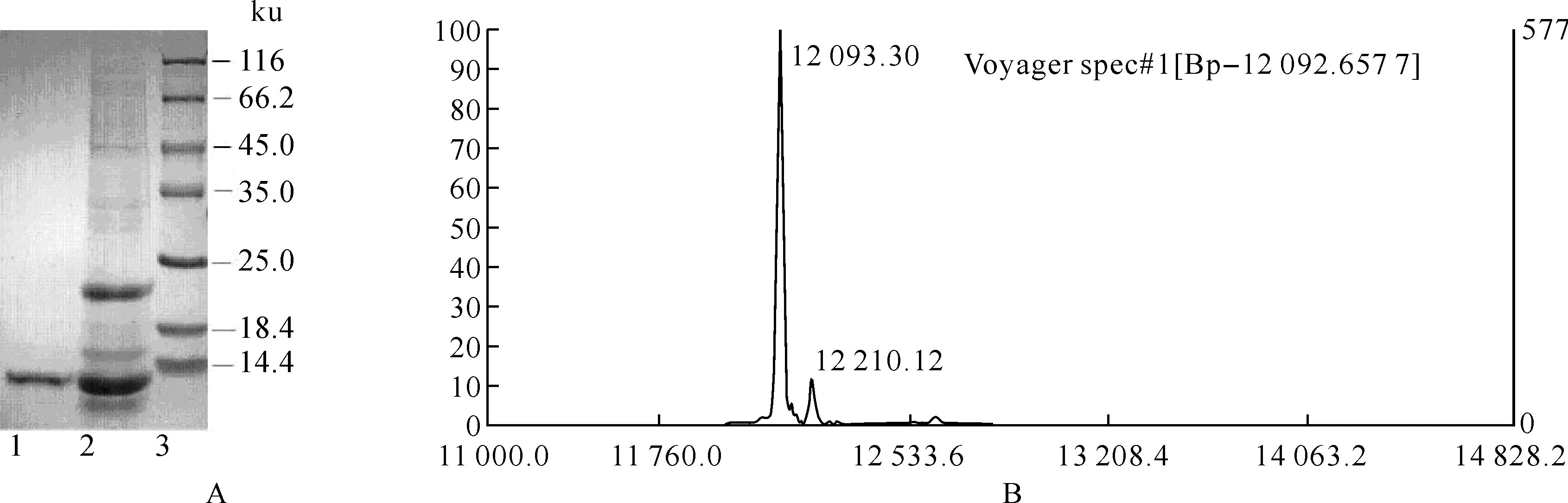
图1 A:SDS-PAGE结果;B:蛋白飞行质谱测定APPT 的分子量
2.2中性糖测定中性糖测定实验结果表明APPT是一种糖蛋白,其含糖量为3.22%.
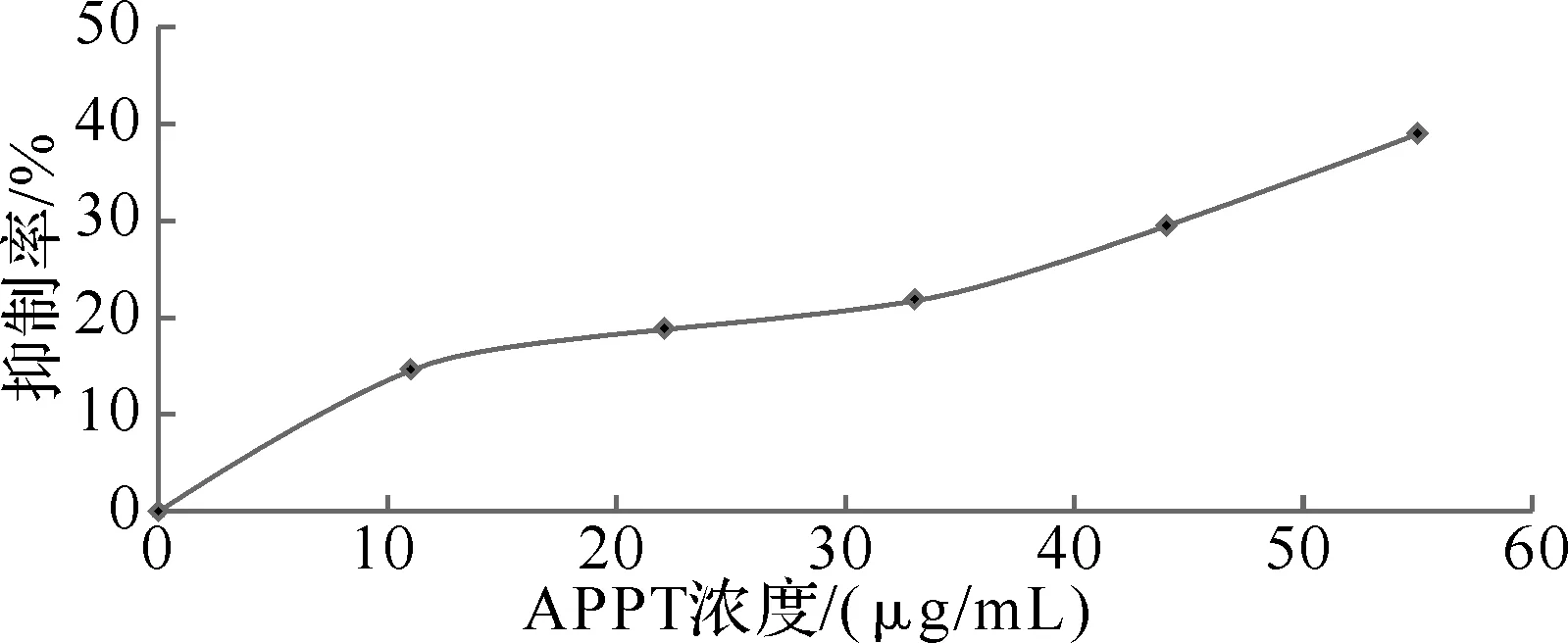
图2 MTT实验结果
2.3MTT实验MTT实验主要测定的是胞内琥珀酸脱氢酶失活的死亡的细胞,胞内琥珀酸脱氢酶没有失活的细胞,如活细胞或者凋亡早期与中期的细胞就不能被测定,也就是说MTT实验能测定药物对细胞的毒性,反映的是药物对细胞增殖的影响以及药物处理后死亡细胞的相对量,在我们的实验中11、22、33、44和55 μg/mL的抑制率分别是14.6%、19.5%、22.1%、29.8%与39%.这一结果表明,APPT对细胞有一定的毒性,并且抑制率随着浓度的增加而增大.
2.4APPT对载瘤小鼠中肿瘤生长的抑制动物实验表明,APPT与阴性对照相比能明显抑制载瘤小鼠中肿瘤细胞的生长,APPT处理的实验组肿瘤的平均质量要比阴性对照组的轻,当APPT处理剂量为0.85、2.30及3.25 mg/kg体重时,其抑制率分别为15.6%,32.1%,36.2%;但与阳性对照组相比,APPT处理的实验组肿瘤的平均质量要略高于阳性对照组的,结果见表2.
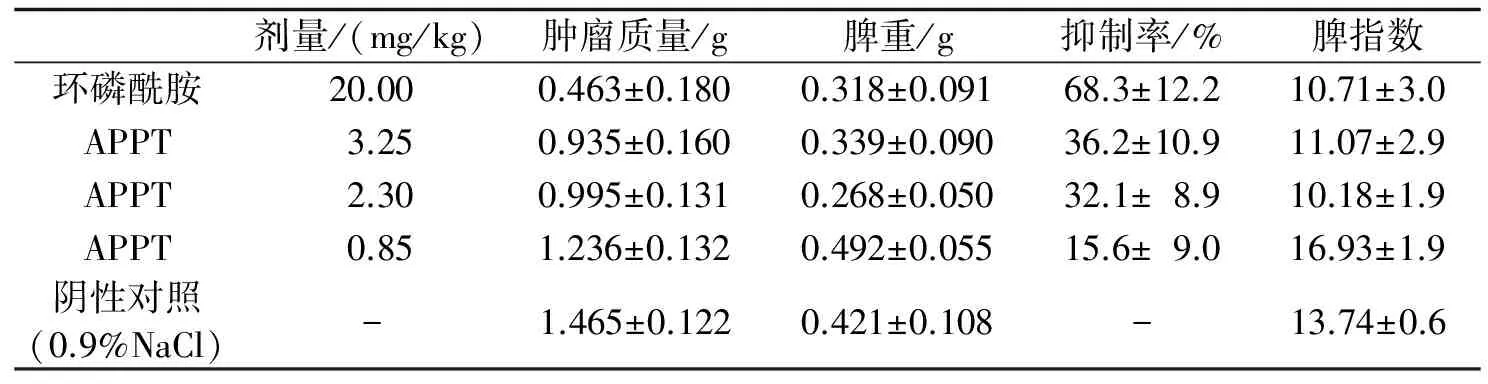
表2 APPT对载瘤小鼠中肿瘤生长的影响
抑制率=(阴性对照鼠的肿瘤质量-实验小鼠肿瘤质量)/阴性对照鼠的肿瘤质量×100%;脾指数=脾重/体质量(mg/g).
2.5流式细胞仪测定细胞周期MTT实验结果表明APPT体外对Sarcoma 180细胞有一定毒性,同时在载瘤小鼠实验中却能明显抑制载瘤小鼠肿瘤的生长,为进一步阐明APPT是影响细胞的分裂还是直接杀死细胞,我们用流式细胞仪分析APPT对Sarcoma 180细胞周期的影响,结果见图3,从图中可以看出:无论处理时间为12 h还是处理时间为24 h,不同浓度的APPT 均能使细胞周期中S期细胞比率减少,而且随着处理时间延长和处理浓度的增加这一趋势更加明显,特别在 20和 40 μg/mL的 APPT处理24 h后S期细胞的比率极低,在所有实验中均没有观察到凋亡峰.综合这些结果表明APPT 通过抑制细胞分裂中的DNA合成起始从而影响细胞增殖以达到抑制肿瘤生长的目的.
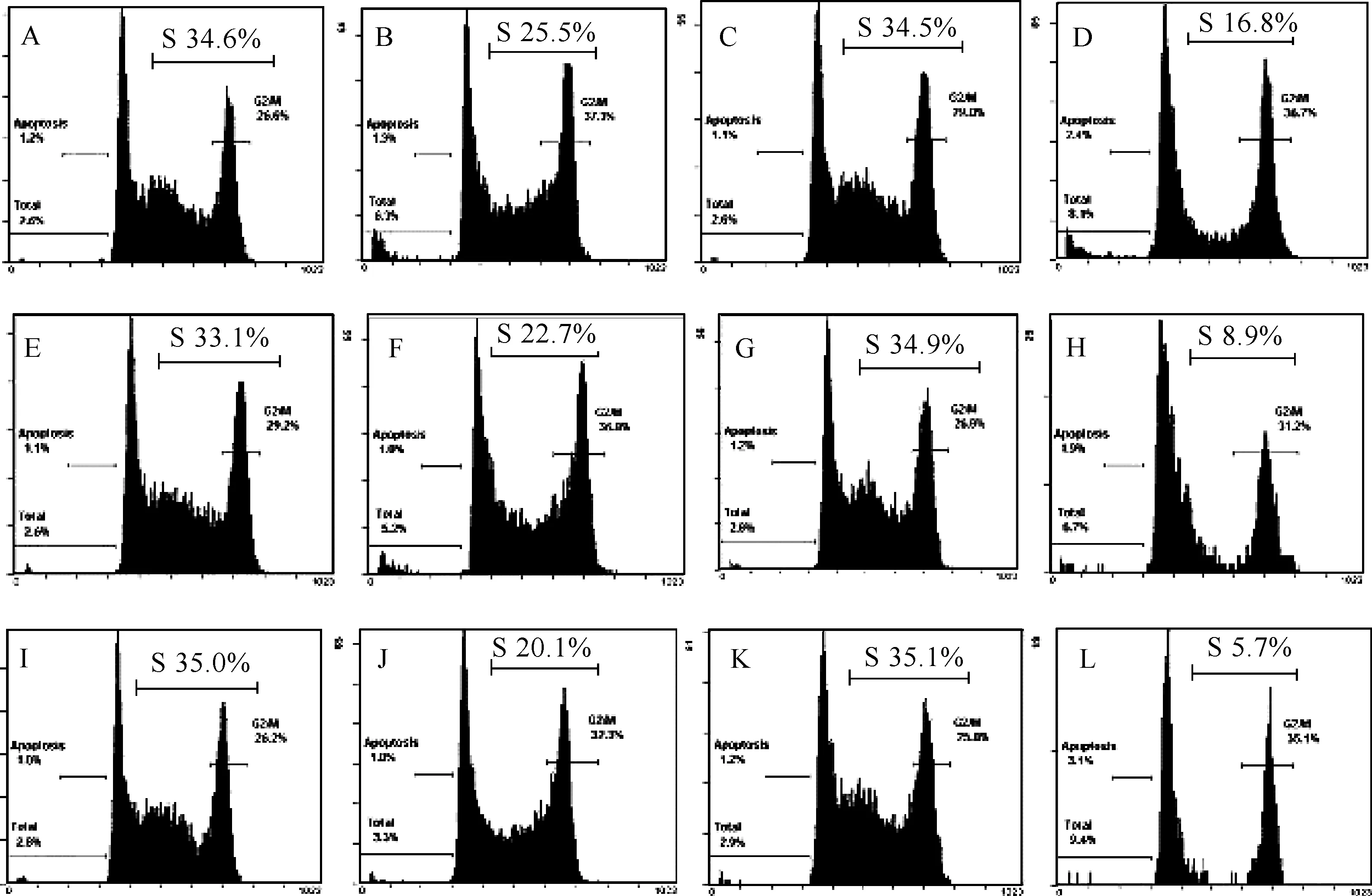
图3 APPT对Sarcoma 180细胞周期的影响
3 讨论
半夏是一种传统的中药,在临床应用中发现鲜半夏的汁液可以用于治疗宫颈癌,因此被广大的研究者所重视,在以前的研究中发现半夏的总蛋白与30%的硫酸胺组分都有抑癌活性,但没有对具体的成分进一步分离纯化,然而鲜半夏有较强的刺激性,因此有必要进一步深入分离纯化其抗癌的有效成分,以减少非抗癌活性组分可能引起的副作用[3-5].本研究中选择Sarcoma 180作为模型细胞系研究APPT抗肿瘤能力是因为Sarcoma 180是广泛使用并被认可的可用于筛选抗肿瘤药物的细胞系[14],APPT 能明显抑制载瘤小鼠体内肿瘤细胞的生长,且浓度越大,抑制率越高,这与MTT实验结果相一致.MTT实验主要测定的是胞内琥珀酸脱氢酶失活的死亡的细胞,胞内琥珀酸脱氢酶没有失活的细胞,如活细胞或者凋亡早期与中期的细胞就不能被测定,也就是说MTT实验能测定药物对细胞的毒性,反映的是药物对细胞增殖的影响、药物处理后死亡细胞的相对量以及凋亡晚期的细胞,为进一步阐明APPT对Sarcoma 180的抑制的机制是通过诱导凋亡的方式还是通过抑制其分裂增值的方式,我们用流式细胞仪进一步测定APPT对细胞周期的影响,发现APPT处理的细胞中没有出现凋亡峰,但大量细胞发生G0/G1期阻滞,提示APPT能抑制肿瘤细胞DNA的复制起始进而抑制细胞分裂增殖,表明APPT抑癌的机理并不是诱导肿瘤细胞凋亡而是抑制肿瘤细胞分裂增殖.以前的一些研究结果也表明有部分物质对肿瘤的抑制作用同APPT一样是通过抑制细胞增殖而不是直接诱导其凋亡[15-16].综上所述,APPT是半夏总蛋白中抑制肿瘤的有效成分之一,这一研究对于进一步提取鲜半夏中抗肿瘤有效成分,降低在使用过程中其他无效成分对机体的刺激或其他副作用有重要的意义.
[1] 朱黎,范汉东,王雪,等.掌叶半夏凝集素的分离纯化及体内外抗S180作用[J].武汉大学学报:医学版,2009,18(1):10-15.
[2] Lin J,Yao J,Zhou X,et al. Expression and purification of a novel mannose-binding lectin fromPinelliaternata[J].Mol Biotechnol,2003,25(3):215-222.
[3] 孙光星,丁声颂,钱瑶君.掌叶半夏总蛋白的提取、化学分析和对小鼠S-180瘤株的抑制作用[J].上海医科大学学报,1992,19(1):17-20.
[4] 朱铭伟,周抗美,丁声颂.掌叶半夏总蛋白对卵巢癌细胞株及人脐血造血细胞的作用[J].上海医科大学学报,1999,26(6):455-458.
[5] 付芸,黄必胜,李娟,等.半夏蛋白抗肿瘤活性组分的提取分离[J].中国中医药信息杂志,2007,14(1):45-46.
[6] Fan H,Liu J,Ren W,et al. pH induces thermal unfolding of UTI: an implication of reversible and irreversible mechanism based on the analysis of thermal stability,thermodynamic,conformational characterization[J].J Fluoresc,2008,18(2):305-317.
[7] Li H P,Hu Z,Yuan J L,et al. A novel extracellular protease with fibrinolytic activity from the culture supernatant ofCordycepssinensis: purification and characterization[J].Phytother Res,2007,21(12):1234-1241.
[8] Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[9] Malzberg B. Migration and mental disease in New York State,1939-1941[J]. Hum Biol,1956,28(3):350-364.
[10] Chen W,Yin Y,Jang J,et al. α-Bisabolol induces dose- and time-dependent apoptosis in HepG2 cells via a Fas- and mitochondrial-related pathway,involves p53 and NFκB[J].Biochemical Pharmacology,2010,80(2):247-254.
[11] Cai X,Pan N,Zou G. Copper-1,10-phenanthroline-induced apoptosis in liver carcinoma Bel-7402 cells associates with copper overload,reactive oxygen species production,glutathione depletion and oxidative DNA damage[J].Biometals,2007,20(1):1-11.
[12] Kuznetsova I M,Yakusheva T A,Turoverov K K. Contribution of separate tryptophan residues to intrinsic fluorescence of actin. Analysis of 3D structure[J].FEBS Lett,1999,452(3):205-210.
[13] Chen J H,Cui G Y,Liu J Y,et al. Pinelloside,an antimicrobial cerebroside fromPinelliaternate[J].Phytochemistry,2003,64(4):903-906.
[14] Bibby M C. Making the most of rodent tumour systems in cancer drug discovery[J].Br J Cancer,1999,79(11/12):1633-1640.
[15] Surh Y J. Molecular mechanism of chemopreventive effects of selected dietary and medicinal phenolic substances[J].Mutat Res,2003,428(1/2):305-327.
[16] Balzarini J,van Laethem K,Hatse S,et al. Profile of resistance of human immol/Lunodeficiency virus to mannose-specific plant lectins[J].J Virol,2004,78(19):10617-10627.
