控制虾夷扇贝闭壳肌积累类胡萝卜素相关基因的筛查*
2012-01-05任晓亮战渊超黄晓婷包振民
任晓亮,侯 睿,王 珊,战渊超,黄晓婷,包振民
(中国海洋大学海洋生物遗传育种教育部重点实验室,山东青岛266003)
控制虾夷扇贝闭壳肌积累类胡萝卜素相关基因的筛查*
任晓亮,侯 睿,王 珊,战渊超,黄晓婷**,包振民
(中国海洋大学海洋生物遗传育种教育部重点实验室,山东青岛266003)
利用抑制性差减杂交技术(Suppression subtractive hybridization,SSH)对虾夷扇贝闭壳肌积累类胡萝卜素相关基因进行筛查和分析。以虾夷扇贝橘红色闭壳肌和白色闭壳肌cDNA构建正反向差减文库,结合454测序技术在正向差减文库中测序得到2 640条序列,拼接得到50个contigs(重叠群);反向差减文库中测序得到2 496条序列,拼接得到187个contigs。经过同源性比对分析,共获得150多个差异表达基因,从中选择3种清道夫受体SRB1、SRF2和SRCR作为候选基因进行研究,对其在虾夷扇贝各组织中的表达量水平进行检测,初步阐述了其在虾夷扇贝中的组织表达规律。根据结果推测在虾夷扇贝橘红色闭壳肌中,清道夫受体有可能是调节类胡萝卜素累积和转运的关键基因。本研究为虾夷扇贝闭壳肌类胡萝卜素累积相关通路的探索提供了初步研究的基础数据。
虾夷扇贝;闭壳肌;类胡萝卜素;抑制性差减杂交
虾夷扇贝(Patinopecten yessoensis)是我国从日本引种的重要海水养殖贝类[1]。2003年中国海洋大学课题组在虾夷扇贝野生群体里发现了一种颜色突变体虾夷扇贝,约占群体总数0.2%,其闭壳肌呈鲜艳的橘红色而不是普通的白色,研究表明造成这一变异主要是由于橘红色闭壳肌扇贝的肉柱中积累了大量的类胡萝卜素[2]。随后课题组开展了选育工作,育成了闭壳肌富含类胡萝卜素的“海大金贝”(品种登记号:GS-01-002-2009)。研究发现,闭壳肌内累积类胡萝卜素是稳定遗传的质量性状。但是,这种类胡萝卜素的累积的机理如何?有哪些基因在这一过程中起了关键作用?目前并不清楚,需要进一步研究。
抑制性差减杂交(Suppression subtractive hybridization,简称SSH)技术自Diatchenko[3]等建立以来,已在水稻[4]、小麦[5-6]、玉米[7]、大鼠[8]、猪[9]以及人[10]等多种生物的差异基因分离中得到应用,被认为是有效富集差异表达基因的方法之一[11]。本研究利用SSH法对虾夷扇贝闭壳肌颜色差异相关基因进行筛选和分析。以“海大金贝”橘红色闭壳肌(简称红柱)和白色闭壳肌(简称白柱)c DNA为材料构建SSH文库,结合454测序技术对筛选得到的特异性cDNA进行测序,分析闭壳肌内可能与类胡萝卜素累积相关的基因的功能,为深入了解虾夷扇贝闭壳肌类胡萝卜素累积相关机制提供基础数据。
1 材料与方法
1.1 实验材料
虾夷扇贝取自大连獐子岛渔业有限公司,分别取15只3龄红柱和白柱虾夷扇贝的闭壳肌组织,液氮冷冻,-80℃保存。
1.2 方法
1.2.1 虾夷扇贝闭壳肌总RNA的提取及m RNA的分离纯化 分别取红柱与白柱虾夷扇贝的闭壳肌组织,按常规的异硫氰酸胍法[12]裂解提取总RNA。随后用Oligotex m RNA Purification Kit(Qiagen公司)分离和纯化m RNA。
1.2.2 虾夷扇贝闭壳肌组织cDNA的抑制性差减杂交
具体操作按照PCR-Select TM cDNA Subtraction Kit(Clontech公司)说明书进行。首先分别取红柱与白柱虾夷扇贝mRNA各2μg合成双链cDNA,然后分别经RsaⅠ酶切消化。正向差减杂交以虾夷扇贝红色肉柱cDNA为tester(测试组),白色肉柱cDNA为driver(驱动组);反之设为反向差减杂交。按照Clontech公司的试剂盒操作说明,经过68℃8和20 h 2轮差减杂交后,再进行2轮抑制性PCR以获得特异性扩增的cDNA片段。
1.2.3 差异片段的测序与分析 将2轮抑制性PCR后获得的特异性扩增的cDNA进行纯化回收,加标识个体或组织的barcode接头,将所有产物混合后,利用罗氏454 GS FLX进行测序,将获得的序列信息去除接头序列后,利用CAP3软件进行序列拼接,而后利用NCBI的Blastx软件对序列进行同源性比对及功能注释。对2个文库中筛选到的序列的数目差异进行显著性检验。
1.2.4 清道夫受体的组织表达分析 对454测序表达差异显著的3种清道夫受体SRB1、SRF2和SRCR作为研究对象,分别取虾夷扇贝红柱个体与白柱个体外套膜、腮丝、性腺、肾、闭壳肌以及肝胰腺组织,按常规的异硫氰酸胍法[12]裂解提取总RNA,采用实时荧光定量PCR技术,检测虾夷扇贝不同组织中清道夫受体的表达情况,用2-△△CT法对实验结果进行分析。
2 结果与分析
2.1 虾夷扇贝闭壳肌组织RNA的提取质量
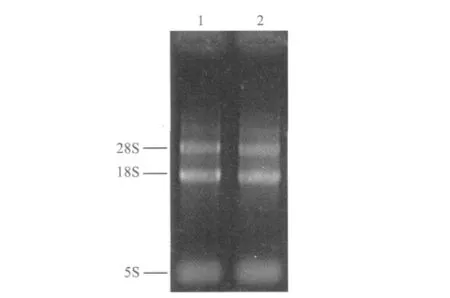
图1 白柱与红柱虾夷扇贝闭壳肌总RNA检测结果Fig.1 Electrophoresis of total RNA extracted from the white and orange adductor muscles of P.yessoensis
图1所示为经1.5%琼脂糖凝胶电泳检测的白柱与红柱虾夷扇贝闭壳肌组织提取的总RNA。28S RNA、18S RNA亮度的比值约为1∶2,条带清晰表明总RNA具有较好的完整性,基本没有降解的情况。本实验利用紫外分光光度计检测RNA的浓度和纯度,结果表明实验选取的白柱和红柱虾夷扇贝闭壳肌的总RNA的OD260nm/OD280nm比值分别是1.96和1.98,证明本实验提取的总RNA质量较高,基本没有杂质污染,并且总RNA浓度满足试剂盒的要求。
2.2 抑制性差减杂交产物的检测
抑制性差减杂交产物经过2次特异性PCR扩增之后电泳结果如图2所示。
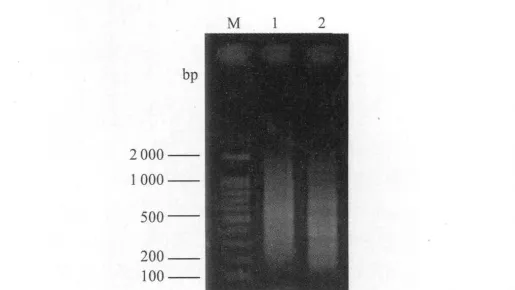
图2 正反向差减文库差减杂交产物第二轮PCR扩增结果Fig.2 Electrophoresis of SSH products of the forward and reverse subtracted libraries amplified after two rounds of PCR
正反向差减文库的差减杂交产物在经过2次特异性PCR后得到了扩增,电泳结果为一段弥散的cDNA smear,片断大小主要集中在250~750 bp之间,较大的片断得到了明显的消减。
2.3 cDNA差减文库的构建及差减效率检测
将抑制差减杂交cDNA的第2次抑制性扩增产物纯化回收,构建了正反向差减文库。通过对文库中的克隆进行PCR检测,显示文库中的插入片段大小主要随机分布在250~750 bp之间,部分克隆的PCR电泳结果如图3和4所示。另外对整个抑制性差减杂交流程进行差减效率检测,分别以差减c DNA与未差减cDNA为模板对持家基因β-actin进行扩增,在第18、23、28、33、38个循环时从体系中取出7μL扩增产物进行电泳检测。未消减cDNA在18~23个循环后就有β-actin扩增条带出现,而消减cDNA在33个循环后才有β-actin扩增条带出现,该结果说明2次差减杂交过程中的消减效率较高,所构建的正反向差减文库质量较好。
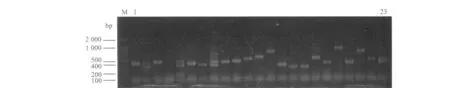
图3 正向差减文库插入片段的检测结果Fig.3 Identification of the inserted cDNA fragments in the forward subtracted library
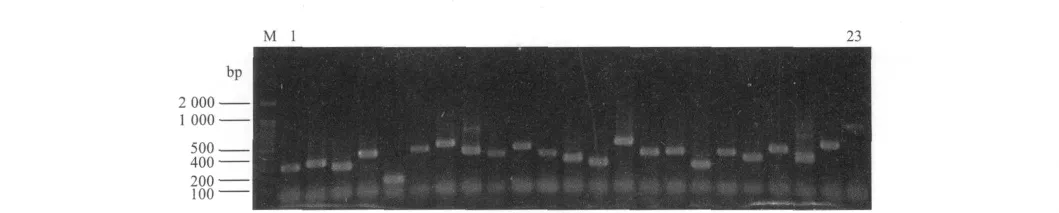
图4 反向差减文库插入片段的检测结果Fig.4 Identification of the inserted cDNA fragments in the reverse subtracted library
2.4 差减杂交产物的测序及分析
利用454测序技术对筛选得到的特异性cDNA进行测序分析,统计结果见表1。
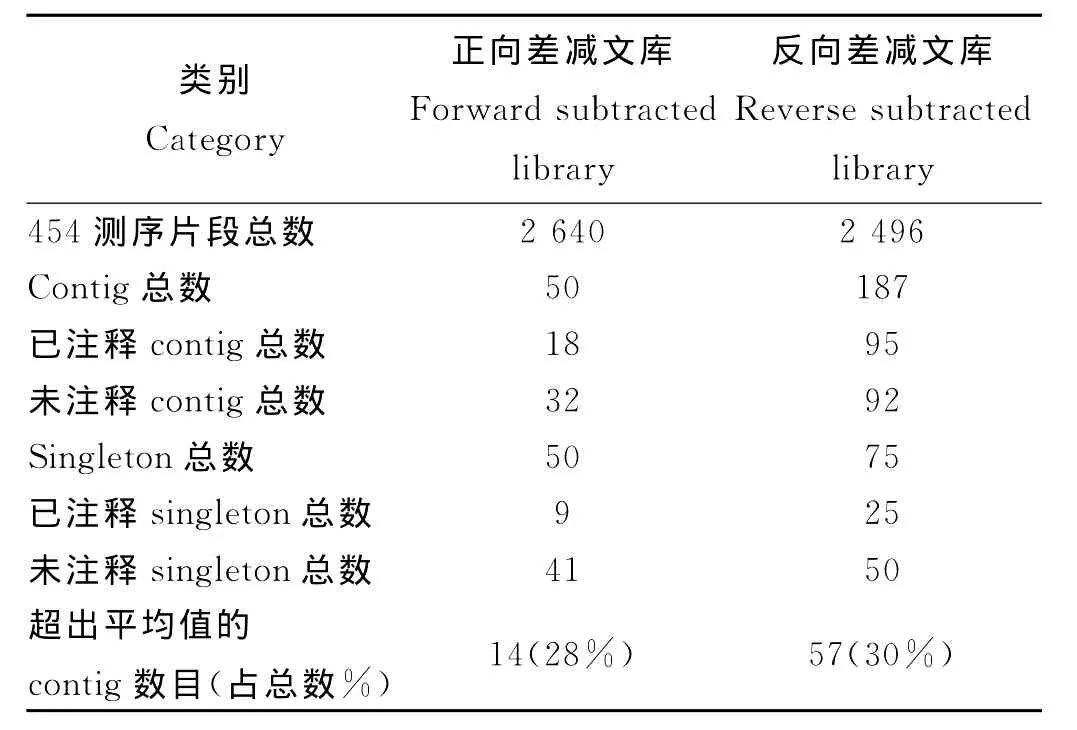
表1 虾夷扇贝正反向差减文库序列数目统计Table 1 Quantities of sequences of the forward and reverse subtracted libraries of P.yessoensis
正向差减文库测序得到2 640条序列,拼接得到50个contigs(重叠群),其中14个表达量超过平均值,占28%;反向差减文库测序得到2 496条序列,拼接得到187个contigs,其中57个表达数目明显多于平均值,占总数的30%。从正反向差减文库得到的454读取的片段数目大致相同可以看出两文库构建的标准统一,结果具有可比性,其后续拼接的contigs的数目差异和种类差异主要是由基因表达的差异造成的。
对表达明显变化的基因片段对NCBI的genbank数据库同源性比对,红柱特异性序列中获得了清道夫受体,紧密连接蛋白、锚蛋白、锰超氧化物歧化酶、磷酸葡萄糖变位酶等共27种基因,涉及脂类代谢,渗透调节、细胞连接、肌肉运动、活性氧清除等方面,部分结果如表2所示;白柱特异性序列中获得了多聚泛素、PDZ结构域蛋白、溶质载体等共121种基因,涉及蛋白降解,信号传递,转录调控等方面,部分结果如表3所示。

表2 正向差减文库cDNA片段同源比对结果(P<0.05)Table 2 BLAST results of forward subtracted cDNA library(P<0.05)
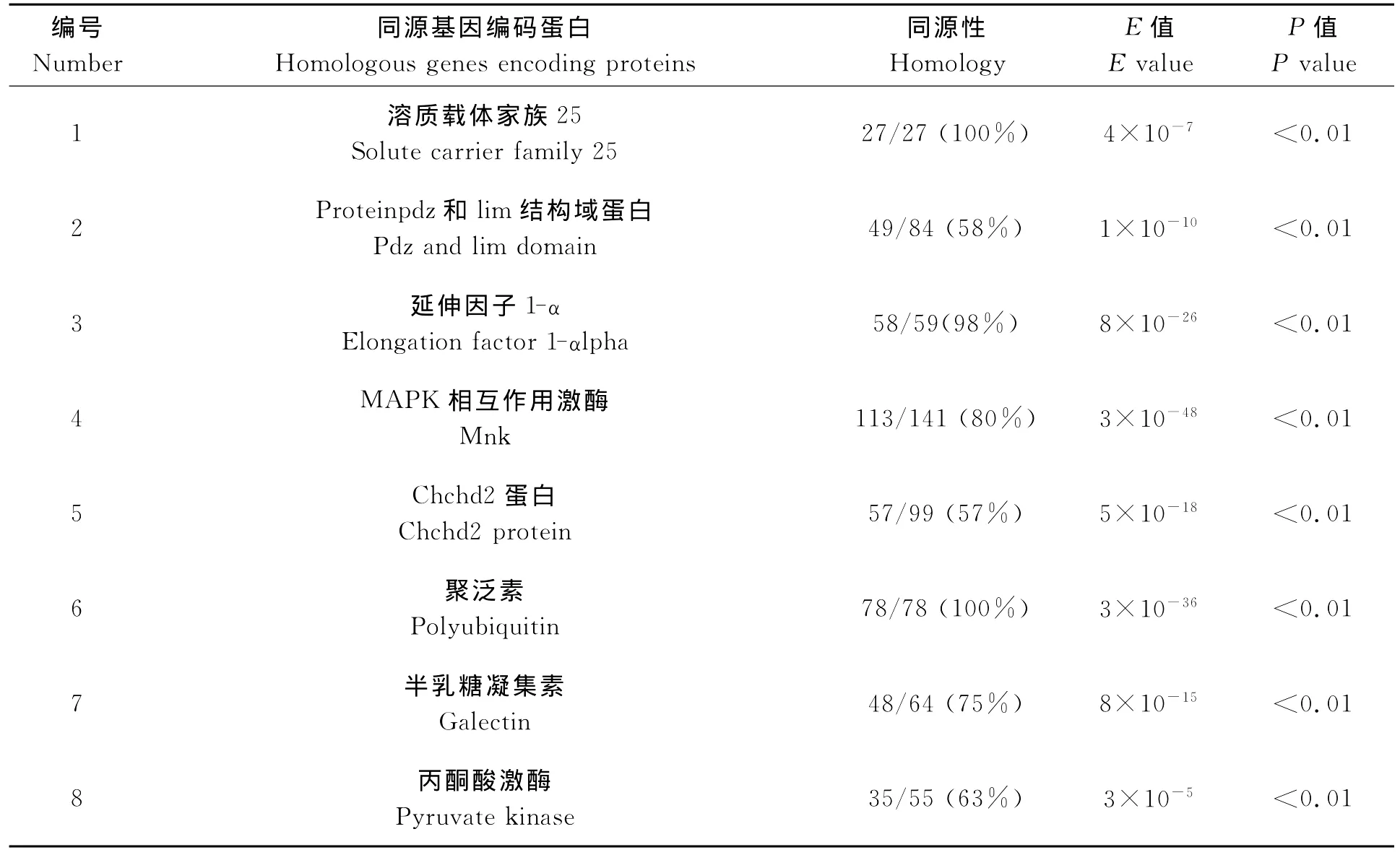
表3 反向差减文库cDNA片段同源比对结果(P<0.05)Table 3 BLAST Results of reverse subtracted cDNA library(P<0.05)
2.5 清道夫受体基因的组织表达分析
通过差异显著性检验,筛选得到的3种清道夫受体基因的序列丰度在红白柱虾夷扇贝之间存在显著差异,清道夫受体基因SRB1,SRF2和SRCR在红白柱虾夷扇贝各组织中的表达量检测结果分别如图5~7所示。
SRB1在肝胰腺中的表达量最高,在性腺中的表达量次之,在外套膜,腮,肾以及闭壳肌中的表达量均较低。SRB1分别在雄性红白柱虾夷扇贝中的表达量相似。在雌性性腺和闭壳肌组织中,红柱虾夷扇贝SRB1表达量显著高于白柱虾夷扇贝。
SRF2在性腺和肾中的表达量明显高于其他组织,且在肾中的表达量最高。在雌性肾组织中,红柱虾夷扇贝SRF2表达量高于白柱虾夷扇贝,在雌性闭壳肌组织中,红柱虾夷扇贝SRF2表达量显著高于白柱虾夷扇贝。在雄性性腺中,红柱虾夷扇贝SRF2表达量显著低于白柱虾夷扇贝。
SRCR在肝胰腺中的表达量最高,且明显高于其他组织,在红柱虾夷扇贝中的表达量高于白柱虾夷扇贝。SRCR在性腺和肝胰腺中也有较高的表达量,在雌性性腺中,红柱虾夷扇贝SRCR表达量高于白柱虾夷扇贝,在雄性性腺中,红柱虾夷扇贝SRCR表达量低于白柱虾夷扇贝。在雌性闭壳肌组织中,红柱虾夷扇贝SRCR表达量显著高于白柱虾夷扇贝。
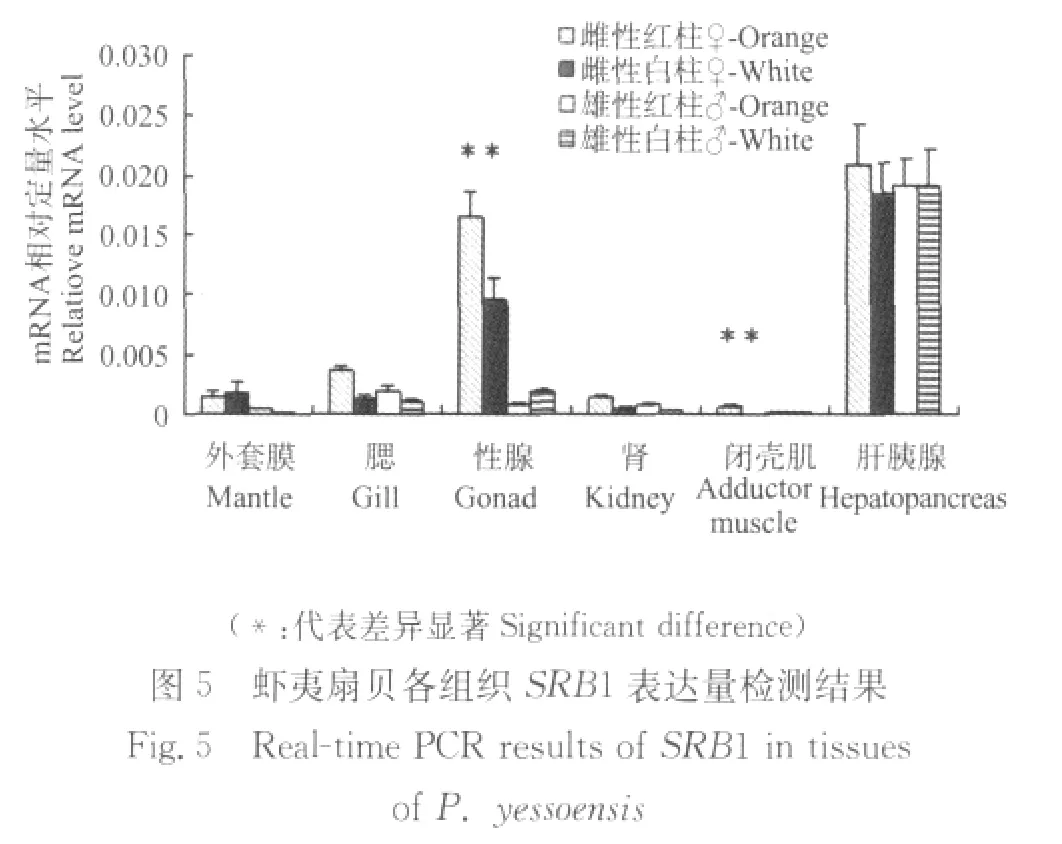
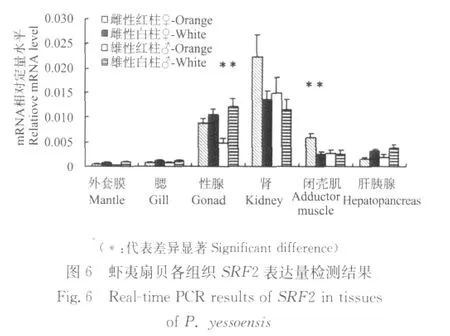

图7 虾夷扇贝各组织SRCR表达量检测结果Fig.7 Real-time PCR results of SRCR in tissues of P.yessoensis
3 讨论
3.1 正反向差减文库的构建
作为一种高效的分离差异表达基因的方法,SSH技术筛选差异基因的阳性率可达94%[13]。在实际应用中,SSH最显著的特点在于应用2次差减杂交和2次PCR扩增[14],消除了c DNA群体中各分子间丰度的差异,使低丰度表达基因得到富集[15],提高了筛选得到低丰度表达基因的可能性。本研究将SSH技术与454测序技术相结合,省去了常规的连接转化挑取克隆等步骤,大大简化了实验流程,同时利用454测序技术的高通量等特点,可以获得绝大部分筛选得到的特异性序列的信息,进一步提高了得到低丰度表达基因的可能性。在测序过程中,表达丰度不同的特异性序列测序深度不同,直接反映了它们在表达量上的差异,为后续实验筛选候选基因提供了依据。
本研究在正向抑制性差减杂交cDNA文库中,筛选得到了铁蛋白(Ferritin),铁蛋白是普遍存在于生物体内的一种保守性较高的多功能多亚基蛋白,它不仅调节体内铁的含量,而且在抵抗氧化损害、调节细胞增殖等方面发挥了重要作用,且和机体的免疫反应有一定的相关性[16]。在一定范围内,随着体内铁离子含量的增加,体内自由基含量增加,可以氧化低密度脂蛋白(LDL)形成氧化-LDL(ox-LDL)[17],推测铁蛋白有可能通过调控体内铁离子的含量来影响低密度脂蛋白的水平,进而影响到类胡萝卜素在体内的转运过程。
在反向抑制性差减杂交cDNA文库中,筛选得到了多聚泛素(Polyubiquitin)等基因。多聚泛素由多个泛素单体首尾相连而形成,可以被特殊的蛋白酶消化为泛素单体[18]。泛素-蛋白酶体途径是细胞内ATP依赖的蛋白质选择性降解的主要途径,参与细胞凋亡、抗原呈递、细胞周期以及细胞内信号转导等多种生理过程[19],其对靶蛋白的降解是一种级联反应过程[20]。在哺乳动物细胞中泛素系统被认为参与了几种膜蛋白的内化和下调,如上皮钠通道(ENaC)、生长激素受体(GHR)、表皮生长因子受体(EGFR)、集落剌激因子/受体和某些免疫系统受体[21]。在酵母细胞中,泛素可能作为一种内化信号直接与胞吞系统相互作用[22]。研究表明,泛素-蛋白酶体途径可能参与了内化后受体到溶酶体的转运[23-25],而在溶酶体内降解的低密度脂蛋白受体相关蛋白(LDL receptor-related protein,LRP)也发现有类似的结果,低密度脂蛋白正是转运类胡萝卜素的重要载体之一,因此推测蛋白酶体可能参与下调类胡萝卜素的累积。
本实验室利用蛋白质双向电泳技术对橘红色闭壳肌与白色闭壳肌中的蛋白质成分进行比较,并对橘红色闭壳肌中特异性表达的蛋白质进行质谱分析(未发表),筛选得到了7种蛋白,分别是延伸因子-β(Elongation factor 1-beta)、蛋白酶体亚基(Proteasome subunit alpha type-1)、果糖二磷酸醛缩酶(Fructose-bisphosphate aldolase)、过氧化物辅酶A异构酶(Peroxisomal 3,2-trans-enoyl-Co A isomerase)、T-复合物多肽1(TCP1)、微管蛋白(Tubulin)以及铁蛋白(Ferritin)。将这一结果与本研究进行比较,其中Fructose-bisphosphate aldolase、Tubulin、Ferritin在正向差减文库中均有发现,而Elongation factor 1-beta在反向差减文库中有发现,其余3种蛋白在正反向差减文库中均没有发现。比较发现在差减文库中筛选得到的特异性序列,在其他实验也可以筛选得到,说明本实验所采用的抑制性差减杂交技术是比较稳定可靠的。在七种蛋白当中有一些蛋白没有在差减文库中筛选到,作者认为这一现象的产生首先是由于454测序过程中要将cDNA进行片断化处理,因此测序得到的并不是全长的片段,这样通过序列比对,差减文库中的短基因片段由于同源区段过短可能无法得到注释。其次,这种差异有可能代表了橘红色闭壳肌和白色闭壳肌在转录组水平以及蛋白质水平上的表达差异,其中有3种蛋白在2个实验中均被筛选出来,可以推测这3种蛋白在2种组织中的表达量确实存在着明显差异,也有可能与类胡萝卜素的累积有关。另外4种蛋白的筛选结果与差减文库筛选的结果有所不同,可能是由于同一基因的cDNA的表达水平与蛋白的表达水平可能存在差异,蛋白检测的结果对于本研究提供了一定的补充,为类胡萝卜素累积机理的研究提供了更多的候选基因。
根据正反向差减文库的序列数量分布情况,可以看出,正反向差减文库最终得到的序列数目大体相似,但其中的特异表达基因在数量分布上呈现不同的趋势。正向差减文库的特异表达基因在数量分布上相对集中,均值比较高,而反向差减文库的特异表达基因在数量分布上则相对离散,均值比较低,推测橘红色闭壳肌与白色闭壳肌虾夷扇贝在转录组水平上有着比较大的差异,这种差异的产生有可能是导致类胡萝卜素累积的原因,也有可能是受类胡萝卜素累积影响而产生的代谢结果,因此还需要进一步的研究来加以证实。
本研究从正反向差减文库同源比对结果中选取了几个具有代表性的差异表达基因,对它们的组织表达规律进行了研究,但更多差异表达基因的组织表达规律,在虾夷扇贝闭壳肌类胡萝卜素累积过程中如何发挥作用等问题还需要进一步的研究探索。此外,在同源比对结果中还得到了一些未知功能的高拷贝数的新序列,因为在Gene bank中没有找到相应的同源基因,所以这些序列是否涉及一些尚未被研究认识的扇贝特异性功能,也需要进一步的研究验证。
3.2 清道夫受体的组织表达规律
本研究根据测序数据中基因的丰度水平对这些基因的差异显著性进行分析,发现SRB1、SRF2以及SRCR这3种清道夫受体的序列丰度在红白柱虾夷扇贝之间存在显著差异。在果蝇(Drosophila)的研究中,Cornelia Kiefer等人发现nina D基因编码一种B族清道夫受体,该受体与哺乳动物中发现的B族1型清道夫受体(SRB1)有着很高的同源性,该受体位于细胞膜的表面,类胡萝卜素在转运过程中首先要与高密度脂蛋白(HDL)和低密度脂蛋白(LDL)结合,形成类胡萝卜素蛋白复合物,该复合物被位于细胞膜上的清道夫受体所识别,并进一步通过其介导进入胞内,因此清道夫受体在组织细胞吸收类胡萝卜素的过程中起着关键性的作用[26]。推测在虾夷扇贝橘红色闭壳肌类胡萝卜素累积和转运的过程中,清道夫受体具有类似的功能,有可能是调节类胡萝卜素吸收的关键基因。相对于其他候选基因,如铁蛋白,多聚泛素等,清道夫受体的调节作用更为直接明显,因此,选择3种清道夫受体基因作为首选的候选基因进行后续的研究。
在性腺中,SRB1在雌雄个体间的表达量差异很大,在雌性个体中的表达量高于雄性个体,在雌性性腺中,SRB1在红柱虾夷扇贝中的表达量显著高于白柱虾夷扇贝,推测原因可能是,在性腺发育过程中,相比于雄性性腺,雌性性腺中会大量累积类胡萝卜素,SRB1由于参与类胡萝卜素的吸收,所以在雌性个体中的表达量要高于雄性个体,同时该结果也暗示红柱虾夷扇贝的性腺在吸收类胡萝卜素方面要强于白柱虾夷扇贝。SRB1在肝胰腺中的表达量最高,有可能是因为肝胰腺是类胡萝卜素吸收和转运较为旺盛的区域,而SRB1由于起到关键的介导作用,表达水平很高。在雌性闭壳肌组织中,SRB1在红柱虾夷扇贝中的表达量显著高于白柱虾夷扇贝,这一结果与橘红色闭壳肌中类胡萝卜素含量显著高于白色闭壳肌的结果[2]相吻合,推测SRB1在橘红色闭壳肌吸收转运类胡萝卜素的过程中可能起到关键作用。在雌性闭壳肌组织中,SRF2和SRCR在红柱虾夷扇贝中的表达量显著高于白柱虾夷扇贝,这一结果同样与橘红色闭壳肌中类胡萝卜素含量显著高于白色闭壳肌的结果相吻合,推测SRF2和SRCR同样在橘红色闭壳肌吸收转运类胡萝卜素的过程中可能起到关键作用。
通过上面结果可以发现,3种清道夫受体结构相似,功能相近,在虾夷扇贝各组织中的表达规律存在着相似的地方,比如在肝胰腺和性腺中表达量较高,在雌性闭壳肌组织中,3种清道夫受体在红柱虾夷扇贝中的表达量均显著高于白柱虾夷扇贝,与橘红色闭壳肌中类胡萝卜素含量显著高于白色闭壳肌的结果相吻合,然而这3种清道夫受体的组织表达规律仍存在着明显的不同,这可能与它们具体的功能存在差别有关。
清道夫受体在虾夷扇贝中的组织表达规律为揭示橘红色闭壳肌内类胡萝卜素累积的原因提供了一定的佐证,但尚无法给出确切的结论,还需要对其做进一步的研究。
[1] 张福绥,李淑英,开玲欣,等.虾夷扇贝的引种,育苗及试养[J].海洋科学,1984,35:38-45.
[2] 李宁.虾夷扇贝橘红色闭壳肌产生的原因及其在育种中的应用[D].青岛:中国海洋大学,2009.
[3] Diatchenko L,Chris L.Suppression subtractive hybridization:A method for generating differentially regulated or tissue-specific cDNA probes and libraries[J].Biochemistry,1996,93:6025-6030.
[4] Liu J,Liu J,Yuan Z M,et al.Isolation and identification of genes expressed differentially in rice inflorescence meristem with suppression subtractive hybridization[J].Chinese Science Bulletin,2001,46(2):98-101.
[5] Li H X,Zhang L,Zhang G S,et al.Construction of cDNA library from fertility related genes of male sterile wheat with Aegilops kotschyi cytoplasm by SSH[J].Acta Agronomica Sinica,2008,34(6):965-971.
[6] 林凡云,陆琼娴,徐剑宏,等.抑制差减杂交分离赤霉病菌诱导的小麦特异表达基因[J].西北植物学报,2008,28(3):433-439.
[7] 吕萌萌,王景安.低锌与正常供锌条件下玉米基因表达差异的研究[J].华北农学报,2007,22(4):94-98.
[8] Gris P,Murphy S,Jacob J E,et al.Differential gene expression profiles in embryonic,adult-injured and adult-uninjured rat spinal cords[J].Molecular and Cellular Neuroscience,2003,24:555-567.
[9] Beno t L,Olivier M,Vilceu B,et al.Identification of differential-ly expressed genes in a porcine in vivo model of adipogenesis using suppression subtractive hybridization[J].Comparative Biochemistry and Physiology,Part D,2009,4:32-44.
[10] Sun W Y,Zhang K T,Zhang X Y,et al.Identification of differentially expressed genes in human lung squamous cell carcinoma using suppression subtractive hybridization[J].Cancer Letters,2004,212:83-93.
[11] Brown M,Davies I M,Moffat C F,et al.Application of SSH and a macroarray to investigate altered gene expression in Mytilus edulis in response to exposure to benzo(a)pyrene[J].Marine Environmental Research,2006,62:128-135.
[12] Chomczynski P,Sacchi N.Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction[J].Analytical Biochemistry,1987,162:156-159.
[13] Oliver D,Wolf G T,Martin H.A high throughput screening for rarely transcribed differentially expressed genes[J].Nucleic Acids Research,1997,25(13):2598-2602.
[14] 陈兆羽,徐安英,李木旺.家蚕黄血近等基因系SSH文库的构建及部分EST的序列分析[J].蚕业科学,2009,35(1):24-29.
[15] 蔡静莉,李昌本,赵寿元.鉴别差异表达基因的新方法——抑制消减杂交法(SSH)[J].生命科学,1998,10(3):115-118.
[16] 刘宝娟,张文兵.铁蛋白的结构、功能及表达调控[J].饲料工业,2009,30(4):42-47.
[17] Ehara S,Ueda M,Naruko T,et al.Elevated levels of oxidized low density lipoprotein show a positive relationship with the severity of acute coronary syndromes[J].Circulation,2001,103(15):1955-1960.
[18] 王金昌,李燕萍.泛素-蛋白酶体途径的生物学功能[J].江西科学,2006,24(2):155-158.
[19] Pickart C M,Eddins M J.Ubiquitin:structures,functions,mechanisms[J].Biochimica et Biophysica Acta,2004,1695:55-72.
[20] Smalle J,Vierstra R D.The ubiquitin 26S proteasome proteolytic pathway[J].Annual Review of Plant Biology,2004,55:555-590.
[21] 屈顺林.泛素-蛋白酶体途径与受体胞吞[J].国外医学·生理、病理科学与临床分册,2004,24(1):11-14.
[22] Susan C S,Katherine S M,Linda H.Monoubiquitin carries a novel internalization sinagal that is appended to activated receptor[J].Embo Journal,2000,19(2):187-198.
[23] Peter VK,Cristina M,Aleves dos S,et al.Proteasome inhibitiors block a late step in lysomal transport of selected membrane but not soluble protein[J].Molecular Biology of the Cell,2001,12:2556-2566.
[24] Amy F R,Nicholas G D.Ubiquitination of PEST-like endocytosis signal of the yeast a factor receptor[J].The Journal of Biological Chemistry,2000,275(11):8143-8153.
[25] Rebecca D,Linda H.Roles for Rsp5p-dependent ubiquitination at the internalization step of endocytosis[J].The Journal of Biological Chemistry,2001,276(28):25974-25981.
[26] Cornelia K,Emerich S,Mathias F W,et al.A class B scavenger receptor mediates the cellular uptake of carotenoids in Drosophila[J].Pnas,2002,99:10581-10586.
Identification of genes relating to carotenoids accumulation in adductor muscles of Yesso scallops(Patinopecten yessoensis)
REN Xiao-Liang,HOU Rui,WANG Shan,ZHAN Yuan-Chao,HUANG Xiao-Ting,BAO Zhen-Min
(Key Laboratory of Marine Genetics and Breeding,Ministry of Education,Ocean University of China,Qingdao 266003,China)
Differentially expressed genes relating to carotenoids accumulation in adductor muscle of Yesso scallop(Patinopecten yessoensis)were isolated using suppression subtractive hybridization(SSH)technique.The cDNA of orange and white adductor muscle was used to construct the forward and reverse subtracted libraries.The cDNA fragments differentially expressed in both subtracted libraries were sequenced using 454 sequencing technique.In the forward subtracted library,50 contigs were obtained from 2640 sequences;in the reverse subtracted library,187 contigs were obtained from 2496 sequences.There were more than 150 genes differentially expressed from which three scavenger receptor genes such as SRB1,SRF2 and SRCR were chosen as candidate genes.The analysis of quantitative expression of scavenger receptor genes in all tissues of Yesso scallop was carried out.The results revealed that the scavenger receptors may play a key role in mediating the cellular uptake of carotenoids in Yesso scallops.The results provided preliminary foundation for exploring the pathway of carotenoids accumulation.
Patinopecten yessoensis;adductor muscle;carotenoid;SSH
S197
A
1672-5174(2012)09-041-07
国家自然科学基金项目(31072190;31130054);国家重点基础研究发展计划项目(2010CB126406);现代农业产业技术体系建设专项资助
2011-10-27;
2012-06-09
任晓亮(1985-),男,硕士生。E-mail:renxiaoliang0417@163.com
**通讯作者:E-mail:xthuang@ouc.edu.cn
责任编辑 朱宝象
