盐度突变对凡纳滨对虾渗透调节中血蓝蛋白和糖酵解影响的初步研究*
2012-01-05赵卓英董双林
李 英,王 芳,赵卓英,董双林
(1.中国海洋大学教育部海水养殖重点实验室,山东青岛266003;2.北京市水产技术推广站,北京100021;3.国家海洋标准计量中心,天津300112)
盐度突变对凡纳滨对虾渗透调节中血蓝蛋白和糖酵解影响的初步研究*
李 英1,2,王 芳1**,赵卓英3,董双林1
(1.中国海洋大学教育部海水养殖重点实验室,山东青岛266003;2.北京市水产技术推广站,北京100021;3.国家海洋标准计量中心,天津300112)
实验室条件下测定盐度突变对凡纳滨对虾(Litopenaeus vannamei)血淋巴渗透压、血蓝蛋白、血糖、己糖激酶(HK)以及丙酮酸激酶(PK)活力的影响。以蜕皮间期对虾为实验材料(初始湿体重为(2.485±0.303)g),设盐度30为对照组,4个不同的盐度突变幅度(为2、4、6、8)为处理组(用S2、S4、S6和S8表示),于降低盐度和恢复盐度至30的不同时间点采样,实验持续7 d。结果表明:(1)凡纳滨对虾血淋巴渗透压会随盐度变化而变化,S4组对虾血淋巴含量在整个实验过程中处于较低水平;(2)随着盐度突变幅度的增加,血蓝蛋白含量与对照组呈现显著性差异(P<0.05)的采样点增多;(3)S4组对虾血糖含量整个实验过程中一直处于较低水平,而S6、S8组对虾血糖含量相对较高;(4)整个实验过程中,S4组对虾肝胰脏中HK活力处于较低水平,而S6与S8组对虾肝胰脏中HK活力处于较高水平;(5)S2、S4组对虾肝胰脏中PK活力与对照组没有显著性差异(P<0.05),而S6和S8组对虾肝胰脏PK活力在盐度突变后与对照组肝胰脏PK活力表现出显著性差异(P<0.05)。
凡纳滨对虾;盐度;血蓝蛋白;血糖;糖酵解
在对虾养殖生产过程中,由于换水、降雨或者持续干旱等原因,养殖水体的盐度经常发生突变,进而影响对虾的蜕皮和生长。在实际养殖生产过程中,也有部分养殖户采用换水或添加淡水的方式来刺激对虾蜕皮[1-2]。但是在盐度改变后,对虾渗透压变化情况和所需能量是如何提供等问题尚需进一步研究。
此前,水生甲壳动物的渗透调节机制一直是国内外学者研究的热点。众多学者在渗透调节器官的形态结构,离子转运酶和血淋巴渗透压调节以及神经内分泌调控等方面作了大量的研究工作[3-9],并取得了许多重要的研究成果,而有关甲壳动物渗透调节中能量代谢,特别是生物体的首要能源糖及其有关的代谢酶活力变化的研究则相对较少。
本文以我国主要的海水养殖虾类之一凡纳滨对虾(Litopenaeus vannamei)为实验材料,并根据之前关于盐度突变对对虾蜕皮影响的研究[10-13]选择4个不同的盐度突变水平,测定对虾血淋巴渗透压、血蓝蛋白、血糖及其糖酵解反应过程中的己糖激酶(Hexokinase,HK)和丙酮酸激酶(Pyruvate kinas,PK)活力的变化,以期为深入了解甲壳动物渗透调节过程中糖代谢的变化提供基础数据。
1 材料与方法
1.1 实验虾的来源与驯化
凡纳滨对虾购自青岛市郊养虾场,体长3~5 cm,为健康活泼的个体。
对虾运回实验室后,在室内(25±0.5)℃下驯养2周,使之适应实验室的条件。驯养期间每天于7:00和17:30定时投喂“海马牌”人工配合饲料2次,驯养期间的光照周期为L∶D=14∶10。实验前对虾饥饿24 h,并参照S.M.Chan等方法[14]将蜕皮间期的对虾挑出,备用。
1.2 实验设计
实验设盐度30为对照组(用C表示),4个不同的盐度波动幅度(分别为2、4、6、8)为处理组,分别用S2、S4、S6和S8表示(以S4组为例的盐度突变模式见图1),每个处理组设置5个水槽作为平行。每个处理组从驯化槽中选取100尾个体相近、体色透明、处于蜕皮间期的凡纳滨对虾,将其放入5个实验水槽(300cm×150cm×80cm)中进行实验。实验用水的初始盐度为30,分别在实验开始前(0h)、降低盐度后3、6、12、24、48、72和96h及恢复盐度至30后的3、6、12、24、48和72h取样。每个取样时间点取5尾对虾,每尾对虾作为1个样本,分别测定对虾血淋巴渗透压、血蓝蛋白、血糖及肝胰脏中己糖激酶活力和丙酮酸激酶活力。实验所需低盐度海水为盐度30的砂滤海水和经曝气的自来水按一定比例配制而成,实验期间连续充气,不投喂。
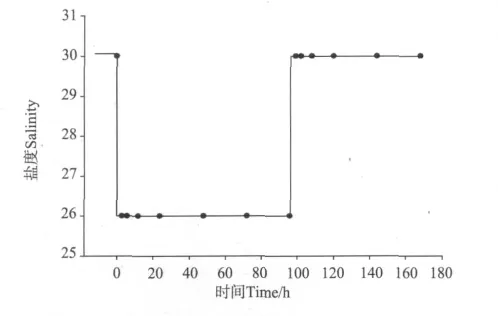
图1 盐度波动示意图(以S4组为例)Fig.1 Sketch map of salinity fluctuation(Taking S4 as an example)
1.3 样品的采集及测定
用吸水纸吸干对虾的体表水分,在冰盘上迅速抽取血淋巴,测定渗透压、血蓝蛋白。同时,取40μL血淋巴与40μL抗凝剂混匀放入冰箱冷藏;取对虾的肝胰脏,放至1.5 m L的离心管中,经液氮快速冷冻后,转入-80℃冰箱保存。
1.3.1 对虾血淋巴渗透压和血蓝蛋白含量的测定渗透压采用Model 210型冰点渗透压计(Micro-Osmometer)测定。血蓝蛋白的测定采用紫外吸收法[15]:将抽取的血淋巴稀释成1%的溶液,在UV分光光度计上,以334 nm波长比色。血蓝蛋白含量按Nickerson方法计算:
1.3.2 对虾血糖含量的测定 待血淋巴与抗凝剂1∶1混合液放入冰箱冷藏3 h后,放入低温离心机,4℃877×g/min离心15 min,取上清液,放入-20℃冰箱冷冻待测。血糖测定采用葡萄糖氧化酶法[16]。
1.3.3 对虾肝胰脏中己糖激酶活力和丙酮酸激酶活力的测定 取对虾的肝胰脏,剪碎,加入9倍体积的冰冷生理盐水(0.86%),制成10%匀浆,286×g/min离心10 min,取上清分装待测。用Folin-酚法测定样本蛋白质浓度[17]。己糖激酶活力采用了6-磷酸葡萄糖脱氢酶偶联比色法测定[18]。丙酮酸激酶活力采用Ireland等的方法测定[19],该酶活性以(μmol丙酮酸·mg-1蛋白质·min-1)表示。
1.4 数据处理与分析
所得数据用SPSS11.0软件进行单因子方差(ANOVA)及Duncan多重比较进行分析处理,以P<0.05作为差异显著水平。
2 实验结果
2.1 盐度突变对凡纳滨对虾血淋巴渗透压的影响
盐度突变对凡纳滨对虾血淋巴渗透压的影响见图2。从图2中可以看出,整个实验过程中,S2组对虾血淋巴渗透压与对照组没有显著性差异,S4组对虾血淋巴渗透压处于较低水平。在降低盐度后,S4组的血淋巴渗透压与对照组在12、24、48和96h处与对照组血淋巴渗透压有显著性差异(P<0.05),S6组对虾血淋巴渗透压与对照组血淋巴渗透压在72h处有显著性差异,S8组对虾血淋巴渗透压与对照组血淋巴渗透压在6、24和72h有显著性差异(P<0.05)。在盐度恢复至30后,仅S8组144h处血淋巴渗透压与对照组血淋巴渗透压有显著性差异(P<0.05)。
同时,S2、S4、S6组血淋巴渗透压还表现出随盐度降低而下降,随盐度升高而上升的趋势;而S8组在盐度降低后血淋巴渗透压却呈现出先上升后下降的趋势,当盐度恢复至30后血淋巴渗透压上升。
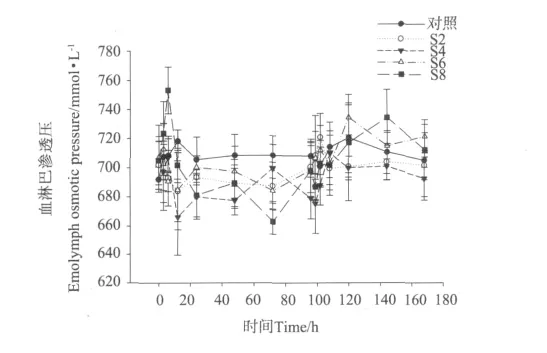
图2 不同盐度突变幅度下凡纳滨对虾的血淋巴渗透压变化Fig.2 Changes of hemolymph osmotic pressure in L.vannamei under different salinity fluctuation treatments
2.2 盐度突变对凡纳滨对虾血蓝蛋白含量的影响
盐度突变对凡纳滨对虾血蓝蛋白含量的影响见图3。从图3中可以看出,盐度降低过程中,S2组对虾血蓝蛋白含量与对照组没有显著性差异,S4、S6和S8组对虾血蓝蛋白含量与对照组血蓝蛋白含量呈现显著性差异的点依次增多。当盐度恢复至30后,各处理组对虾血蓝蛋白含量与对照组呈现显著性差异点也依次增多,且S4组对虾血蓝蛋白含量低于其他各处理组。

图3 不同盐度突变幅度下凡纳滨对虾血蓝蛋白含量的变化Fig.3 Changes of the hemocyanins contents in L.vannamei under different salinity fluctuation treatments
2.3 盐度突变对凡纳滨对虾血糖含量的影响
盐度突变对凡纳滨对虾血糖含量的影响见图4。从图4中可以看出,在盐度降低过程中,S2和S4组对虾血糖含量与对照组没有显著性差异,但表现出血糖含量先降低后上升再趋于平稳的趋势,而S6和S8组对虾血糖含量在降低盐度3 h处出现了急剧的上升,此时S8组对虾血糖含量是实验开始时的2.6倍;在盐度恢复至30后,S2、S6和S8组对虾血糖含量与对照组有显著性差异,而S4组对虾血糖含量与对照组没有显著性差异。整个实验过程中,S4组对虾血糖含量较其他处理组整体处于较低水平,而S6、S8组对虾血糖含量则维持在一个较高水平。

图4 不同盐度突变幅度下凡纳滨对虾血糖含量的变化Fig.4 Changes of the blood glucose contents in L.vannamei under different salinity fluctuation treatments
2.4 盐度突变对凡纳滨对虾肝胰脏中己糖激酶(HK)活力的影响
盐度突变对凡纳滨对虾肝胰脏中己糖激酶(HK)活力的影响见图5。从图5中可以看出,在降低盐度12 h内,各处理组对虾己糖激酶(HK)活力与对照组相比有显著性差异(P<0.05),且HK活力略低于对照组,但12 h后处理组HK活力逐渐上升,并在出现一个峰值后趋于平稳;在盐度恢复至自然海水盐度后,各处理组对虾己糖激酶(HK)活力在盐度升高24 h内均有上升趋势,盐度升高后24h时,S2、S6和S8组对虾己糖激酶活力与对照组有显著性差异。整个实验过程中,S4组对虾肝胰脏中己糖激酶(HK)活力整体处于较低的水平,而S2、S6组与S8组对虾肝胰脏中HK活力处于较高水平。
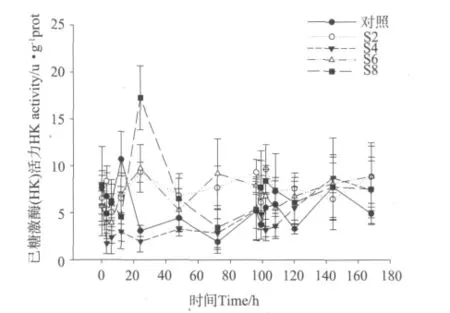
图5 不同盐度突变幅度下凡纳滨对虾肝胰脏中己糖激酶(HK)活力的变化Fig.5 Changes of HK activity in hepatopancreas of L.vannamei under different salinity fluctuation treatments
2.5 盐度突变对凡纳滨对虾肝胰脏中丙酮酸激酶(PK)活力的影响
盐度突变对凡纳滨对虾肝胰脏中丙酮酸激酶(PK)活力的影响见图6。从图6中可以看出,S2、S4组对虾肝胰脏中丙酮酸激酶(PK)活力与对照组没有显著性差异,而S6和S8组对虾肝胰脏PK活力在盐度突变后(特别是盐度降低后)与对照组肝胰脏PK活力表现出显著性差异(P<0.05),且盐度突变后,S6和S8组对虾丙酮酸激酶活力均呈现先升高后下降的趋势,直到盐度突变48h后趋于稳定。

图6 不同盐度突变幅度下凡纳滨对虾肝胰脏中丙酮酸激酶(PK)活力的影响变化Fig.6 Changes of PK activity in hepatopancreas of L.vannamei under different salinity fluctuation treatments
3 讨论
3.1 凡纳滨对虾血淋巴渗透压在盐度突变过程中的变化
在盐度变化的环境中,甲壳动物会主动调节血淋巴中无机离子以及其它渗透压效应物含量,来维持渗透平衡[20]。研究已发现,中国明对虾(Fenneropenaeus chinensis)从盐度15突变至7时,血淋巴渗透压下降后6h趋于稳定,但与起始相比显著降低[21];龙虾(Homarus gammarus)从盐度为30的水环境中移到盐度为20的水环境后,其渗透压突降至544 mOsm/L,趋于稳定后略提高了154 m Osm/L,但也明显低于起始的渗透压[22]。Marsupenaeus japonicus从盐度为30的海水中分别移至盐度为20和25海水中后,其渗透压明显降低,而移至盐度为35海水中后其渗透压上升[23]。本实验在降低盐度后,S2、S4和S6组对虾渗透压同样出现了下降趋势;S8组对虾除12h处出现一个高峰外其他时间的渗透压持续下降,并在实验的72h降至所有处理组的最低点663 mmol/L。各处理组在盐度恢复至30后,对虾渗透压迅速升高。这说明在盐度波动时,对虾能主动调节渗透压使其适应变化的环境,这与上述学者的观点一致。S8组对虾渗透压在盐度降低后先上升后下降的现象,可能因为盐度突变幅度过大,对虾由于受到强烈的应激反应,表现出渗透压增大,而当对虾适应低盐环境后,其渗透压又下降。
3.2 凡纳滨对虾血蓝蛋白含量在盐度突变过程中的变化
血蓝蛋白是甲壳动物运载氧气的载体。但除了运输氧气外,血蓝蛋白还与渗透调节、能量储存和能量代谢等有关。Paul等认为甲壳动物血蓝蛋白在不同盐度下的合成代谢变化与其渗透调节过程密切相关,在高盐度下血蓝蛋白可降解为游离氨基酸,维持血淋巴渗透压平衡[24]。Huong等也发现随着外界盐度升高,甲壳动物的血淋巴蛋白减少,游离氨基酸含量增加[5]。此外,血蓝蛋白是甲壳动物体内巨大的蛋白质储存库。有报道表明,对虾将体内富余蛋白质以血蓝蛋白形式储存,是甲壳动物储存蛋白能量的有效途径之一,甲壳动物血蓝蛋白约占血淋巴总蛋白的90%以上[25-28]。Dall and Smith报道改变盐度时,血蓝蛋白可用来作为渗透压受动器,同时也可以做为能量代谢使用[29]。Hagerman研究发现血蓝蛋白是饥饿状态下甲壳动物蛋白的提供者[30]。Carlos发现血淋巴中的蛋白质在食物中缺乏糖类时就开始为新陈代谢提供能量[31]。Rosas等报道凡纳滨对虾在低盐度的血氨水平高于高盐度组,这与蛋白代谢有一定的联系,可能是机体为了维持渗透压而消耗体内的游离氨基酸作为能源,然后以氨的形式排泄出去[28]。
本实验中,盐度降低过程中,S2组对虾血蓝蛋白含量与对照组没有显著性差异,S4、S6和S8组对虾血蓝蛋白含量与对照组血蓝蛋白含量呈现显著性差异的点依次增多;当盐度恢复至30后,各处理组对虾血蓝蛋白含量与对照组呈现显著性差异点也依次增多。这说明随着盐度突变幅度的增加,对虾在渗透调节过程中血蓝蛋白起到的作用在逐渐增加。
在盐度降低的过程中,S4、S6和S8组对虾血蓝蛋白含量呈现出先上升后下降的趋势,这可能是因为盐度降低后,对虾不再需要分解过多的蛋白质形成游离氨基酸来维持渗透压,使血淋巴中的蛋白含量升高,随着对虾对环境的适应和为了提供渗透调节所需的能量,启动糖异生机制,降解以血蓝蛋白形式储存在血液中的蛋白质补充血糖的不足,血蓝蛋白含量开始下降并随着对虾对环境的适应趋于稳定;当盐度恢复至30后,S4和S6组对虾血蓝蛋白含量呈现下降趋势,除了转化成糖类外还可能与高盐度下血蓝蛋白降解为游离氨基酸,维持血淋巴渗透压平衡有关。
3.3 凡纳滨对虾糖酵解作用在盐度突变过程中的变化
糖类是生物体内的重要能源物质。在盐度突变过程中,对虾的应激反应引起能量消耗骤增,使糖类代谢增强,血糖浓度降低,且常伴随着供氧不足,进而使糖酵解作用增强。而己糖激酶(HK)和丙酮酸激酶(PK)是糖酵解反应过程中的2种关键酶,其活性的变化对维持机体血糖水平以及糖酵解速率具有重要作用。己糖激酶是肝脏中调节血糖浓度的关键酶,它可以和细胞膜上葡萄糖转运蛋白功能相互偶联,对机体细胞内葡萄糖流量和代谢产生一定的影响[32-33]。丙酮酸激酶可调节细胞中ATP、ADP和糖酵解的中间产物,对糖酵解速率的控制起关键作用,该酶活性的增加表明糖酵解活动增加,补充机体所需能量[33-34]。因此,研究血糖含量、己糖激酶活力和丙酮酸激酶活力在盐度突变后的变化情况对进一步了解对虾渗透调节过程中糖代谢变化情况有重要意义。
本实验中,S2和S4组对虾血糖含量在盐度突变后与对照组没有显著性差异,但表现出血糖含量先降低之后趋于平稳的趋势。这与杨宇晴等在斜带石斑鱼Epinephelus coioides和Imsland等在大西洋比目鱼Hippoglossus hippoglossus L.中发现的盐度突变导致鱼体血糖呈下降趋势的结果相似[35-36]。这是因为盐度改变,耗能增加,糖酵解作用增强,使血淋巴中的葡萄糖含量下降,当血糖含量降低到一定程度后启动糖再生作用,使血糖浓度升高,随着对虾对环境的适应、能量消耗的减少,血糖含量趋于稳定;而S6和S8组对虾血糖含量在短时间内(3 h)急剧上升,可能与盐度波动较大,对虾过早的启动糖异生作用,未能捕捉到血糖下降的过程有关,同时也说明凡纳滨对虾在应激反应等耗能骤增的过程中,增加糖代谢是保证能量供应的一个重要途径。
动物在适应环境因子的突变中会产生应激反应,消耗大量能量,耗氧率上升,机体内往往会出现供氧不足的情况,这就使糖酵解作用在糖代谢中所占比例增加。而己糖激酶和丙酮酸激酶是糖酵解过程中重要的关键酶,在动物适应环境变化时也会随糖酵解作用的增强而发生变化。郭彪等发现温度突变会使凡纳滨对虾己糖激酶活力短时间内升高,随着对虾适应环境己糖激酶活力又逐渐下降[37]。Gabriela等发现蜕皮间期的凡纳滨对虾在低盐环境下比高盐环境下己糖激酶活力高[38]。
本实验中,对虾肝胰脏中己糖激酶活力与血糖含量变化情况相似,整个实验过程中S4组血糖含量和肝胰脏己糖激酶活力处于较低水平,而S6和S8组对虾血糖含量和肝胰脏己糖激酶活力处于较高水平。这说明S4组对虾在渗透调节过程中糖代谢作用较低,而S6和S8组对虾糖代谢作用较高。这可能是因为S4组对虾所处的海水盐度为26与凡纳滨对虾的等渗点非常接近,因此渗透调节耗能较少;而S6和S8组对虾则要消耗大量能量来进行渗透调节。血糖含量和己糖激酶含量变化相似,则主要是因为己糖激酶是肝脏中调节血糖浓度的关键酶。这与以前学者的研究结果一致。
同时,在本实验中,对虾干胰脏丙酮酸激酶活力变化情况要滞后于血糖含量变化,如:在S6和S8组降盐后3 h血糖含量最高,而丙酮酸激酶活力比较低,直到降低盐度6 h时,血糖含量开始下降,丙酮酸激酶活力却达到一个高峰。这种滞后现象则表明在对虾进行渗透调节过程中,在降盐后3 h处增加的血糖有很大一部分是通过增加糖酵解作用而进行代谢的,即增加糖酵解作用是保障渗透调节所需能源的重要途径。
总之,在盐度的发生突变后,甲壳动物进行渗透调节时会消耗大量的能量。这些能量可能是由消耗血糖和储存在血液中的蛋白来提供,本研究发现凡纳滨对虾在渗透调节过程中血糖和糖酵解过程中己糖激酶活力和丙酮酸激酶活力都有显著变化,说明增加糖酵解作用是保证渗透调节所需能量的重要途径。但要弄清甲壳动物在渗透调节过程中整个能量代谢变化的详细情况,还需要人们对糖类的有氧代谢和蛋白质代谢作进一步系统研究。
[1] 胡钦贤,陆建生.中国对虾生长与环境因子关系的初步探讨[J].东海海洋,1990,8(2):58-62.
[2] 黄加祺,林琼武.影响日本对虾亲虾蜕壳因素的探讨[J].海洋科学,2003,27(2):30-31.
[3] Lin S C,Liou C H,Cheng J H.The role of the antennal glands in ion and body volume regulation of cannulater Penaeus monodon reared in various salinity conditions[J].Comp Biochem Physiol,2000,127(2):121-129.
[4] Castiho P C,Martins I A,Bianchinin A.Gill Na+,K+ATP ase and osmoregulation in the estuarine crab,Chasmagnathus granulata Dana,1851(Decapoda,Grapsidae)[J].J Exp Mar Biol Ecol,2001,256:215-227.
[5] Huong D T T,Yang W J,Okuno A,et al.Changes in free amino acids in the hemolyph of giant freshwater prawn Macrobrachium rosenbergii exposed to varying salinities:relationship to osmoregulatory ability[J].Comp Biochem Physiol,2001,128(2):317-326.
[6] Wilder M N,Ikuta K,Atmomarsono M,et al.Changes in osmotic and ionic concentrations in the hemolymph of Macrobrachium rosenbergii exposed to varing salinities and correlation to ionic and crystalline composition of the cuticle[J].Comp Biochem Physiol,1998,119(4):941-950.
[7] Freire C A,Mc Namara J C,Rosa J C,et al.Neuroendocrine control of osmotic regulation in the freshwater shrimp Macrobrachium olfersii(Wiegmann)(Crustacea,Decapoda);Free amino acid concentrations in the hemolymph[J].Gen Comp Endocrinology,1995,100:83-91.
[8] Morris S.Neuroendocrine regulation of osmoregulation and the evolution of air2breathing in decapod crustaceans[J].J Exp Bio,2001,204(5):979-989.
[9] 金彩霞,潘鲁青.盐度变化对克氏原螯虾渗透调节影响机制的初步研究[J].水生生物学报,2008,32(6):894-999.
[10] 穆迎春,王芳,董双林,等.不同盐度波动幅度对中国明对虾稚虾蜕皮和生长的影响[J].海洋学报,2005,27(2):122-126.
[11] 丁森,王芳,郭彪,等.盐度波动对中国对虾稚虾蜕皮、生长和能量收支的影响[J].应用生态学报,2008,19(22):419-423.
[12] 丁森,王芳,郭彪,等.盐度波动频率对中国明对虾稚虾蜕皮、生长和能量收支的影响[J].中国海洋大学学报:自然科学版,2008,38(4):579-584.
[13] 李英,王芳,董双林,孙皓.盐度突变对凡纳滨对虾稚虾蜕皮和呼吸代谢的影响[J].中国海洋大学学报:自然科学版,2010,40(7):47-52.
[14] Chan S M,Rankin S M,Keeley L L.Characterization of the Molt Stages in Penaeus vannamei:setogenesis and hemolymph levels of total protein,ecdysteroids,and glucose[J].The Biological Bulletin,1988,175:185-192.
[15] Nickerson K W,K E Van Holde.A comparison of moluscan and arthropod haernocyanin.I.Circular dichromism and absorption spectra[J].Comp Biochem Physiol,1971,39(4):855-872.
[16] 李萍.生物化学检验学[M].北京:人民卫生出版社,1998:62-98.
[17] Lowry O H,Roscbrough N J,Farr A,et a1.Protein measurement with the folin phenol reagent[J].J Biol Chem,195l,193:265-275.
[18] Braithwaite S S,Palazuk J R,Colca C W,et a1.Reduced expression of hexokinase.II in insulin—resistant diabetes[J].Diabetes,1995,44:43-48.
[19] 左斌,邱德文,罗宽.植物激活蛋白对水稻秧苗生长及相关酶活性的影响[J].科学技术与工程,2005,5(17):1260-1262.
[20] 潘鲁青,刘泓宇.甲壳动物渗透调节生理学研究进展[J].水生生物学报,2005,29(1):109-114.
[21] 房文红,王慧,来琦芳,等.不同盐度对中国对虾血淋巴渗透浓度和离子浓度的影响[J].上海水产大学学报,1995,4(2):122-127.
[23] Agung S,Carlos A S,Fumio T,et a1.Short-term responses of adult kuruma shrimp Marsupenaeus japonicus(Bate)to environmental salinity:osmotic regulation,oxygen consumption and ammonia excretion[J].Aquaculture Research,2004,35:669-677.
[24] Paul R,Pirow R.The physiological significance of respiratory proteins in invertebrates[J].Zoology,1998,100:319-327.
[25] Djangmah J S.The effect of feeding and starvation on copper in the blood and hepatopancreas,and on blood protein of Crangon vulgaris(Fabricius)[J].Comp Biochem Physiol,1970,32:709-731.
[26] Pascual C,S nchez A,Zenteno E,et a1.Biochemical,physiological,and immunological changes during starvation in juveniles of Litopenaeus vannamei[J].Aquaculture,2006,251:416-429.
[27] Pascual C,Gaxiola G,Rosas C.Blood metabolites and hemocyanin of the white shrimp,Litopenaeus vannamei:the effect of culture condition and a comparison with other crustacean species[J].Marine Biology,2003,142:735-745.
[28] Rosas C,Cuzon G,Gaxiola G,et a1.An energetic and conceptual model of the physiological role of dietary carbohydrates and salinity on Litopenaeus vannamei juveniles[J].Journal of Experimental Marine Biology and Ecology,2002,268:47-67.
[29] Dall W,Smith D M.Oxygen consumption and ammonia-Nexcre-tion in fed and starved tiger prawns Penaeus esculentus Haswell[J].Aquaculture,1986,55:23-33.
[30] Hagerman L.Haemocyanin concentration in the shrimp,Crangon crangon(L.)after exposure to moderate hypoxia[J].Comp Biochem Physiol,1986,85(4):721-724.
[31] Carlos R,Gerard C,Gabriela G,et al.Metabolism and growth of juveniles of Litopenaeus vannamei:effect of salinity and dietary carbohydrate levels[J].Journal of Experimental Marine Biology and Ecology,2001,259:1-22.
[32] 汪玉松,邹思湘,张玉静.现代动物生物化学[M].第三版.北京:高等教育出版社,2005:466-490.
[33] 王广宇,刘波,谢骏,等.鱼类糖代谢几种关键酶的研究进展[J].上海水产大学学报,2008,17(3):377-383.
[34] Allert S,Ernest I,Poliszcak A,et a1.Molecular cloning and analysis of two tandemly linked genes for pyruvate kinase of Trypanosoma brucei[J].Eur J Biochem,1991,200:19-27.
[35] 杨宇晴,余德光,谢骏,等.急性盐度胁迫对斜带石斑鱼Na+/K+-ATP酶及血清应激指标的影响[J].热带海洋学报,2010,29(4):160-164.
[36] Imsland A K,Gustavsson A,Gunnarsson S,et al.Effects of reduced salin ities on growth,feed conversion efficiency and blood physiology of juvenile Atlantic halibut(Hippoglossus hippoglossus L.)[J].Aquaculture,2008,274:254-259.
[37] 郭彪,王芳,侯纯强,等.温度突变对凡纳滨对虾己糖激酶和丙酮酸激酶活力以及热休克蛋白表达的影响[J].中国水产科学,2008,15(5):885-889.
[38] Gabriela G,Gerard C,Tomás G,et al.Factorial effects of salinity,dietary carbohydrate and moult cycle on digestive carbohydrases and hexokinases in Litopenaeus vannamei(Boone,1931)[J].Comparative Biochemistry and Physiology,2005,140(1):29-39.
Effects of Salinity Fluctuations on Hemocyanins and Glycolysis of Litopenaeus vannamei
LI Ying1,2,WANG Fang1,ZHAO Zhuo-Ying3,DONG Shuang-Lin1
(1.Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao 266003,China;2.Aquatic Product Technology Promotion Department of Beijing,Beijing 100021,China;3.National Center of Ocean Standard and Metrology,Tianjin 300112,China)
Effects of salinity fluctuations on hemolymph osmotic pressure,hemocyanins,blood glucose and the activities of HK and PK of Litopenaeus vannamei with initial wet body weight of 2.485±0.303g were investigated in this study.There were four different salinity fluctuation models:S2,S4,S6 and S8,where 2,4,6 and 8 are decreasing range of salinity from 30(control).Samples were taken at different time points.This study lasted for 7 days.The main results were as follows:(1)Hemolymph osmotic pressure varied with salinity change,and the level of hemocyanins and blood glucose in S4 group were lower than the other groups.(2)With the increase of salinity mutation rate,the sampling points increased,which hemocyanin content of the treated groups with the control group showed significant difference(P<0.05).(3)The blood glucose contents in S4 maintained at low level during the whole experiment.While the level of group S6 and S8 were relatively high.(4)The trend of HK activity in hepatopancreas was similar to that of blood glucose contents.(5)There was no significant difference in PK activity of hepatopancreas among group S2,S4 and the control.But PK activity of group S6 and S8 were higher than that of the control,and the difference was significant(P<0.05).
Litopenaeus vannamei;salinity;hemocyanins;blood glucose;glycolysis
S964.3
A
1672-5174(2012)09-028-07
国家重点基础研究发展计划项目(2009CB118706);国家科技支撑计划项目(2011BAD13B03)资助
2011-05-13;
2012-03-15
李 英(1984-),男,硕士。E-mail:Liy.1210@yahoo.com.cn
**通讯作者:E-mail:wangfang249@ouc.edu.cn
责任编辑 朱宝象
