高氯酸体系中肼为还原剂催化还原U(Ⅵ)的反应动力学
2012-01-04张秋月丁伯发唐洪彬
李 斌,何 辉,张秋月,丁伯发,王 亮,唐洪彬
中国原子能科学研究院 放射化学研究所,北京 102413
Purex流程是目前乏燃料后处理厂广泛采用的工艺流程。正在运行的大型商用后处理厂中,铀钚共去污分离循环主要采用U(Ⅳ)作还原剂将有机相(1AP)中的Pu(Ⅳ)还原为不易被萃取的Pu(Ⅲ)进入水相,而U(Ⅵ)仍保留在有机相中,从而实现U与Pu的分离[1]。U(Ⅳ)作为还原剂、肼为支持还原剂具有反应速度快、分离效果好且不会向系统引入杂质离子等优点。以肼为还原剂,在铂(Pt)、钯(Pd)等贵金属的催化作用下能够将U(Ⅵ)还原为U(Ⅳ),此反应能够在常温常压等温和条件下进行,且转化率很高,是一种非常有前景的U(Ⅳ)制备方法。目前关于该方法的文献报道比较少。仅俄罗斯在酸性溶液中以Pt/SiO2为催化剂,用肼还原U(Ⅵ)来制备U(Ⅳ),主要考察了负载金属粒子的粒径对还原反应速率的影响[2]。他们还用Pd/SiO2作催化剂进行肼与U(Ⅵ)的反应,发现硝酸体系中此反应不能进行,而硫酸和高氯酸体系中反应能进行[3]。
本工作拟以铂黑为催化剂,研究高氯酸体系中肼还原U(Ⅵ)的反应动力学,考察铀浓度、酸度、肼浓度、固液比以及温度等因素对催化反应速率的影响。
1 实验部分
1.1 试剂和仪器
UO2(ClO4)2,实验室自制;水合肼(80%),化学纯,西陇化工股份有限公司;铂黑,w>99.9%,安耐吉化学;高氯酸,分析纯,上海金鹿化工有限公司;TiCl3溶液、对二甲氨基苯甲醛,分析纯,国药集团化学试剂有限公司;二苯胺磺酸钠,分析纯,天津福晨化学试剂厂;重铬酸钾标准溶液,北京化学试剂公司;硫酸,分析纯,北京化工厂。
WFC-UV2100型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;HX-1050型恒温循环器,北京博医康实验仪器有限公司。
1.2 实验与分析方法
将一定浓度的UO2(ClO4)2溶液和高氯酸酸化的N2H5ClO4溶液定量加入到25 mL容量瓶中,再加入适量的HClO4溶液调整体系酸度,最后用0.01 mol/L的稀高氯酸溶液定容。将配好的溶液加入到带水浴夹套的玻璃反应容器中,维持反应温度为恒定值,电磁搅拌条件下(所有实验都保持同一固定的搅拌速度,约500 r/min,此时溶液扩散的影响可以忽略)加入一定量的Pt黑催化剂,反应开始同时计时,考察反应生成的U(Ⅳ)浓度随时间的变化。
初始U(Ⅵ)浓度的分析采用TiCl3还原-重铬酸钾滴定法[4]。
反应过程中U(Ⅳ)浓度的测定采用直接分光光度法,将样品用H2SO4溶液稀释后在650 nm波长处测定吸光度,依据标准曲线计算U(Ⅳ)浓度。
肼浓度的测定采用分光光度法,将样品稀释后加入对二甲氨基苯甲醛显色剂,在458 nm波长处测定吸光度,依据标准曲线计算肼浓度[5]。
高氯酸浓度的测定:采用草酸铵络合-定pH滴定法测定。
1.3 动力学处理方法
铂催化肼还原U(Ⅵ)的总化学反应式为:
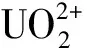
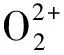
(1)
式中k为反应速率常数。
两边取对数:
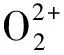
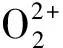
(2)
多次实验发现,催化剂刚加入反应容器时反应很不稳定,在t=0时dc0(U4+)/dt无法准确获得。考虑到反应开始阶段(5 min内)U(Ⅳ)的生成量不大,反应物的消耗量相对于其初始浓度也很小,可近似认为不变。在此时间范围内取一个反应已趋于稳定的时刻t(t=3 min时满足要求),用此时的反应速率来代替dc0(U4+)/dt进行数据处理,误差不大。
2 结果与讨论
2.1 U(Ⅵ)浓度对反应速率的影响



图2 关系曲线
2.2 肼浓度对反应速率的影响


图3 不同初始N2H4浓度下四价铀浓度与反应时间t的关系
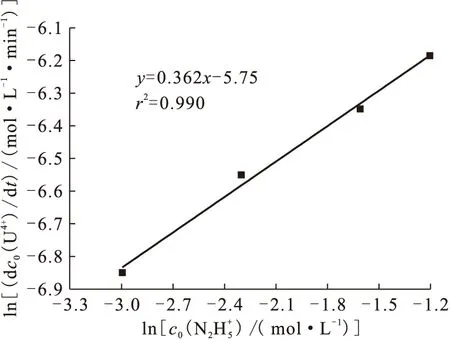
图4 关系曲线
2.3 HClO4浓度对反应速率的影响
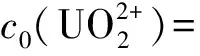

图5 不同酸度下四价铀浓度与反应时间t的关系
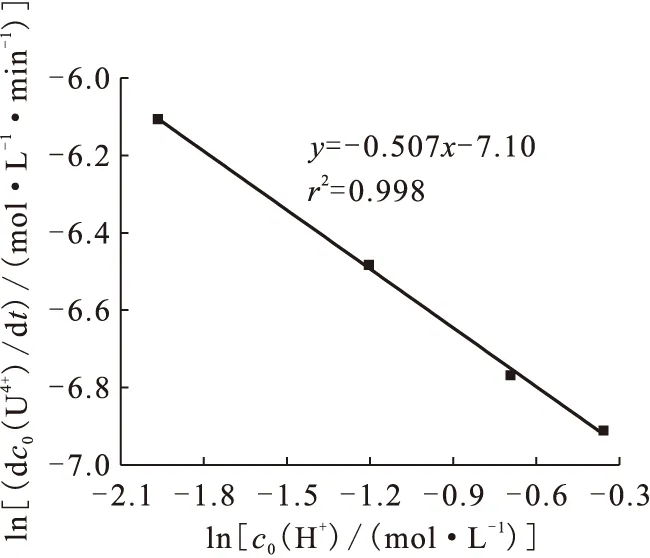
图6 ln(dc0(U4+)/dt)-ln c0(H+)关系曲线
综上所述,铂催化肼还原制备U(Ⅳ)的初始表观动力学速率方程可表示为:
温度θ=60 ℃、固液比为0.002 kg/L时,速率常数k=3.2×10-3(mol/L)0.76/min。
2.4 催化剂用量对反应速率的影响
图7为不同固液比条件下四价铀浓度与反应时间t的关系。如图7所示,随着反应体系中催化剂用量的增加(固液比rS/L增大),U(Ⅳ)的生成速率增加。以ln(dc0(U4+)/dt)对相应的lnrS/L作图,得到直线斜率为1.01(图8),即反应速率与催化剂用量成正比关系,也可理解为反应对催化剂活性中心的浓度的表观反应级数为1。通过比较反应级数可知,相对于初始铀浓度和肼浓度对体系反应速率的影响,催化剂的用量影响更大,说明肼在催化剂活性位的吸附步骤是慢步骤,对整个反应速率的影响最大。

图7 不同固液比条件下四价铀浓度与反应时间t的关系
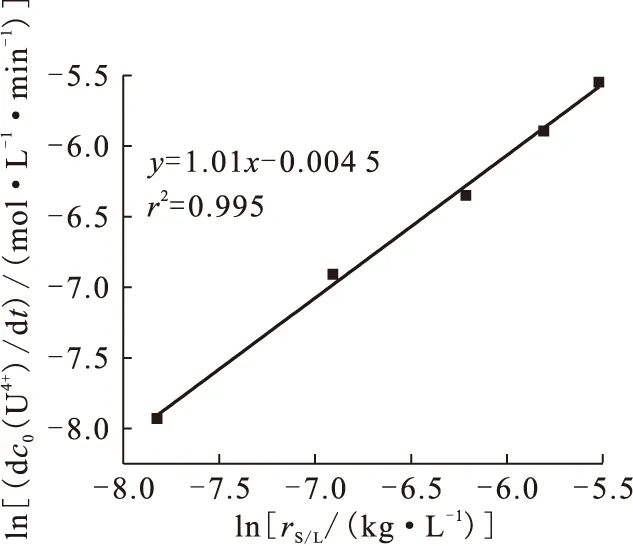
图8 ln(dc0(U4+)/dt)-ln rS/L 关系曲线
2.5 温度对反应速率的影响
实验中维持其它反应条件不变,改变反应体系的温度,在20~75 ℃范围内研究反应温度对反应的影响,结果示于图9。图9表明:随着反应体系温度的升高,反应速率加快。在整个温度范围内,lnk-T-1之间的关系并不是一条直线,这是异相催化反应的一种典型现象,随着反应体系温度的升高,反应过程由动力学控制转变为扩散控制过程[6]。根据Arrhenius方程,分别求得扩散控制过程反应的活化能为7.8 kJ/mol,动力学控制过程的活化能为30.1 kJ/mol。
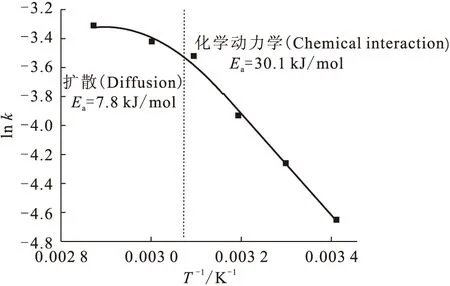
图9 ln k-T-1关系曲线
3 反应机理探讨
通过以上反应动力学数据分析以及实验过程中的产物分析,可以对高氯酸体系下铂催化肼还原U(Ⅵ)的反应机理进行初步推测,此反应属于典型的非均相催化反应,具体的反应历程可能如下:
(3)
(4)

(5)
(6)
(7)

(8)
(9)
反应发生于固体催化剂的表面,首先H+和肼竞争吸附到催化剂的表面(式(3)、(4)),在催化剂活性点一定的情况下,增加肼浓度或者减少酸度更利于肼的吸附,从而可以加速反应,动力学方程中酸的级数为负而肼的级数为正可以证明;肼在催化剂作用下分解(式(5))[7],此步骤是整个反应的控制步骤;反应(6)、(7)的反应速率非常快,否则NH2·或者NH·会进一步分解生成H·,进而生成H2,而在产物中没有检测到H2。反应过程中,肼不但作为还原剂还原U(Ⅵ),还发生自身的氧化还原反应(式(10)—(12)),二者是平行反应,反应过程中提高初始铀浓度,U(Ⅳ)的生成速率加快,即铀酰根离子的反应级数为正。
(10)
(11)
(12)
4 结 论
(1)本实验条件下,高氯酸体系中铂催化肼还原U(Ⅵ)的反应动力学方程为:
在温度60 ℃、固液比rS/L=0.002 kg/L时,速率常数k=3.2×10-3(mol/L)0.76/min。
(2)在20~75 ℃范围内,随着温度升高,反应速率加快,反应过程由动力学控制转变为扩散控制过程。动力学控制过程的活化能为30.1 kJ/mol,扩散控制过程反应的活化能为7.8 kJ/mol。
(3)根据动力学实验数据及实验过程中的产物分析,推测了高氯酸体系下铂催化肼还原U(Ⅵ)的反应机理,认为此过程是典型的异相催化反应,肼在催化剂表面的吸附分解是整个反应的控制步骤。
[1]任凤仪,周镇兴.国外核燃料后处理[M].北京:原子能出版社,2006.
[2]Boltoeva M Yu,Shilov V P,Anan’ev A V.Reactivity of Platinum Nanoaggregates in Catalytic Reduction of U(Ⅵ)With Hydrazine in Acid Solutions[J].Radiochem,2007,49(6): 603-606.
[3]Boltoeva M Yu,Trefilova A V,Anan’ev A V.Catalytic Reduction of U(Ⅵ)With Hydrazine on Palladium Catalysts in Acid Solutions[J].Radiochem,2008,50(1): 38-45.
[4]董灵英.铀的分析化学[M].北京:原子能出版社,1982:118-122.
[5]孙宏,姜维功,杨清平,等.对二甲氨基苯甲醛分光光度法测定水中肼[J].环境科学,1995,16(1):74-77.
[6]吴越.应用催化基础[M].北京:化学工业出版社,2008:135-139.
[7]Ananiev A V,Broudic J-C,Brossard Ph.The Platinum Catalyzed Hydrazine Decomposition in Non-Nitrate Acidic Media[J].Appl Catal A: General,2003,242: 1-10.
