弱后酸化保加利亚乳杆菌突变菌株的遗传稳定性研究
2012-01-04刘飞焦月华郭文奎于微谷春涛高学军
刘飞,焦月华,郭文奎,于微,谷春涛,高学军
(1.东北农业大学,乳品科学教育部重点实验室,食品科学与工程博士后流动站,哈尔滨 150030;2.丹尼斯克(中国)有限公司博士后科研工作站,昆山 江苏 215300;3.黑龙江省中医药大学,药物安全性评价中心,哈尔滨 150040)
弱后酸化保加利亚乳杆菌突变菌株的遗传稳定性研究
刘飞1,2,焦月华3,郭文奎1,于微1,谷春涛1,高学军1
(1.东北农业大学,乳品科学教育部重点实验室,食品科学与工程博士后流动站,哈尔滨 150030;2.丹尼斯克(中国)有限公司博士后科研工作站,昆山 江苏 215300;3.黑龙江省中医药大学,药物安全性评价中心,哈尔滨 150040)
对从传统乳制品中筛选得到的德氏乳杆菌保加利亚亚种自发突变株KLDS 1.9201-4的遗传稳定性进行研究。将突变菌株进行连续传代,观察形态学变化,利用HPLC分析葡萄糖和乳酸的代谢情况,RAPD分析基因组DNA的稳定性。结果表明,突变菌株KLDS 1.9201-4能够稳定遗传至第8代,在传代过程中菌落和菌体特征没有发生明显变化,KLDS 1.9201-4对初始葡萄糖的代谢率逐渐升高,终产物中乳酸的浓度也逐渐升高。KLDS 1.9201-4的基因组DNA相对稳定,没有发生明显变异。弱后酸化德氏乳杆菌保加利亚亚种的自发突变株KLDS 1.9201-4具有适宜的遗传稳定性,可被用于制作弱后酸化的酸奶发酵剂。
德氏乳杆菌保加利亚亚种;遗传稳定性;突变株;后酸化
0 引 言
酸奶作为一种具有益生作用的乳制品,已经普遍被消费者认可,但是由于酸奶正常发酵结束后,在产品贮存、运输、销售等过程会发生后酸化,使感官质量下降,影响酸奶的保质期[1]。德氏乳杆菌保加利亚亚种是导致酸奶发生后酸化的主要原因,它具有较强的耐酸性,当外界环境中pH值降低时,其质膜H+-ATPase能将细胞内的质子泵出胞外,形成跨膜pH梯度差,使胞内代谢酶活力不受影响。当环境中pH值达到3.5时,跨膜pH梯度差才不存在,新陈代谢活动受到抑制[2-3],然而,理想酸奶产品的pH值在4.2左右。因此,针对酸奶“后酸化”这一问题,本研究对通过诱变育种得到的H+-ATPase缺陷的德氏乳杆菌保加利亚亚种菌株的遗传稳定性进行研究[3],为最终开发弱后酸化酸奶发酵剂奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和培养基
①德氏乳杆菌保加利亚亚种 (Lactobacillus delbrueckii subsp.bulgaricus)KLDS 1.9201-4为本实验室保藏菌种。②培养基:MRS培养基[4],脱脂乳培养基。
1.1.2 主要试剂和仪器
葡萄糖和乳酸标样,rTaq和dNTP,其余试剂均为分析纯。低温冷冻离心机,PCR扩增仪9700,光学显微镜,紫外分光光度计DU-800,HPLC Waters 2695等。
1.2 菌株的传代培养
将实验室保存的KLDS 1.9201-4接入到MRS液体培养基中,在37℃培养,每24 h传代一次,均按照3%接种量接种。
1.3 菌株的形态学观察
在传代培养过程中,每次传代之前都观察菌株在液体培养基中的菌液状态,并利用光学显微镜观察菌体细胞的形态。
1.4 菌株的代谢分析
将KLDS 1.9201-4以3%(v/v)接种量接种于MRS broth中,在37℃下培养,每24 h传代一次,每次传代之前利用pH计测定发酵液的pH值、利用HPLC测定葡萄糖和乳酸的含量。
1.4.1 乳酸含量测定
色谱分离柱为Waters Park C18柱;检测器为UV214 nm。流动相A为浓度0.02 mol/L的NaH2PO4,流动相B为乙腈,A与B的比例是为9∶1;流速1 mL/min,进样量为10 μL。 取发酵液50 mL,以10 000 g,4℃下离心10 min,取上清液经0.22 μm滤膜过滤后经适当稀释进行色谱分析[3]。
1.4.2 葡萄糖含量测定
色谱分离条件:色谱柱为氨基柱;柱温为30℃;流动相为乙腈∶水=70∶30;流速为0.8 mL/min;进样体积为20 μL;检测器为折光。取发酵液50 mL,以10 000 g,4℃下离心10 min,取上清液经0.22 μm滤膜过滤后经适当稀释进行色谱分析[3]。
1.5 菌株的RAPD分析
1.5.1 基因组DNA的提取
采用天根基因组提取试剂盒提取KLDS 1.9201-4的基因组DNA,具体的操作方法按照试剂盒的说明书进行。分别提取KLDS 1.9201-4第1代和第8代的基因组DNA,取1 μL DNA样品,稀释200倍后,测定OD260和OD280。选取浓度1.8≤OD260/OD280≤2.0的样品。然后,将DNA质量浓度稀释至50 mg/L作为模板备用。
1.5.2 RAPD的引物和扩增条件
根据文献[5-6],从20种引物中筛选出多态性良好的适宜引物序列,其中引物1的序列为:5’GAGCGGC CAAAGGGAGCAGAC3’;引物2序列为:5’AACAGCTATGACCATG3’; 引物3序列为:5’CCGCAGCCAA3’。
PCR体系为25 μL: 灭菌ddH2O 15 μL,10×Buffer 2.5 μL,dNTP 2.5 μL,DNA模板2 μL,引物1 μL,MgCl21.5 μL,Taq酶0.4 μL。PCR扩增条件为:94℃变性5 min,40℃退火5 min,72℃延伸5min,4 cycles;94℃变性1 min,55℃退火1min,72℃延伸2 min,30 cycles;72℃10 min。
1.5.3 电泳和凝胶成像分析
将3种引物的扩增产物在1%琼脂糖凝胶中电泳,电压为100 V,电泳2 h后在紫外灯下观察并拍照记录结果,随后对DNA指纹图谱的变化情况进行比较分析。
1.6 统计分析
采用SPSS11.5软件对试验数据进行统计分析,其中每组试验有3个重复。
2 结果与分析
2.1 菌株的形态学变化
将突变菌株KLDS 1.9201-4进行了连续传代培养,当传至第9代时突变菌株又恢复了原来的产酸能力,因此传代试验在第10代就结束了。第1代和第8代的菌体形态分别如图1和图2所示。由图1和图2可以看出,在连续传代8次后,突变菌株的表型特征没有发生明显的变化。

2.2 菌株的生长代谢情况
将KLDS 1.9201-4进行连续传代,发酵液的pH值、葡萄糖和乳酸质量分数的变化结果分别如图3和图4所示。
由图3可以看出,在传代过程中随着传代次数的增加,突变菌株KLDS 1.9201-4发酵终点的pH值逐渐降低,一直传代到第8代时发酵终pH值仍然大于4.2,直到第9代时发酵终pH开始低于4.2,也就是说突变菌株可能发生了回复突变,不再具有弱后酸化能力。

由图4可以看出,在传代过程中随着传代次数的增加,发酵液中葡萄糖的质量浓度逐渐减少,也就是说突变菌株KLDS 1.9201-4对培养基中葡萄糖的代谢能力逐渐增强,产乳酸量也逐渐增加。当传代到第9代时,KLDS 1.9201-4对葡萄糖的代谢量显著增加,发酵液中的乳酸质量浓度也陡然增加,这表明突变菌株可能发生了回复突变,恢复了亲本菌株的产酸能力。
2.3 RAPD分析结果
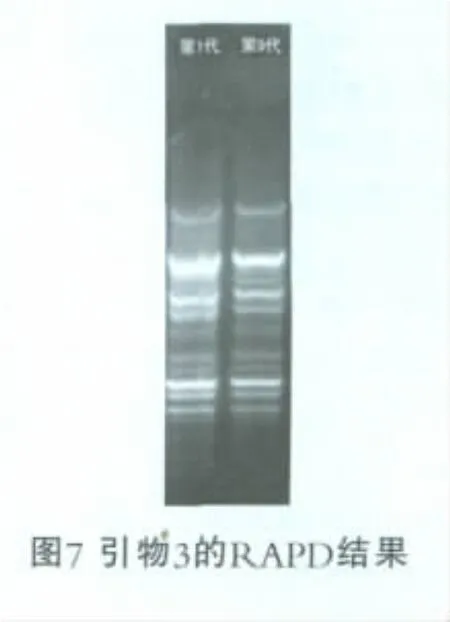
用筛选出的3种引物对传代不同次数的菌株进行RAPD分析,结果如图5~图7所示。

由图5~图7可以看出,在连续传代9次后,RAPD指纹图谱结果表明,利用引物1、2、3进行扩增时,突变菌株KLDS 1.9201-4的基因组DNA指纹图谱基本没有变化,随机扩增条带数相同且亮度接近,说明其基因组DNA具有高度的同源性,并没有随着菌株弱后酸化能力的丢失而发生变化。然而,突变菌株KLDS 1.9201-4的代谢情况分析表明,其在第9代时已经恢复了原来的产酸能力,这表明其可能发生了回复突变。虽然Fani等的研究表明,RAPD技术可作为评估菌株在环境中遗传稳定性的一种有效技术手段[7],但是本研究的结果表明RAPD技术可能并不适合用来评估所有细菌的遗传稳定性。
3 讨 论
细菌在经过多次连续传代培养之后容易发生退化现象[8],其遗传稳定性会发生变化,从而导致其相应的表型特征的改变,尤其是生理生化特性的改变,这样在工业生产过程中就可能引起发酵失败,造成巨大经济损失[9]。因此,一般的工程菌株都具有很好的遗传稳定性,这样才能实现在食品工业中的应用。然而,对直投式酸奶发酵剂来说,如果菌株的稳定性特别好,那么酸奶生产厂家就可通过单次购买直投式发酵剂而获得该菌株,从而能够自己生产酸奶发酵剂,不利于知识产权的保护,因此,直投式酸奶发酵剂必须具有适宜的遗传稳定性[10]。本研究中HPLC分析表明,突变菌株KLDS 1.9201-4从第9代开始就恢复了亲本菌株的产酸能力,也就是说它不再具有弱后酸化的能力。然而,RAPD分析的结果却表明KLDS 1.9201-4在第9代仍然能够稳定遗传,这可能是因为本研究中所采用的引物恰好不能扩增出基因组中发生回复突变的核苷酸序列,也可能是RAPD技术并不适用于评估突变菌株KLDS 1.9201-4的遗传稳定性。因此,如果要想确定突变菌株发生回复突变的核苷酸序列,那么就需要进一步对亲本和突变菌株进行全基因测序分析,目前,亲本和突变菌株的全基因组测序工作正在华大基因公司进行。综上所述,本研究中的具有弱后酸化能力的德氏乳杆菌保加利亚亚种KLDS 1.9201-4能够稳定遗传至第8代,这个特性不但对直投式发酵剂的生产没有任何不良影响,而且还非常有利于知识产权的保护,能够有效的避免菌株资源被窃取。因此,突变菌株KLDS 1.9201-4在传代过程中的遗传稳定性恰好能够被应用于制作弱后酸化酸奶发酵剂。
[1]徐成勇,吴昊,郑思聪,等.酸乳后酸化影响因子的初步研究[J].食品与发酵工业,2006,32(12):10-14.
[2]ROBERT W H,NANCY L N.pH Homeostasis in Lactic Acid Bac-teria[J].Journal of Dairy Science,1993,76(8):2354-2365.
[3]刘飞,杜鹏,王玉堂,等.保加利亚乳杆菌H+-ATPase缺陷型菌株的筛选[J].微生物学报,2009,49(1):23-29.
[4]凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:85-86.
[5]AKOPYANZ N,BUKANOV N O,WESTBLOM T U,et al.DNA Diversity among Clinical Isolates of Helicobacter Pylori Detected by PCR-based RAPD Fingerprinting[J].Nucleic Acids Research,1992,20:5137-5142.
[6]TORRIANI S,ZAPPAROLI G,DELLAGLIO F.Use of PCR-based methods for rapid differentiation of Lactobacillus delbrueckii subsp.bulgaricus and L.delbrueckii subsp.lactis[J].Appl Environ Microbiol,1999,65:4351–4356.
[7]FANI R,BANDI C,BANDON M G,et al.RAPD Fingerprinting is Useful for Identification of Azospirillum Strains[J].Microbial Releases,1993,1(4):217-221.
[8]何国庆.食品发酵与酿造工艺学[M].北京:中国农业出版社,2001.
[9]杜磊,袁超,杜杨.保藏过程中乳酸菌发酵菌种的选择[J].食品工业科技,2011,32(10):259-260.
[10]刘飞,杨丽杰,霍贵成.罗地亚9001直投型发酵剂发酵特性研究[J].中国乳品工业,2005,33(1):11-14.
Genetic stability of Lactobacillus delbrueckii subsp.Bulgaricus mutant stain with low post-acidification
LIU Fei1,2,JIAO Yue-hua3,GUO Wen-kui1,YU Wei1,GU Chun-tao1,GAO Xue-jun1
(1.Key laboratory of Dairy Science,Ministry of Education,Postdoctoral Research Station of Food Science and Engineering,Northeast Agricultural University,Harbin 150030,China,2.Danisco(China)Co.,Ltd.,Kunshan 215300,China,3.Center of Drug Safety Evaluation,Heilongjiang University of Chinese Medicine,Harbin 150040,China)
The genetic stability of a mutant with reduced membrane-bound H+-ATPase activity from L.delbrueckii subsp.bulgaricus originated from the traditional dairy product was studied to develop a yoghurt starter culture with low post-acidification capacity.The mutant was propagated in MRS broth continuously,the morphological trait of mutant was examined by microscope,the glucose and lactic acid content of supernatant of fermented broth was determined by HPLC,and the genome DNA stability was analyzed by RAPD.The result showed that the low post-acidification capacity of mutant strain was still stable while being propagated in MRS broth continuously after eight generation.During this period,the morphological trait of mutant cell didn’t change,the glucose content fermented by KLDS 1.9201-4 and the content of lactic acid of fermented broth increased gradually.Furthermore,the RAPD results showed that the genome DNA of KLDS 1.9201-4 was stable all the time.Thus the L.delbrueckii subsp.bulgaricus mutant KLDS 1.9201-4 with reduced membrane-bound H+-ATPase activity had adequate genetic stability,which could be applied to develop yoghurt starter culture with lower post-acidification.
Lactobacillus delbrueckii subsp.bulgaricus;genetic stability;mutant;post-acidification
Q935
A
1001-2230(2012)09-0011-04
2012-02-08
黑龙江省教育厅科研项目(12511051)。
刘飞(1980-),男,博士,主要研究方向为食品微生物与生物技术。
高学军
