家兔C型利钠肽基因真核表达载体的构建及鉴定*
2012-01-03龚昆梅王昆华欧阳一鸣李临海黄映光龙亚新
张 剑,龚昆梅,肖 乐,王昆华,欧阳一鸣,李临海,黄映光,朱 宇,龙亚新
(云南省第一人民医院普外一科,昆明 650032)
C型利钠肽(C-type natriuretic peptide,CNP)是Sudoh等[1]在1990年从猪脑中分离而得的由22个氨基酸组成的多肽,是利钠肽家族的重要成员[2],主要表达于中枢神经系统和血管内皮细胞。目前认为CNP是新型有效的血管调节因子[3],但由于CNP在合成后并非大量释放入血,且半衰期极短(仅为2.6 min),生理状态下血浆CNP浓度难以检出[4],大大限制了对其功能的研究和应用。本研究利用基因工程技术将CNP基因导入真核表达载体中,是进一步基因治疗研究的重要基础。
1 材料与方法
1.1材料
1.1.1质粒和菌株 真核表达质粒pEGFP-N1由本室保存;感受态大肠杆菌DH5α购自北京百泰克生物技术有限公司;克隆载体pMD 18-T购自宝生物工程(大连)有限公司。
1.1.2主要试剂和工具酶 限制性内切酶PstⅠ、HindⅢ、KpnⅠ、T4DNA连接酶购自宝生物工程(大连)有限公司;逆转录酶M-MuLV购自加拿大Fermentas公司;TaqPlus DNA聚合酶、dNTP Mix、总RNA提取试剂盒、DNA纯化回收试剂盒购自北京百泰克生物技术有限公司;质粒提取纯化试剂盒购自上海华舜生物技术有限公司。
1.1.3PCR引物设计 利用软件Primer Premier 5.0辅助设计,由上海超世生物科技有限公司合成。序列如下:上游引物5′-ATG CAC CTC TCC CAG CTG C-3′,5端从起始密码ATG开始;下游引物5′-ACA TCC CAT GCC GCT CAT G-3′,5′端含有终止密码子TAG的互补序列。PCR产物长度为381 bp。
1.2方法
1.2.1兔腹主动脉总RNA的提取和cDNA的逆转录 按照总RNA提取试剂盒、Fermentas逆转录试剂盒说明书进行。
1.2.2兔CNP基因全长编码区的克隆 以兔腹主动脉cDNA为模板,用RT-PCR方法克隆。cDNA模板4 μL,dNTP(10 mmol/L)2 μL,Taq plus buffer(10×)5 μL,Taq plus(5 μ/μL)2 μL,DMSO 2.5 μL,甘油2.5 μL,上游引物(10 μmol/L)2 μL,下游引物(10 μmol/L)2 μL,ddH2O 28 μL。循环条件为:95 ℃ 5 min,94 ℃ 75 s,59 ℃ 45 s,72 ℃ 45 s(共40个循环),72 ℃延伸10 min。将产物经2%琼脂糖凝胶电泳观察结果。
1.2.3pMD 18-T/rCNP的亚克隆 将CNP片段胶回收后通过TA克隆连接到克隆质粒pMD 18-T的TA克隆位点,经T/A连接,16 ℃延伸30 min。将重组克隆转化感受态大肠杆菌DH5α,通过蓝白斑筛选挑取阳性克隆,扩增后提取纯化质粒,得到重组pMD 18-T /rCNP。
1.2.4pMD 18-T/rCNP的筛选和鉴定 用Pst Ⅰ内切酶对重组pMD 18-T/rCNP进行单酶切,筛选出负向插入片段,分别用HindⅢ和KpnⅠ双酶切鉴定。双酶切体系:10×M Buffer 5 μL,HindⅢ 2.5 μL,KpnⅠ 2.5 μL,模板20 μL,双蒸20 μL,共50 μL,37 ℃酶切1 h,结束后进行琼脂糖凝胶电泳检测。
1.2.5pEGFP-N1/rCNP的构建和鉴定 用HindⅢ和KpnⅠ分别对pEGFP-N1和负向pMD 18-T/rCNP进行双酶切,切胶回收后将CNP通过T4DNA连接酶定向克隆至pEGFP-N1的酶切位点HindⅢ和KpnⅠ中,转化感受态大肠杆菌DH5α,选取阳性克隆,扩增后提取纯化质粒,得到重组pEGFP-N1/rCNP。然后分别用PCR、双酶切和测序三重方法对重组pEGFP-N1/rCNP进行鉴定。
2 结 果
2.1家兔CNP基因全长编码区的克隆 将PCR产物进行琼脂糖凝胶电泳,在381 bp左右的位置可见1条清晰明亮的目的条带,片段大小与Genebank中公布的片段大小相符。而阴性对照无目的条带出现,见图1。
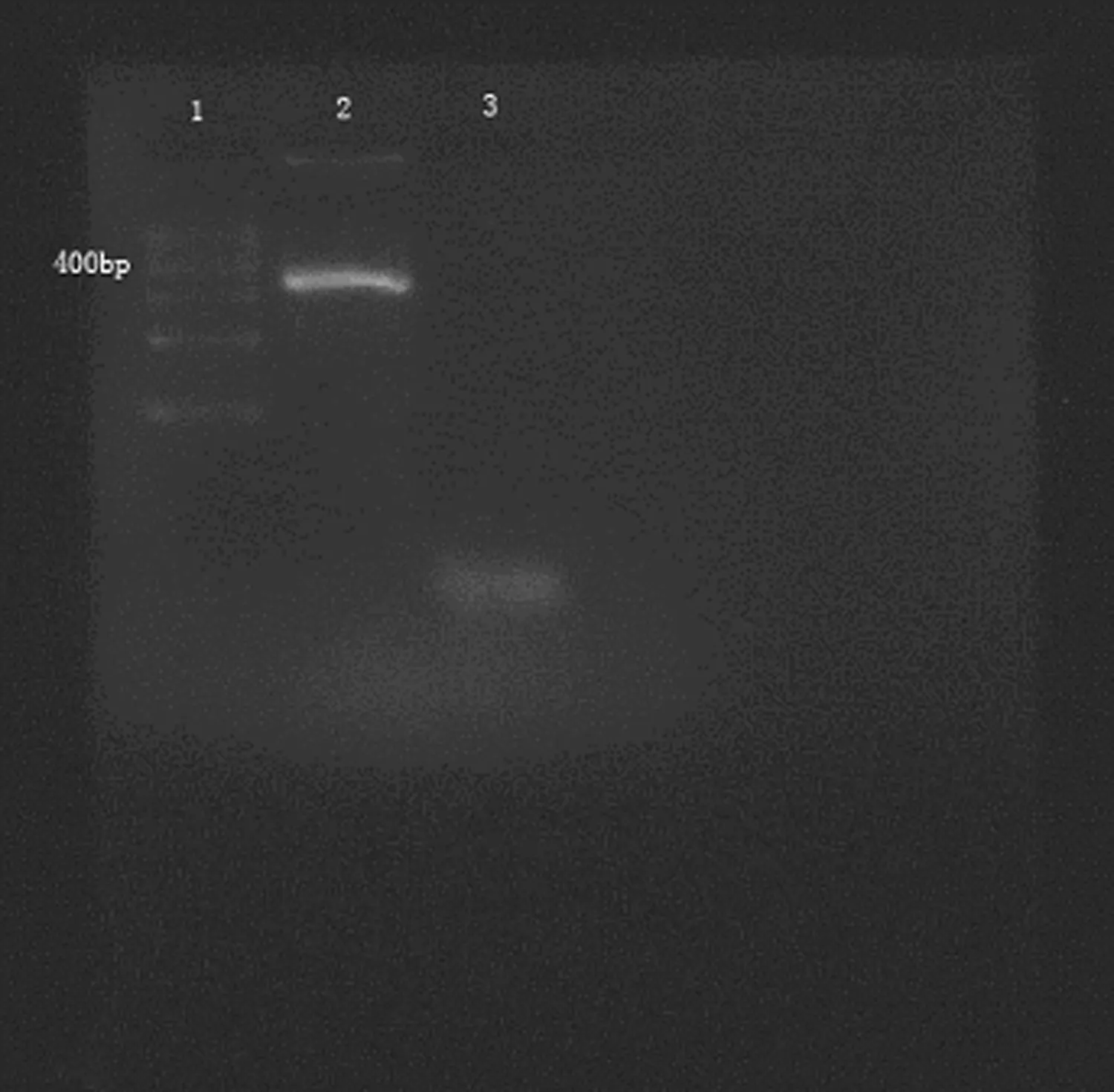
1:DNA 标记物;2:目的条带家兔CNP;3:阴性对照。
2.2pMD 18-T/rCNP亚克隆的筛选和鉴定 用Pst Ⅰ对pMD 18-T /rCNP进行单酶切,含反向插入片段的酶切结果是2条分别为153 bp和2 920 bp的条带,含正向插入片段的酶切结果是2条分别为256 bp和2 817 bp的条带。
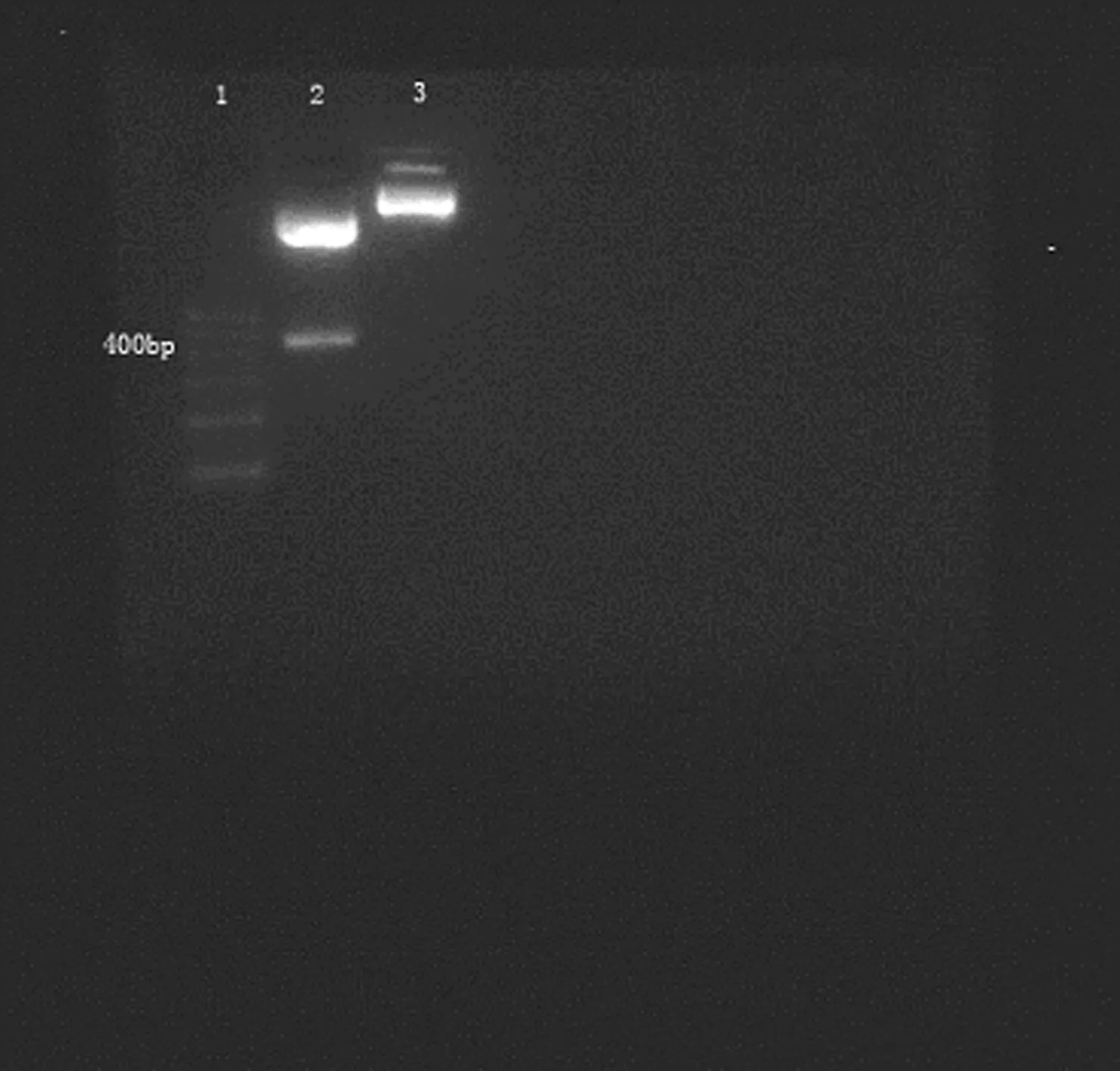
1:DNA 标记物;2:重组pEGFP-N1/CNP;3:空pEGFP-N1。
2.3pEGFP-N1/rCNP的鉴定 采用pEGFP-N1/rCNP为模板,进行PCR鉴定,在381 bp左右的位置可见到目的条带。用HindⅢ和KpnⅠ对重组pEGFP-N1/rCNP进行双酶切,结果得到大小分别为4 300 bp和400 bp的2条片段,而空pEGFP-N1仅为1条4 700 bp的片段(图2)。经Blast对比,测序结果与Genebank中公布的序列完全相符(Gene ID:100344147),且目的片段被准确插入到pEGFP-N1中HindⅢ和KpnⅠ中(上海生工生物工程技术有限公司,07051844(ZJ1)PEGFPN5_A11)。重组pEGFP-N1/rCNP的部分测序结果,见封2图3。
3 讨 论
利钠肽家族成员包括心房利钠肽(atrial natriuretic peptide,ANP),脑利钠肽(brain natriuretic peptide,BNP)、CNP、树眼镜蛇属利钠肽(dendroaspis natriureticpeptide,DNP)、尿扩张素、鸟苷蛋白和尿鸟苷蛋白等[5]。利钠肽在调节血容量、血管平滑肌张力和维持心血管动态平衡方面起着重要作用[6]。其中,ANP和BNP主要来源于心脏,合成后分泌到血液循环中与血管组织、肾脏和肾上腺上的特异性受体(natriuretic peptide receptor,NPR)-A结合,发挥促使血管扩张、促进利钠、利尿等作用[7];CNP主要来源于中枢神经系统、血管内皮和肾脏,通过旁分泌、自分泌的方式与NPR-B结合,对血管紧张度和重构起调节作用[8-9]。
CNP主要在血管组织中表达,与广泛分布于血管系统、脑、骨等组织的受体胞外区域特异性结合后,通过跨膜转运激活与质膜相连的鸟苷酸环化酶,促进第二信使cGMP积累,导致cGMP依赖蛋白激酶磷酸化,降低细胞内钙离子浓度,使血管平滑肌松弛[10]。其生理效应:(1)调节血管平滑肌细胞紧张度与血管内皮细胞保持一致,实现对局部血管舒缩的调控[11];(2)调节血管稳态[12],直接或间接调节血压[3,13];(3)增强心肌收缩[14];(4)抑制血管炎症反应和血管平滑肌细胞增殖[15];(5)促进血管损伤后新生内膜形成[3,16];(6)抑制缺血或再灌注损伤[4]以及作为血管内皮细胞超极化因子(endothelium-derived hyperpolarizing factor,EDHF)发挥作用[17]。
本研究直接通过RT-PCR方法从家兔血管组织中克隆CNP全长编码区,然而CNP编码区GC含量高达64%,容易形成稳定的二级结构,使PCR反应及测序常常不能顺利进行。本实验中采用提高预变性温度和延长变性时间的办法,同时加入甘油和二甲亚砜等PCR增强剂,保证了PCR扩增反应的顺利进行。
外源DNA片段与载体连接的方式包括同源黏端连接、平端连接和定向克隆,其中定向克隆具有连接效率高、定向插入和有效限制自身环化的优点[18]。本研究先将CNP全长编码区亚克隆至克隆载体pMD 18-T中,再通过双酶切使CNP片段具备与pEGFP-N1互补的黏端,然后再定向克隆至pEGFP-N1的转录起始位点下游。此方法与直接在引物末端添加酶切位点相比,大大提高了酶切和连接效率。
本研究成功构建了含家兔CNP基因的真核表达质粒,对于进一步开展研究CNP的作用机制以及与疾病的关系及其临床应用价值等打下了重要基础。
[1]Sudoh T,Minamino N,Kangawa K,et al.C-type natriuretic peptide(CNP):a new member of natriuretic peptide family identified in porcine brain [J].Biochem Biophys Res Commun,1990,168(2):863-870.
[2]Rubattu S,Sciarretta S,Valenti V,et al.Natriuretic peptides:an update on bioactivity,potential therapeutic use,and implication in cardiovascular diseases[J].Am J Hypertens,2008,21(7):733- 741.
[3]Scotland RS,Ahluwalia A,Hobbs AJ.C-type natriuretic peptide in vascular physiology and disease[J].Pharmacol Ther,2005,105(2):85-93.
[4]Hobbs AJ,Foster P,Prescott C,et al.Natriuretic peptide receptor-C regulates coronary blood flow and prevents myocardial is chemia/reperfusion injury:a novel cardioprotective role for endothelium-derived C-type natriuretic peptide[J].Circulation,2004,110(11):1231-1235.
[5]Potter LR,Yoder AR,Flora DR,et al.Natriuretic peptides:their structures receptors,physiologic,functions and therapeutic applications[J].Handb Exp Pharmacol,2009(191):341-366.
[6]Vlachopoulos C,Ioakeimidis N,Terentes-Printzios D,et al.Amino-terminal pro-C-type natriuretic peptide is associated with arterial stiffness,endothelialfunction and early atherosclerosis[J].Atherosclerosis,2010,211(2):649-655.
[7]Nakao K,Ogawa Y,Suga S,et al.Molecular biology and biochemistry of the natriuretic peptide system.I:Natriuretic peptides[J].J Hypertens,1992,10(9):907-912.
[8]Miyoshi M,Kitaqawa Y,Imoto T,et al.Effect of natriuretic peptide receptor antagonist on lipopolysaccharide-induced fever in rats:is natriuretic peptide an endogenous antipyretic[J].J Pharmacol Exp Ther,2006,318(3):1163-1170.
[9]Pagel-Langenickel I,Buttgereit J,Bader M,et al.Natriuretic peptide receptor B signaling in the cardiovascular system:protection from cardiac hypertrophy[J].J Mol Med(Berl),2007,85(8):797-810.
[10]Garbers DL,Chrisman TD,Wiegn P,et al.Membrane guanylyl cyclase receptors:an update[J].Trend s Endocrinol Metab,2006,17(6):251-258.
[11]Kelsall CJ,Chester AH,Sarathchandra P,et al.Expression and localization of C-type natriuretic peptide in human vascular smooth muscle cells[J].Vascular Pharmacol,2006,45(6):368-373.
[12]Potter LR,Abbey-Hosch S,Dickey DM.Natriuretic peptides,their receptors,and cyclic guanosine monophosphate-dependent signaling functions[J].Endocr Rev,2006,27(1):47-72.
[13]Ono K,Mannami T,Baba S,et al.A single-nucleotide polymorphism in C-type natriuretic peptide gene may be associated with hypertension[J].Hypertens Res,2002,25(5):727-730.
[14]Palmer SC,Prickett TC,Espiner EA,et al.Regional release and clearance of C-type natriuretic peptides in the human circulation and relation to cardiac function[J].Hypertension,2009,54(3):612-618.
[15]Walther T,Stepan H.C-type natriuretic peptide in reproduction,pregnancy and fetal development[J].J Endocrinol,2004,180(1):17-22.
[16]Hutchinson H,Trinlade P,Cunanan D,et al.Mechanisms of natriuretic-peptide-induced growth inhibition of vascular smooth muscle cells[J].Cardiovascular Res,1997,35(1):158-167.
[17]Sandow SL,Tare M.C-type natriuretic peptide:a new endothelium-derived hyperpolarizing factor[J].Trends Pharmacol Sci,2007,28(2):61-67.
[18]Sambrook J,Ffitsch EF,Maniatis T.Molecular Cloning:A Laboratory Manual[M].3rd ed.New York:Cold Spring Harbor Laboratory Press Cold Spring Harbor,2002:78-90.
