CD105、TSP-1在膀胱移行细胞癌中的表达及临床意义
2012-01-01王晓辉李志军程远合张建国
王晓辉, 李志军, 程 涛, 程远合, 张建国, 梁 豪
膀胱移行细胞癌(transitional bladder cell carcinoma, TBCC)在我国是泌尿系统发病率最高的恶性肿瘤。TBCC以高发、多发、复发为特点,浅表性肿瘤易复发,浸润性和转移性肿瘤预后则较差。近年来手术和化疗方案虽不断改进,但疗效仍不尽人意。肿瘤新生血管在肿瘤的生物学特性方面的重要作用日益受到诸多学者的重视。本研究通过对膀胱肿瘤新生血管的研究以期为膀胱移行细胞癌的治疗提供新思路。本研究通过免疫组织化学SP法检测CD105和TSP-1两种血管生成相关因子在60例膀胱移行细胞癌组织和12例正常膀胱组织中的表达,并通过微血管密度计数,分析两者在膀胱移行细胞癌中的作用。
1 资料与方法
1.1 临床资料 60例人膀胱移行细胞癌标本和12例正常膀胱组织标本均来源于本院2010年3月至2011年5月的手术患者,术前均未行放化疗,资料完整且经病理诊断证实。膀胱移行细胞癌患者中男34例,女26例;年龄27~79岁,平均年龄58.41岁。肿瘤标本分组根据TNM分期(Tis~T1 20例,T2 28例,T3~T4 12例)和WHO分级(G1 30例,G2 19例,G3 11例)。
1.2 方法 (1)试剂:所用鼠抗人CD105单克隆抗体和鼠抗人TSP-1单克隆抗体及免疫组化SP试剂盒均购自福州迈欣生物技术有限公司,DAB显色剂购自北京鼎国昌盛生物技术有限公司。(2) 免疫组化染色:所有标本经10%福尔马林固定,石蜡包埋,4 μm切片,0.01 mol/L柠檬酸盐缓冲液抗原修复,SP免疫组化染色。所用抗E-cadherin抗体浓度为1∶100,所用抗Snail抗体浓度为1∶150。染色步骤按说明书进行,DAB显色,苏木精复染,透明封固。两者均以PBS代替一抗做阴性对照。
1.3 结果判定 阳性结果判定标准以染色强度和阳性细胞的百分比的乘积进行判断:依据参考文献[1],染色程度淡黄色为1分,棕黄色为2分,黄褐色为3分。在高倍视野下计数阳性细胞的百分比,小于5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。按照染色程度×阳性细胞百分比计积分:1~2分为弱阳性(+),3~4分为中等阳性(++),5分以上为强阳性(+++)。微血管密度(MVD)的判定:依据参考文献[2],在低倍镜下选择5个微血管密集区,而后在高倍镜下以被染色的内皮细胞群为1个微血管,分别计数出5个视野的微血管平均值,即为该肿瘤的MVD值。
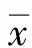
2 结果
2.1 CD105和TSP-1在膀胱癌及正常膀胱黏膜组织中的表达情况(表1) TBCC中CD105的阳性表达主要在细胞浆及胞膜,特别集中于肿瘤的边缘细胞和微血管内皮细胞。阳性表达率为78.3%(47/60),正常膀胱黏膜中CD105的阳性表达率为25.0%(3/12),两者相比差异有统计学意义(P<0.05)。TBCC中TSP-1的阳性表达率为43.3%(26/60),在正常膀胱组织中的阳性表达率为75.0%(9/12),两者相比差异有统计学意义(P<0.05)。
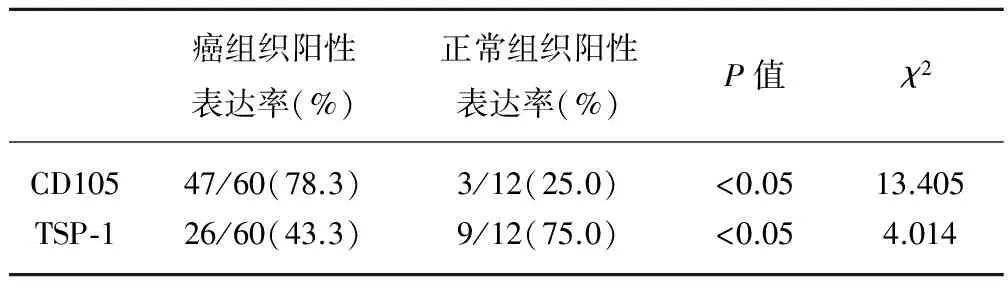
表1 CD105与TSP-1在膀胱移行细胞癌、正常膀胱组织中的表达
2.2 CD105、TSP-1和MVD的相互关系 CD105高表达而MVD值高的27例膀胱癌组织中TSP-1低表达25 例;TSP-1高表达的16例膀胱癌组织中MVD值较低,而CD105表达较低也有13 例。在CD105中低度表达的膀胱癌组织中TSP-1低表达的MVD值要明显高于TSP-1高表达的MVD值(P<0.05)。Sperarman等级相关分析表明,CD105和TSP-1在膀胱移行细胞癌中表达情况呈负相关(r=-0.234,P<0.05)。
2.3 CD105、TSP-1和MVD与TBCC分级分期的相关性(表2) WHO分级:CD105在G1、G2、G3级中的阳性表达率分别为76.7%、78.9%、81.8%。G1级和G2级、G2级和G3级之间差异无统计学意义差异(P>0.05),而G3级的表达显著高于G1级(P<0.05)。MVD值在G1、G2、G3级中分别为63.8±13.2、76.2±10.9、81.9±8.8。TSP-1在G1、G2、G3级中的阳性表达率分别为50.0%、42.1%、27.3%。G3级的表达显著低于G1级和G2级(P<0.05)。
TNM分期:CD105在Tis~T1、T2、T3~T4期的阳性表达率分别为60.0%、82.1%、100%,3组分期间CD105表达差异均有统计学意义(P<0.05)。TSP-1在Tis~T1、T2、T3~T4期的阳性表达率分别为55.0%、46.4%、16.7%,3组分期间TSP-1表达差异均有统计学意义(P<0.05)。MVD在 60例BTCC中Tis~T1、T2、T3~T4期的数值分别为67.3±11.1、73.2±10.8、89.1±12.3。

表2 CD105与TSP-1在TBCC不同分期、分级中的表达及其关系
3 讨论
肿瘤新生血管是肿瘤的主要生物学特点,是肿瘤发生发展和转移的基础。因此对血管生成相关因子的研究有助于了解血管生成的机制和在肿瘤组织中的临床意义,为肿瘤临床治疗提供更多理论依据。
MVD是肿瘤血管最密集部位微小血管的平均计数,是了解肿瘤微血管与肿瘤分级分期相互关系的重要指标。我们研究发现在肿瘤细胞分化级别较低的组织中MVD值较高,且随着肿瘤TNM分期的增加MVD值也在升高。通过MVD计数发现进展期肿瘤的边缘部位的微血管数量明显高于近肿瘤中心部位的微血管数量,这就说明肿瘤的微血管在肿瘤的分级分期和肿瘤的发生发展转移方面都有密切关系。大量研究发现肿瘤微血管的生成受多种因子的调节,根据在血管生成方面的作用大致分为促进血管生成因子和抑制血管生成因子两大类。
CD105作为促进肿瘤血管生成最重要的因子之一,是一种新生血管内皮细胞的粘附分子,在增殖的肿瘤血管内皮细胞中表达较高,而在正常组织血管中表达较少。Akagi等[3]研究证实在结肠的轻到重不典型增生直到癌变过程中CD105标记的MVD逐级升高,提示CD105对于结肠癌的早期诊断有参考价值。Bourdeau等[4]研究发现CD105基因编码突变将导致遗传性毛细血管扩张症,也证实了CD105在血管生成中的作用。Li等[5]研究发现去除CD105基因的裸鼠在妊娠后10~11天死于脉管发育不全,由此也说明CD105在血管生成中的重要作用。本实验的研究结果显示,在膀胱移行细胞癌中CD105的阳性表达率为78.3%(47/60),在正常膀胱黏膜中的阳性表达率为25.0%(3/12),两者差异有统计学意义,结果与上述文献一致。通过本实验显示的TBCC各分期中CD105的表达及与MVD的关系可以说明CD105与膀胱癌的发展、转移密切相关,可以作为判断膀胱癌恶性程度、病情进展程度的标志物之一。
血小板反应蛋白(TSP-1)是一种重要的抑制血管生成物质,在人体组织中广泛分布。Yap等[6]研究证实TSP-1的衍生物在体外可直接杀伤内皮细胞,在体内可诱导环磷酰胺和顺铂对内皮细胞的凋亡作用,从而抑制肿瘤血管的生成。多项研究发现TSP-1与血管内皮受体CD36结合抑制内皮细胞的迁移,拮抗毛细血管的生成[7]。Isenberg等[8]研究发现TSP-1的type I序列能明显抑制内皮细胞的增殖。Reiher 等[9]也发现TSP的类似物DI-TSP具有和TSP-1类似的抑制肿瘤血管生成,诱导内皮细胞凋亡的作用。本实验研究TSP-1 在膀胱癌的各级各期中的表达发现,在分期越高和恶性程度高的标本中表达较弱,而TSP-1表达阳性率较高的标本多见于正常组织或肿瘤的早期,也证实了上述学者的观点。
本研究中CD105高表达且MVD值高的膀胱癌组织中TSP-1表达低,TSP-1高表达的膀胱癌组织中MVD值较低,CD105表达也较低。在CD105中低度表达的膀胱癌组织中TSP-1表达低的MVD值要明显高于TSP-1表达高的,这都说明肿瘤血管的生成是以CD105和TSP-1为代表的正负两类血管因子相互作用的结果。因此测定两者在癌组织中的表达情况及与MVD 的关系有助于判断肿瘤的发展及预后,同时也可通过干预两者在血管生成方面的作用来达到膀胱癌的抗血管治疗。关于两者在肿瘤血管生成方面的作用尚处于研究阶段,其中较多环节作用机制尚不完全明了,仍需进一步的研究。
[1] Gohji K, Okamoto M, Kitazawa S, et al. Heparanase protein and gene expression in bladder cancer[J]. J Urol, 2001,166(4):1286-1290.
[2] 吴后男, 李玉林, 张丽红, 等. 血管内皮生长因子和E26转录因子在乳腺癌中的表达及意义[J]. 中华病理学杂志, 2002, 31(3):222-226.
[3] Akagi K, Ikeda Y, Sumiyoshi Y, et al. Estimation of angiogenesis with anti-CD105 immunostaining in the process of colorectal cancer development[J]. Surgery, 2002, 131(1suppl):S109-S113.
[4] Bourdeau A, Faughnan ME, Letarte M. Endoglin-deficient mice,a unique model to study hereditary hemorrhagic telangiectasis[J]. Trends Cardiovasc Med, 2000,10(7):279-285.
[5] Li C, Hampson IN, Hampson L, et al. CD105 antagonizes the inhibitory signaling of transforming growth factor beta1 on human vascular endothelial cells[J]. FASEB J, 2000, 14(1):55-64.
[6] Yap R,Veliceasa D, Emmenegger U,et al. Metronomic lowdose chemotherapy boosts CD95-dependent antiangiogenic effect of the thrombospondin peptide ABT-510: a complementation antiangiogenic strategy[J].Clin Cancer Res,2005,11(18):6678-6685.
[7] Simantov R, Silverstein RL. CD36: a critical anti-angiogenic receptor[J]. Front Biosci, 2003, 8:s874-882.
[8] Isenberg JS, Ridnour LA, Perruccio EM, et al. Thrombospondin-1 inhibits endothelial cell responses to nitric oxide in a cGMP-dependent manner[J]. Proc Natl Acad Sci USA, 2005, 102(37):13141-13146.
[9] Reiher FK, Volpert OV, Jimenez B, et al. Inhibition of tumor growth by systemic treatment with thrombospondin-1 peptide mimetics[J]. Int J Cancer, 2002, 98(5):682-689.
