从软锰矿中湿法浸出锰的研究进展
2011-12-31谢红艳王吉坤杨世诚李天杰纳吉信
谢红艳,王吉坤,杨世诚,马 进,李天杰,纳吉信,彭 东
(1.昆明理工大学冶金与能源工程学院,云南昆明 650093;2.云南冶金集团总公司,云南昆明 650031;3.云南建水锰矿有限责任公司,云南建水 654302)
0 前言
硫酸锰的工业生产在我国已有50多年的历史。由于我国锰矿资源丰富,各地都根据其资源条件开展了硫酸锰生产的各种工艺研究[1~3]与生产实践。研究如何经济、合理地利用低品位软锰矿,特别是解决其还原工艺这一瓶颈性的技术问题,对缓解当前我国锰矿资源紧缺的矛盾、确保锰系产品行业的可持续发展,以及西部地区经济的发展都具有十分重要的战略意义[4]。本文在广泛收集整理国内外有关锰矿湿法浸出研究成果的基础上,对锰矿湿法浸出过程及其工艺的研究进展进行综述,并提出进一步研究的方向。
1 国内的研究进展与现状
1.1 两矿一步法
我国研究工作者对两矿一步法反应过程的浸出机理、化学热力学和动力学特征、以及过程的各种影响因素和具体操作条件,都开展了大量的试验研究工作,发表了许多研究报告。
2004年,贺周初等[5]介绍了两矿法浸出低品位软锰矿的原理及工艺条件,在一定的工艺条件下,以硫铁矿作还原剂,用硫酸直接浸出Mn含量为25%左右的低品位软锰矿,浸出率达93%,该工艺具有能耗少,成本低,实用性强,锰回收率高等特点,为低品位软锰矿的利用开辟了新的途径。
对该酸浸反应,不少研究者作了很多探讨,由反应复杂,每个反应都有其理论依据。根据文献[6~7],归纳列出的反应式如下:

袁明亮等[8~9]的研究指出,在该浸出过程中,浸出反应初始条件不同,反应机理及最终的产物均不同,在起始酸浓度较高的条件下,存在着黄铁矿氧化产物为S0和SO2-4的竞争反应,使得浸出所需黄铁矿用量增加,同时,产物S0粘附于矿石颗粒表面,由于S0的强疏水性和非导电性,阻碍了浸出反应的进一步进行,这是两矿法锰浸出率低的主要原因。
王长兴[10]认为在浸出过程中,由FeS2和MnO2颗粒组成两个原电池,如图1。其中MnO2原电池反应迅速,而FeS2的原电池由于生成的硫膜覆盖在FeS2颗粒表面,溶解速度受阻变慢。
MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O FeS2+Fe3+=3Fe2++2S°
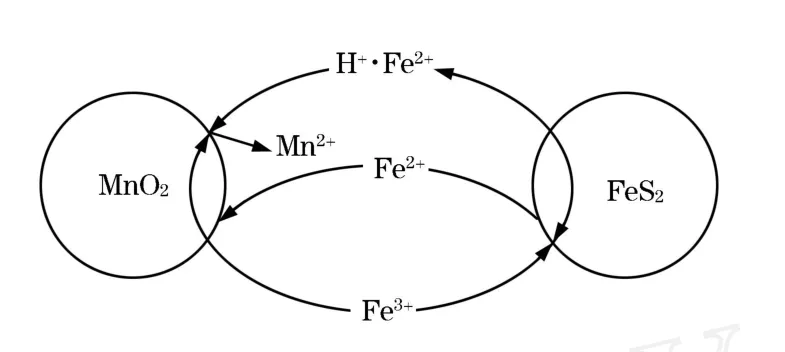
图1 FeS2和MnO2颗粒组成两个原电池
提高浸出温度和加强搅拌,加速扩散有利于反应进行。当溶液的pH值接近3以后,Fe2+沉淀为Fe(OH)3或 Fe2O3·n H2O,催化作用即消失。
卢宗柳等[11]的研究指出:浸出反应体系中Fe3+氧化能力的制约因素是Fe3+与Fe2+的浓度比值,比值愈高,则氧化能力愈强。采取在浸出料浆中返回浸渣洗液(含 Fe3+和 Fe2+)可缩短反应时间。出现不同产地黄铁矿用量配比差异的主要原因可能是由于元素之间的类质同象、晶体结构畸变以及选矿药剂作用等因素造成的。
华毅超等[12]利用Fenton试剂的催化氧化作用对还原阶段的后期进行了相关的改进,Fenton试剂(Fe2++H2O2)能产生大量的羟基自由基,因而具有极强的氧化能力。由于硫铁矿的投料相对于锰是过量的,因而在反应后期,体系中有一定量 Fe2+存在。此时引入双氧水(H2O2)则在体系中形成了 Fenton试剂。剧烈的氧化作用使反应体系产生大量微泡而剧烈翻腾,强化了搅拌效果,并将矿粉颗粒进一步破碎,促使被包藏的锰进一步溶出。此外,H2O2也具有将四价锰还原为二价锰的作用,还可将过量的Fe2+氧化为 Fe3+,使浸取液中的铁以 Fe3+的形式存在。这样,当加入碳酸钙(CaCO3)中和过量硫酸时,杂质铁形成Fe(OH)3而更易于沉淀除去。Fenton试剂的形成起到了一举多得的效果。主要反应方程式为:
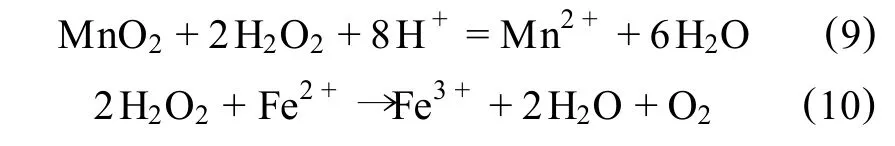
据称,由此可使软锰矿中锰的利用率从现行工艺的83%提高至91%,新增产出大大高于所增加的原料投入。
2008年,陈蓉等[13]以铁矿精选后的尾矿—硫精砂为还原剂,用硫酸直接浸出锰含量为15%左右的低品位锰矿,可得到较好技术指标的硫酸锰产品,锰的浸出率在97%以上,锰回收率可达92.39%。实验得出当锰矿粉、硫铁矿和硫酸三者的质量比为1∶0.2∶0.46,浸出时间为10 h时,锰浸出效果较佳,且副产品酸性白土的产率为51%~72%。
两矿一步法的优点是省去了高温焙烧工序,其还原、浸出和净化可在同一反应槽内完成,减少了设备投资,黄铁矿来源广,价格低廉,生产成本低,操作过程亦简单易行,与焙烧法相比大大改善了操作环境,还降低了酸耗,因此两矿一步浸出法在当前已是我国低品位软锰矿生产锰系产品过程中最通行的工艺路线。
两矿一步法的缺点是还原率和浸出率较低,渣量大,影响了锰的回收率,尤其在生产电解金属锰过程的工艺控制上,净化过程较难掌握,特别要求软锰矿和黄铁矿的矿源成分稳定,因此,两矿一步法虽然在硫酸锰和普通级电解二氧化锰生产中得到了广泛的应用,但是在生产电解金属锰的过程中,至今尚未得到普遍推广使用。
1.2 SO2直接浸出法
张昭等[14]研究了用纯SO2浸出软锰矿(含锰量25%)的动力学,在系统研究了温度、锰矿粒度、SO2流量、液固比和搅拌强度对锰浸出率影响的基础上,导出了浸出过程的动力学方程:
1-(1-a)1/3=2.80×10-3Q1.04SO2exp(-22 420/8.31 T)t实验结果表明:浸出过程为矿粒表面化学反应所控制,浸出反应可在常温下进行。同时也研究了杂质铁的行为,证实了二价铁离子对锰浸出的催化作用。
有学者研究表明[15~16],在 SO2直接浸取软锰矿过程中,连二硫酸锰的生成与所使用的浸取反应条件有很密切的关系,在室温下反应所得浸出产物中有1/3是连二硫酸锰,而若在10℃以下生成物则全部是连二硫酸锰,而随着温度的升高,连二硫酸锰会发生分解反应:
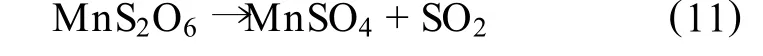
总的说,与传统的还原焙烧法相比,二氧化硫浸出工艺缩短了生产流程,节省能源消耗、设备投资和场地、避免了焙烧过程废气对环境的污染。生产成本亦有所降低,因而特别适用于低品位软锰矿的有效利用[17],在这方面,尚需要长期的生产实践来加以验证。
1.3 连二硫酸钙法浸出软锰矿[18]
在浸出槽中将软锰矿粉与连二硫酸钙(CaS2O6)混合成矿浆,通入 SO2即生成硫酸锰和连二硫酸锰,所生成的硫酸锰再与连二硫酸钙作用置换转化为连二硫酸锰溶液和硫酸钙沉淀:
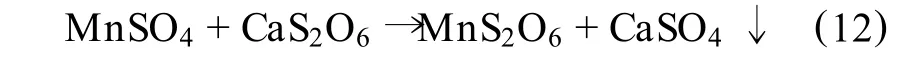
过滤浸出液,碳酸钙即与浸出渣一起被过滤分离出去。滤液中加入石灰乳,则生成Mn(OH)2沉淀:
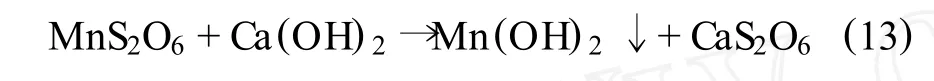
再将其过滤,即得到固体Mn(OH)2产品,可作为锰精矿或用酸溶解后制备锰系产品。而滤液中含CaS2O6可循环使用。
1.4 硫酸亚铁浸出法
综合国内发表的用硫酸亚铁浸出软锰矿的试验报告[19~22]可知其反应条件大体为:反应温度70~95 ℃,初始硫酸浓度 180~210 g/L,液固比 3∶1~8∶1,在搅拌下反应时间为2~3.5 h,二氧化锰浸出率可达95%以上。显然,硫酸亚铁浸出软锰矿的浸出液中含铁量较高,如果使用通行的Fe(OH)3中和沉淀法除铁将产生大量的胶体沉淀,造成过滤困难和锰的吸附损失,因此宜在浸出的同时加入硫酸钠,采用铁矾沉淀法除去大部分的铁[23],所生成的黄钠铁矾沉淀的沉降和过滤性能良好,而且铁矾沉淀反应为产酸反应,可有利于硫酸亚铁浸出软锰矿过程的继续进行。余下未除尽的铁再以调节pH值生成Fe(OH)3沉淀的方法深度去除以达到工艺要求。
1.5 金属铁直接浸出法
朱道荣在研究硫酸亚铁浸出软锰矿的报告[19]中曾经指出:“在此过程中添加定量的废铁屑,对锰的浸出率、液固分离、减少亚铁用量都有好处,这方面的工作有待于进一步研究”。
张东方等[24]报道了用铁屑作还原剂,在酸性条件下浸出锰银矿中的锰,浸出反应条件为:当铁矿比1∶13,矿酸比 0.6∶1,液固比 3∶1,浸出时间 60 min,浸出温度室温,磨矿细度为小于0.074 mm占80%时,锰浸出率达到97.60%,银则留在浸出渣中,实现了锰银分离。酸耗较大是该方法的主要缺点。
1.6 闪锌矿(方铅矿)催化还原法
唐尚文[25~26]介绍了在稀硫酸(或稀盐酸)溶液中,用闪锌矿(或方铅矿)精矿作还原剂,用可溶性铁盐作催化剂,分解软锰矿(或大洋锰结核矿),同时制取锰盐和锌盐。该工艺具有反应快速、彻底,工艺流程简单等特点,同时省去了软锰矿的还原焙烧和锌(铅)精矿的氧化焙烧,能够大幅度提高锰、锌(铅)矿的浸出率,对原料矿的品级没有严格要求。
1.7 农林副产物直接浸出法
2008年,李同庆[4]将各种农作物副产品作为软锰矿还原剂的浸出试验综合于表1中[27~37]。

表1 各种植物原料还原软锰矿浸出试验
1.8 微生物浸取法
20世纪70~80年代我国在微生物浸取低品位锰矿方面曾经进行过不少的工作。近年来,李浩然等[38]进行了用氧化亚铁硫杆菌加还原剂从大洋锰结核中浸出锰的研究,锰的浸出率接近100%。杜竹玮等[39]还进行了用嗜酸混合异养菌还原浸出废电池粉末中的二氧化锰,浸出率达90%以上。
1.9 两矿加浓硫酸熟化法
滕英才等[40]介绍了用硫铁矿、锰矿加入浓硫酸熟化法生产硫酸锰,具有锰的收率高及节约原(燃)材料的特点。首先,将锰粉、硫铁矿粉按1∶0.35先置入搅混机内,加入30%水调成浆状,在不断搅拌下逐渐加入98%浓硫酸,浓硫酸加入量为锰粉的55%左右。由于反应热和硫酸的稀释热作用,过程反应十分激烈,实测温度达140~160℃。待硫酸加完毕,再搅拌10~20 min,趁其还是浆状排出,熟化,再放置较长时间,使其反应彻底进行。
然后,将熟化后的物料,用第2次压滤出的洗涤水按1∶2.5左右进行浸取。开始时浸出液的p H值已达2.5~3,通入蒸汽加热到90℃左右,再用富锰渣粉(其主要成分为MnSiO3)调节p H值,用离心机分离出的母液调节浆液浓度,使浆状溶液的浓度在42°Be,p H=4.8~5.2 后排出。
2 国外的研究进展与现状
2.1 两矿加酸浸出法
将软锰矿、黄铁矿及硫酸按一定的配比,在一定的温度下进行反应,使得高价态锰被还原成低价态锰。Nayak等[41]的研究指出,在此过程中主要产生以下的氧化—还原反应:
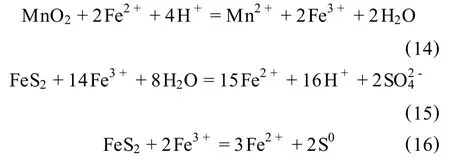
Fe2+由硫铁矿浸出产生,MnO2主要被Fe2+还原成可溶性的Mn2+,这样两个反应循环往复的进行,软锰矿就被不断地浸出,一般认为总反应式为:

第1个反应是快速反应,第2个反应的速度较慢,是整个浸出反应的控制步骤,因此维持 Fe2+离子的浓度远低于Fe3+离子浓度即可促进MnO2的反应速率。
2.2 SO2还原浸出法
Miller J D,Wan R Y[42]研究指出,用 SO2做还原剂直接浸出软锰矿制备硫酸锰的试验原理是:
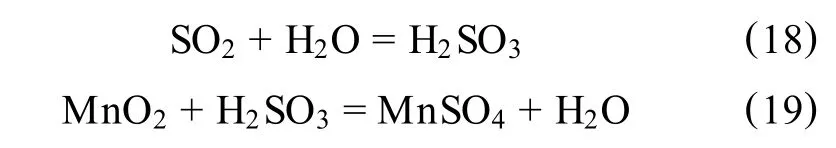
同时发生副反应:
MnO2+2H2SO3=MnS2O6+2H2O
MnS2O6的生成量随搅拌速度增大而降低,随pH值的减小而下降[43]。当温度升高,发生反应:
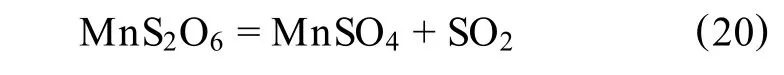
美国矿务局A.Back等[44]发表的研究报告表明,在 pH=0.75时,仅有 3%的 SO2被氧化成S2O6-,而在pH=1.90时,就有8%的SO2被氧化成S2O6-。
日本大阪市立大学Asai等人的研究[45]也同样证实了提高酸度有利于抑制S2O-6的生成,浸取液的温度越高、酸度越高和浆液搅拌强度越大,以及SO2不过量,则反应生成的连二硫酸锰越少。
澳大利亚 HiTec公司2004年申请的专利声称[46],通过控制浸出液的电位、酸度、反应温度和反应时间,可有效地抑制副反应的进行,使浸出液中MnS2O6的含量低于1~5 g/L,其主要工艺参数为:
1)浸出温度95℃以上,浸出液pH值低于1.5。
2)浸出液中可溶性铁以 Fe2(SO4)3的形式存在,其初始浓度大于4 g/L,亚铁离子浓度保持在0.5 g/L以下。
3)在整个浸出过程中,监控铁离子与亚铁离子的比例,确保氧化还原电位(ORP)大于或等于550 mV(相对Ag/AgCl参比电极)。
4)在浸出过程中通入SO2的时间不少于10 h,整个浸出时间为10~15 h。
5)浸出液中MnS2O6含量低于5 g/L或低于1 g/L。
HiTec进一步研究采用溶剂萃取法净化浸出液工艺,并于2005年申请了SO2直接浸取软锰矿的第2个专利[47],在溶剂萃取法净化浸出液的过程中,MnS2O6不会被有机溶剂萃取而留在水相之中,从而与被萃取到有机相的硫酸锰分离开来[48]。因此,在不必考虑生成MnS2O6副反应的情况下,SO2浸取软锰矿过程的反应条件发生了重大的变化,即:浸出液的pH从低于1.5改变为可低于5或低于3;浸出温度从95℃以上改变为可低于60℃;反应时间从不少于10~15 h改变为可在2 h以内使其中95%以上的锰被浸出,从而大大放宽了浸出过程的反应条件,即采用较低的温度和酸度,容许生成少部分MnS2O6。
2.3 硫酸亚铁浸出法
低品位软锰矿与硫酸亚铁之间可能产生以下3种反应[49]:
1)在中性硫酸亚铁溶液中:
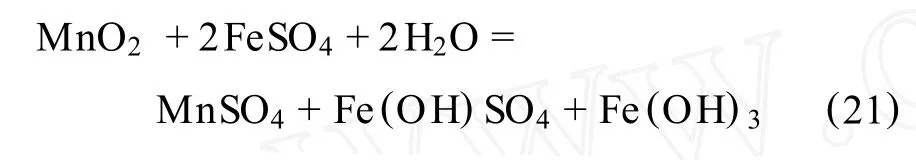
2)在微酸性硫酸亚铁溶液中:
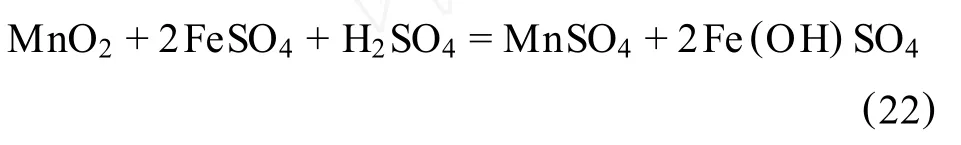
3)在有过量酸存在的硫酸亚铁溶液中:
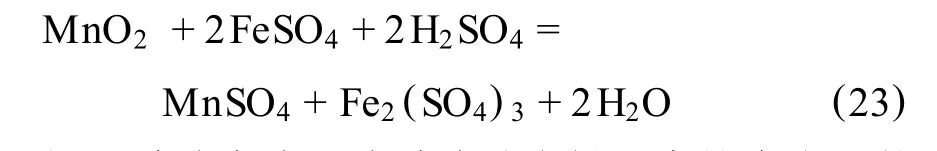
钢厂酸洗废液和硫酸法钛白粉生产均有大量的副产绿矾(FeSO4·7H2O),可在酸性溶液中浸出软锰矿中作为还原剂,使软锰矿中的四价锰还原成硫酸锰,用于生产硫酸锰或其他锰系产品。
2.4 铁屑浸出法
最近国外的研究[50]表明:在酸性软锰矿浆中,直接加入海绵铁,能够使软锰矿中的四价锰迅速地还原成二价锰,比用硫酸亚铁更加有效。其反应条件为:物料(锰矿和海绵铁)粒度:-250+150μm,H2SO4/MnO2摩尔比3,Fe/MnO2摩尔比0.8,室温(20℃)下反应10 min后锰浸出率即达到98%,反应15 min后浸出率达到100%。若将反应温度从20℃提高到60℃,则反应时间可从10 min减少到3 min,即可使软锰矿完全被浸出。
而在与前列同样条件下,若使用硫酸亚铁作为还原剂,并且把 Fe/MnO2摩尔比提高到0.8,反应10 min后锰浸出率仅为80%,反应30 min后也仅93%,可见直接加金属铁现场形成的硫酸亚铁对还原浸出的过程起了很有利的促进作用。
实际上,铁屑在酸性溶液中很快就与酸反应生成硫酸亚铁,起还原作用的还是硫酸亚铁中的亚铁离子,因此金属铁直接浸出法的机理是与硫酸亚铁浸出法相同的,实际上是一种改良的硫酸亚铁浸出法,这是由于初生态的亚铁离子可能具有更强的还原能力。
2.5 煤炭直接还原法[51-52]
在酸性条件下,煤可与软锰矿反应,使其中的MnO2还原成MnO而进入溶液:
2MnO2+4H++C→CO2+2Mn2++2H2O(24)
ΔESHE=1 102 V,ΔG0=-394 kJ,由此可知 ,该反应的热力学的反应推动力较大,Hancock等研究了使用烟煤和褐煤在酸性溶液中分别浸出Amapa锰矿粉(含锰33.1%)、软锰矿(估计含锰 63%)、深海锰结核(含锰33.9%)和化学二氧化锰(估计含锰63%)的过程,指出浸出还原反应速率与温度和酸度成正比,煤/矿比为2∶1,浸出液可用硫酸、盐酸或腐殖酸,酸浓度为1~5 N,浸出液含固浓度100~300 g/L,在95℃以上进行反应约2~4 h,锰浸出率可达95%以上。试验表明:褐煤还原二氧化锰的能力大于烟煤,同等反应条件下以上4种类含锰的物料中软锰矿的浸出率相对较低,而盐酸溶液中的浸出反应速率和浸出率明显大于硫酸溶液。
2.6 草酸直接浸出法
Sahoo[53]等报道了用草酸作为还原剂浸出印度Joda软锰矿(含 24.7%Mn和 28.4%Fe,粒度为-150+105μm)的试验,在85℃的含草酸30.6 g/L和硫酸浓度为0.534 M的溶液中可浸出锰矿粉中98.4%的锰,而只有8.7%的铁被浸出。
在酸性介质中草酸可与二氧化锰产生以下还原反应:
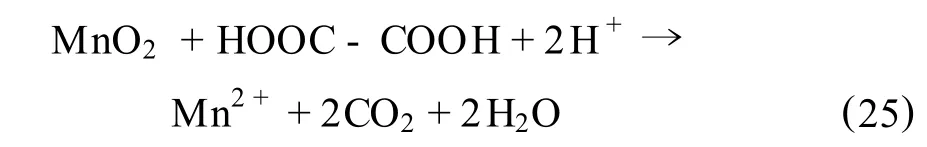
2.7 甲醇直接浸出法
F.Momade等[54]研究了在硫酸介质中甲醇直接还原加钠贫软锰矿(含27.6%~32.0%Mn和8.6%~6.1%Fe)的浸出过程,其反应式为:
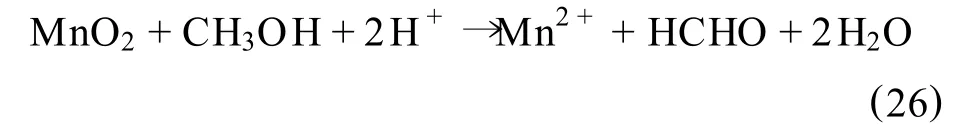
试验结果表明:在160℃的高温下,含硫酸0.3 M的40%(体积比)甲醇溶液与软锰矿反应2 h后,锰的浸出率可达98%。试验结果还指出,在此过程中甲醇浓度对锰矿中铁的浸出率具有很大的影响,在120℃和0.16 M硫酸的反应条件下,当溶液中的甲醇浓度从0%增加到50%(体积比)时,铁的浸出率则从58%降低到3.5%,而在160℃和0.092 M硫酸和40%(体积比)甲醇的反应条件下,铁的浸出率仅有0.4%。
2.8 电解还原浸出法
Elsherief[55]研究了埃及低品位软锰矿在硫酸溶液中的矿浆电解浸出过程,指出其反应:
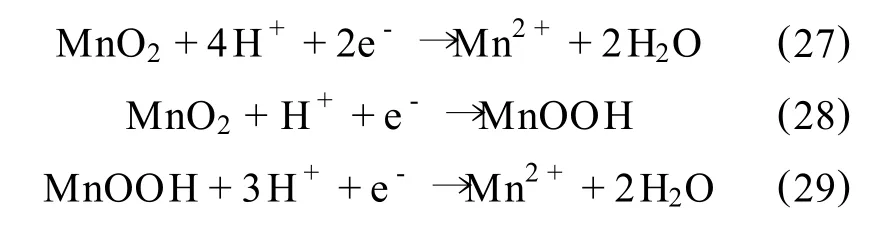
当有足够的MnOOH聚集在MnO2表面时,就产生进一步的还原反应,在电解液中形成Mn2+:
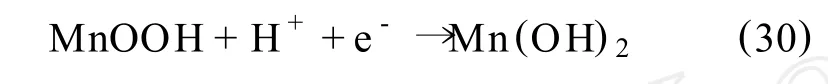
酸度、温度和所施加的电位对浸出率都有很大的影响,Fe2+和Mn2+的存在将大大增加反应的速度,最佳的电解浸出反应条件是在70℃的50 g/L硫酸溶液中,液固比为 1∶100,施加电位 0 m V(相对Hg/HgSO4/K2SO4参比电极),反应45 min后锰即可被完全浸出,而铁的浸出率仅56%。在此反应条件下锰的浸出率要比未施加电位时的化学溶解过程高出5倍。
2.9 苯胺还原浸出法
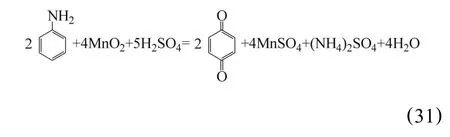
刘建本等[56]报道了日本的赤羽工厂采用苯胺作还原剂直接浸出锰的生产技术,其苯胺加入量较小,利用率高,浸出渣量少,因而过滤设备的面积也小。采用低温浸出,浸出温度控制在10~20℃,为了维持浸出温度,浸出槽中设有蛇形管,通过循环冷却水冷却,既节约了能源,又保持了良好的作业环境。浸出反应为:
2.10 苯醇还原浸出法
YAHU I ZHANG等[57]报道了以苯醇为还原剂,在硫酸气氛下浸出锰,使四价锰还原为二价锰,苯醇被氧化为对苯醌。因此,在此浸出过程中发生的氧化还原反应如下式所述:
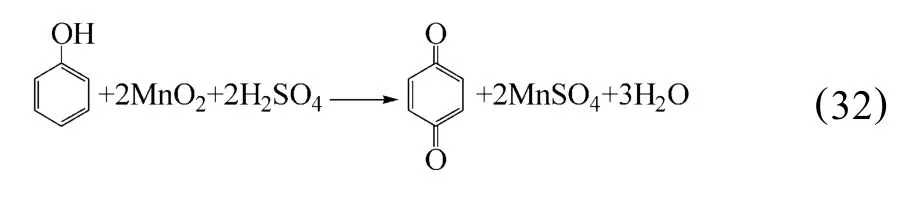
2.11 葡萄糖还原浸出法
F.Pagnanelli等[58]介绍了用葡萄糖作还原剂,在硝酸环境下浸出低品位锰矿。所用锰矿中的锰以复杂氧化物Mn7O13(6MnO2·MnO)的形式存在,并伴随有铝硅酸盐。本研究考察了温度、粒度、葡萄糖和硝酸浓度对浸出结果的影响,并与以前的硫酸环境下的反应进行了对比。其最佳工艺条件为:温度90℃,化学计量的硝酸浓度,20%以下化学计量的葡萄糖,颗粒大小为295~417μm。试剂的浓度是通过下式进行化学计量的(矿中所有锰元素均认为是四价锰):
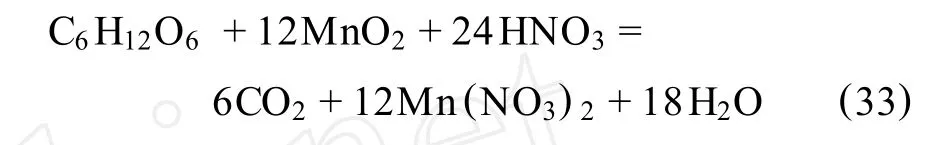
2.12 FeS2-MnO2-O2-H2O体系高温加压浸出法
Rajko.Z.V racar等[59]报道了在加压釜内高温条件下,在 FeS2-MnO2-O2-H2O体系中浸出锰的研究。此文表述了:
1)在加压釜内高温下,硫铁矿在水溶液中被氧气氧化的结果。
2)硫铁矿氧化产物FeSO4和H2SO4与软锰矿同时反应,并浸出软锰矿中Mn4+的结果。
本文说明了黄铁矿氧化和锰的高效浸出两个过程几乎能够顺利完成。
浸出过程中可能发生的反应如下:
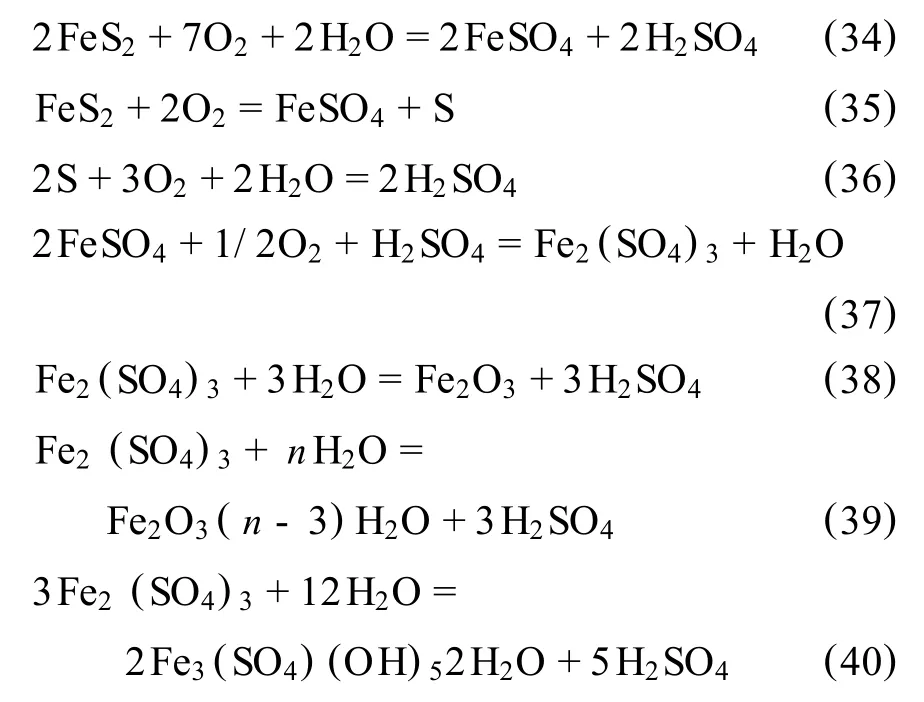
总反应式为:
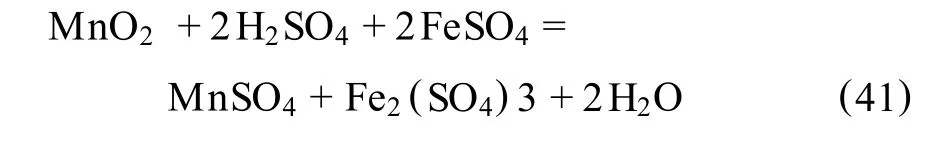
3 锰矿湿法浸出技术展望
软锰矿湿法浸出过程及其工艺的研究历经多年发展取得了丰硕的成果,而且各种工艺已实现了工业应用,但浸出过程机理的研究仍有待深入,尤其在矿物表面分子或原子级水平研究方面非常欠缺。而且,在清洁高效、技术合理、经济可行的适合处理复杂低品位锰矿的新工艺研究及其工业应用方面还有较长的一段路要走。今后应在以下几方面继续开展研究:
1)研究其他矿物成份(如黄铁矿、磁黄铁矿、黄铜矿、方铅矿等)对软锰矿浸出的影响,这对于处理复杂矿,实现选择性浸出具有指导意义;
2)加强矿物浸出过程的电化学研究,采用电化学与表面分析[60](如:STM/ETS,AFM,XPS,AES/SAM,SIMS,SAL I,RBS,RNR,SEM,TEM,LEED等)相结合的方法,研究浸出过程中锰矿的表面性质,进一步明晰浸出过程机理;
3)研究新型高效添加剂(如煤等)脱除元素硫的作用及其机理;
4)加强铁浸出控制及铁渣处理的研究,开发出适用于复杂锰矿的节能、高效、清洁的浸出新工艺;
5)探索加压浸出复杂锰矿的工艺过程及机理。
[1]谭立群.硫酸锰厂新工艺的设计[J].中国锰业,2000,18(4):33-35.
[2]杨新科.制备硫酸锰最佳工艺条件的研究[J].中国锰业,2001,19(3):15-16.
[3]周凌风.冷法浸出硫酸锰溶液[J].中国锰业,2002,20(4):20-22.
[4]李同庆.低品位软锰矿还原工艺技术与研究进展[J].中国锰业 ,2008,26(2) :4-26.
[5]贺周初,彭爱国,郑贤福,等.两矿法浸出低品位软锰矿的工艺研究[J].中国锰业,2004,22(2):35-37.
[6]丁楷如,余逊贤,等.锰矿开发与加工技术[M].长沙:湖南科学技术出版社,1991.
[7]田宗平,朱介忠,王雄英,等.两矿加酸法生产硫酸锰的工艺研究与应用[J].中国锰业,2005,23(4):4-26.
[8]袁明亮,梅贤功,陈工,等.两矿法浸出软锰矿的工艺与理论[J].中南工业大学报,1997,28(4):329-332.
[9]袁明亮,梅贤功,邱冠周,等.两矿法浸出软锰矿时元素硫的生成及其对浸出过程的影响[J].化工冶金,1998,19(19):161-164.
[10]王长兴.软锰矿直接酸浸法生产硫酸锰的工艺探讨[J].湖南有色金属,1997,13(1):45-48.
[11]卢宗柳,都安治.两矿法浸出氧化锰矿的几个工艺问题[J].中国锰业,2006,24(1):39-42.
[12]华毅超,陈国松,张红漫,等.工业硫酸锰湿法还原生产工艺[J].南京工业大学学报,2004,26(5):50-53.
[13]陈蓉,陈启明,陈金芳,等.低品位锰矿制备硫酸锰的研究[J].武汉工程大学学报,2008,30(1):20-22.
[14]张昭,刘立泉,彭少方.二氧化硫浸出软锰矿[J].化工冶金,2000,21(1):103-107.
[15]欧阳昌伦,谢兰香.锰矿湿法脱硫过程中影响连二硫酸锰生成的主要因素[J].化工技术与开发,1983,3:60-66.
[16]刘启达.高效实用的软锰矿浆脱硫新技术和流程[J].广东化工 ,1998,(2) :19-20.
[17]王强,詹海青,何建新,等.软锰矿浆烟气脱硫技术的研究与应用[J].中国锰业,2007,25(4):19-23.
[18]余逊贤.锰[Z].长沙:冶金工业部长沙黑色冶金矿山设计院,1980.
[19]朱道荣.软锰矿-硫酸亚铁的酸性浸出[J].中国锰业,1992,10(1):30-31.
[20]袁明亮,庄剑鸣,陈荩.用硫酸亚铁渣直接浸出低品位软锰矿[J].矿产综合利用,1994,(6):6-9.
[21]王德全,宋庆双.用硫酸亚铁浸出低品位锰矿[J].东北大学学报(自然科学版),1996,17(6):606-609.
[22]彭荣华,李晓湘.用钛白副产的硫酸亚铁浸锰制备高纯二氧化锰[J].无机盐工业,2006,38(12):48-50.
[23]王德全,宋庆双,彭瑞东.用硫酸亚铁浸出同时沉淀铁矾法处理低品位锰矿[J].东北大学学报(自然科学版),1998,19(2):168-170.
[24]张东方,田学达,欧阳国强,等.银锰矿中锰矿物的铁屑还原浸出工艺研究[J].中国锰业,2007,25(1):24-26.
[25]唐尚文.用闪锌矿(方铅矿)精矿催化还原软锰矿(大洋锰结核矿)制取硫酸锰[J].无机盐工业,2005,37(6):46-49.
[26]唐尚文.氧化锰矿和硫化锌/硫化铅精矿在稀酸中直接,同时浸出的方法[P].CN,1465723A.2004-01-07.
[27]杨幼平,黄可龙.植物粉料一硫酸法直接浸出软锰矿的实践[J].中国矿业,2001,10(5):54-56.
[28]邓益强,乐志文.软锰矿无煤还原制备硫酸锰新工艺研究[J].广西轻工业,2007,(10):38-40.
[29]曹柏林,黄斌.用贫软锰矿制备硫酸锰[J].湖南有色金属,2000,16(3):18-19.
[30]张小云,田学达.纤维素还原低含量软锰矿制备硫酸锰[J].精细化工,2006,23(2):195-197.
[31]刘西德,姜立夫,高灿柱,等.从废锰渣制取硫酸锰的研究[J].山东化工,1994,(2):13-15.
[32]杨明平,宋和付.酒糟一硫酸浸取锰矿尾矿中锰制备硫酸锰工艺[J].无机盐工业,2006,38(11):50-52.
[33]杨明平,宋和付,李国斌.米糠一硫酸直接浸锰工艺条件研究[J].无机盐工业,2005,37(2):30-32.
[34]D.Hariprasad,B.Dash,M.K.Ghosh,etal.Leaching of Manganese Ores using Saw dust as a Reductant[J].M inerals Engineering,2007,20(1):293-295.
[35]赵崇涛.氧化锰矿直接制备硫酸锰的研究Ⅱ-蔗渣法[J].福建师范大学学报(自然科学版),1993,9(2):54-58.
[36]S.J.M cCarroll.Treatment of Manganese Ores[P].US:3,085,875,1963.
[37]粟海锋,孙英云,文衍宣,等.废糖蜜还原浸出低品位软锰矿[J].过程工程学报,2007,7(6):89-93.
[38]李浩然,冯雅丽.微生物催化还原浸出氧化锰矿中锰的研究[J].有色金属,2001,(8):5-81.
[39]杜竹玮,李浩然.微生物还原浸出法回收废旧电池粉末中的金属锰[J].环境污染治理技术与设备,2005,(9):62-64.
[40]滕英才,马集成.两矿加浓硫酸熟化法生产硫酸锰[J].化工技术与开发,2006,35(2):1-2.
[41]B.B.Nayak,K.G.Mishra,R.K.Paramguru.Kinetics and Mechanism of MnO2Dissolution in H2SO4[J].Journal of Applied Electrochemistry,1999,29:191-200.
[42]Miller J D,Wan R Y.Reaction Kinetics for the leaching of MnO2by Sulfur Dioxide[J].Hydrometallurgy,1983,10:219-242.
[43]Asai S,Negi H,Konishi Y.Reductive Dissolution of Manganese Dioxide in Aqueous Sulfur Dioxide Solutions[J].The Canadian Journal of Chem.Eng,1986,64:237-241.
[44]A.E.Back,S.F.Ravitz,K.E.Tame.Formation of Dithionate and Sulfate in the Oxidation of Sulfur Dioxide by Manganese Dioxide and Air[J].U.S.Bureau of Mines,1952,Report Investigation 4 931.
[45]S.Asai.H.Negi,Y.Konish,Reductive Dissolution of Manganese Dioxide in Aqueous Sulfer Dioxide Solutions[J].The Canadian J.of Chem.Eng,64(4):237-242.
[46]C.Ward.Hydrometallurgical Processing of Manganese Containing Materials[P].WO:033738,2004.
[47]C.Ward.Imp roved Hydrometallurgical Processing of Manganese Containing Materials[P].WO:012582,2005.
[48]C.Ward,C.Y.Cheng,M.D.Urbani.Manganese-From Waste to High-tech Material[C].Green Processing Conference,Fremantle,WA,10-12May,2004.
[49]S.C.Das,P.K.Sahoo,P.K.Rao.Extraction of Manganese Ores by FeSO4Leaching[J].Hydrometallurgy,1992,15:35-47.
[50]Bafghi,A,Zakeri,Z1Ghasemi,etal.Reductive Dissolution of Manganese Ore in Sulfuric Acid in the Presence of Iron Metal[J].Hydro metallurgy,2008,90:207-212.
[51]Hancock,H A,Fray,D J.Use of Coal and Lignite to Dissolve Manganese Dioxide in Acidic Solutions[J].Transaction of Institution of mining and Metallurgy,Section C,1986,95:27-34.
[52]Fray,D J,Hancock,H A.Obtaining Aqueous Solutions from Insoluble Metal Oxide[P].GB:2,161,465,1986.
[53]R.N.Sahoo,P.K.Naik,S.C.Das.Leaching of Manganese from Low-Grade Manganese Ore using Oxalic Acid as Reductant in Sulphuric Acid Solution[J].Hydrometallurgy,2001,62:157-163.
[54]F.Momade,Z.Momade.Reductive Leaching of Manganese Oxide Ore in Aqueous Methanol-Sulphuric Acid Medium[J].Hydrometallurgy,1999,51:103-113.
[55]Elsherief A.E.A Study of the Electroleaching of Manganese Ore[J].Hydro metallurgy,2000,55:311-326.
[56]刘建本,陈上,鲁广.硫酸锰的生产技术及发展方向[J].无机盐工业,2005,37(9):5-7.
[57]Yahui Zhang,Qi Liu and Chuanyao Sun.Sulfuric Acid Leaching of Ocean Manganese Nodules Using Phenols as Reducing Agents[J].Minerals Engineering,2001,14(5):525-537.
[58]F.Pagnanelli,G.Furlani,P.Valentini,F.Veglio,L.Toro.Leaching of low-grade manganese ores by using nitric acid and glucose:optimization of the operating conditions[J].Hydro metallurgy,2004,75:157-167.
[59]Rajko.Z.V racar,Katarina P.Cerovic.Manganese leaching in the FeS2-MnO2-O2-H2O system at high temperature in an autoclave[J].Hydro metallurgy,2000,55:79-92.
[60]Vaughan D J,Pattrick R A D.Mineral Surfaces[M].London,UK:Champman&Hall,1995 :17-60.
