氯化锰浸出液的净化除杂研究
2011-12-31童张法陈志传郑帅飞高大明
冯 茹,童张法,陈志传,郑帅飞,高大明
(1.广西大学化学化工学院,广西南宁 530004;2.深圳市危险废物处理站有限公司,广东深圳 518049)
0 前言
我国锰矿已探明储量达6亿多吨,特点是贫、杂、细,原矿品位平均仅为23%。每年我国需进口数百万吨的富锰矿与国内的贫锰矿搭配使用。其次,锰矿矿石类型以碳酸锰矿石为主,约占总储量的73%。对于低品位碳酸锰矿石,从国内外的发展看,目前还没有一种成熟的既回收率高又环境污染少的技术[1~4]。锰在富集的同时,大量杂质常常一起浸出,如铁、钙、镁等。目前,除铁的方法主要有氧化中和法、针铁矿法、黄钾铁矾法和吸附法[5~7],其中以氧化中和法最普遍最经济。作为锰矿的主要伴生元素,锰浸出液中钙、镁的去除一直是生产上的一个难题[1],有文献报道利用盐溶解度不同通过控制温度和水分蒸发去除钙镁[8~9];也有利用钙镁离子与某些阴离子如 F-,C2O2-4,PO2-4形成难溶氟化物,沉淀分离钙镁的报道[10~11]。另外,刘洪刚[12]等采用P507和磺化煤油做萃取剂脱除钙镁。以上均见于硫酸锰溶液的研究,对于氯化锰溶液中钙、镁的去除鲜有报道。
碳酸锰是高性能磁性材料的主要原料,锰盐溶液通过碳化结晶可以制备高纯碳酸锰[1,13]。此外,碳酸锰还是生产化学二氧化锰,四氧化三锰等其他锰的氧化物和锰盐的原料。以低品位菱锰矿为原料,采用氯化铵焙烧—水浸取得到氯化锰浸出液,浸出液净化除杂后,可以用于制备高纯碳酸锰产品。
1 实验部分
1.1 实验仪器和试剂
主要仪器设备有:精密电子天平,p H计(PHS-3C),ICP-AES(V ISTA-M PX),SHZ-ⅢX型循环水式真空泵,DF-101S集热式恒温加热磁力搅拌器,精密电子天平,DHG型电热恒温鼓风干燥箱等。
实验所用菱锰矿的锰品位为26.5%,其他试剂药品有:氯化铵(工业级)、硫酸亚铁铵(AR)、N-苯代邻氨基苯甲酸(AR)、硝酸铵(AR)、二氧化锰(AR)、氨水(质量分数 10%)、氟化铵(CP)、锰粉、一水合硫酸锰(AR)、碳酸氢铵(工业级)等。
1.2 实验方法
按比例将锰矿粉与氯化铵混合研磨均匀后,置于电阻炉中焙烧。焙砂用水浸取,过滤得到氯化锰浸出液,浸出渣洗涤后的洗水返回浸出段循环利用。向浸出液中加入一定量二氧化锰,在搅拌状态下加热至80~90℃左右,反应30 min后用氨水调节溶液p H至4.0~4.5,继续搅拌30 min,过滤得到除铁后的滤液。向滤液中加入适量硫酸锰初步去除钙离子,一定条件下向滤液中加入氟化铵,沉淀脱除Ca、Mg,静置过滤得到氯化锰净化液。按比例将此净化液加入到已配制好的碳酸氢铵溶液中,碳化结晶并分离出固体粉末,洗涤,烘干后得到碳酸锰产品。实验流程见图1

图1 实验流程
2 结果与讨论
实验所用氯化锰浸出液由氯化铵与锰矿粉按质量比1.05∶1混合研磨,500℃下焙烧1 h后水浸取得到,溶液中的主要元素含量分析如表1。

表1 氯化锰浸出液中主要元素含量 g/L
2.1 浸出液水解净化除铁
浸出液中铁离子主要以+2价存在,由于 Fe(OH)3的溶度积常数比 Fe(OH)2要小得多,需将Fe2+氧化成Fe3+,通过调节溶液的pH,水解沉淀铁离子。
主要反应如下:
MnO2+2FeCl2+4HCl=MnCl2+2FeCl3+2H2O FeCl3+3H2O=Fe(OH)3↓+3HCl
采用二氧化锰做氧化剂,将 Fe2+氧化为 Fe3+,用氨水调节溶液pH至4.0~4.5,Fe3+将水解为氢氧化铁沉淀。实验确定了二氧化锰用量对铁去除率的影响。如图2,当二氧化锰用量为理论量的1.5倍时,杂质Fe可完全除尽。实验严格控制p H,减少主体金属离子锰的水解损失,除铁后的浸出液趁热过滤。
2.2 浸出液中钙和镁的脱除
在锰的浸出过程中,作为菱锰矿的主要伴生元素,杂质钙、镁大量进入浸出液。从水溶液中分离出钙、镁离子尤为困难。因此,必须找出一条合适的途径,从浸出液中有效的分离出钙、镁杂质。利用钙、镁离子和氟离子形成难溶的氟化物沉淀,可以实现钙、镁杂质和锰的分离。试验发现,单独使用氟化铵做沉淀剂时去除钙镁的效果并不理想,而采用两步除杂效果较好。由于硫酸钙为微溶物,实验先用硫酸锰沉淀出大部分的钙离子,再加入氟化铵除去镁离子和余下的钙离子。
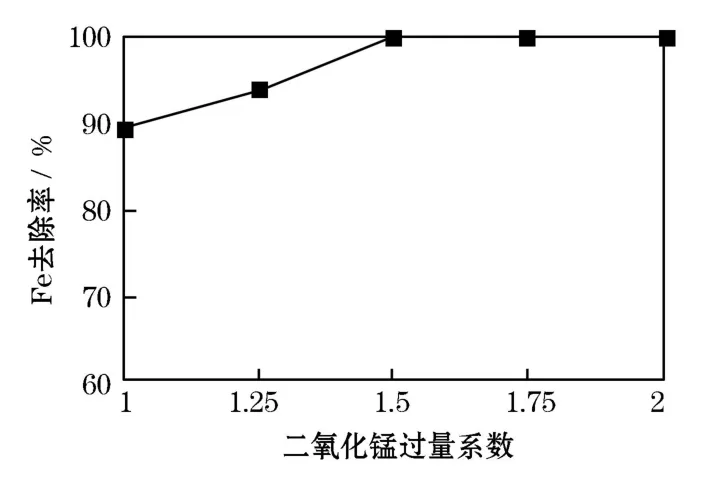
图2 二氧化锰用量对铁去除率的影响
2.2.1 硫酸锰初步除钙方法
1)称取约17 g一水合硫酸锰溶于50 mL纯水,备用。
2)取500 mL除铁后的滤液,60~80℃搅拌状态下,加入40 mL上述硫酸锰溶液于滤液中,出现大量硫酸钙沉淀,40 min后进行固液分离,得到副产硫酸钙沉淀和浅粉色氯化锰滤液;继续向此滤液中分次滴加余下的硫酸锰溶液,直至未出现硫酸钙沉淀,继续加热搅拌约30 min后,放置冷却并进行固液分离。
3)加入适量的氯化钡溶液沉淀过量的硫酸根离子。
4)硫酸锰初步除钙后,测得氯化锰溶液中Ca浓度为2.5~3.0 g/L,钙去除率为60%左右。
2.2.2 氟化铵沉淀钙和镁的优化条件
采用正交实验法,选用L9(34)正交设计表,考察氟化铵用量、体系p H及体系温度对钙去除率,镁去除率的影响。正交实验因素水平见表2,正交实验结果及结果分析见表3~4。

表2 正交实验因素水平

表3 正交实验结果
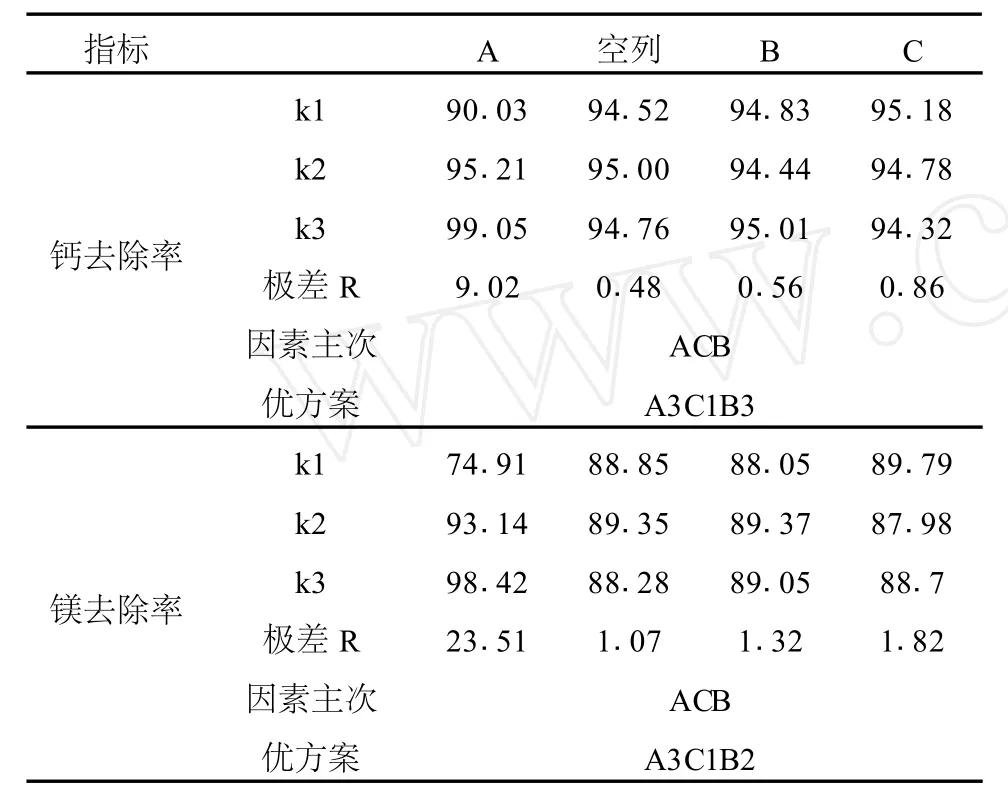
表4 正交实验结果分析
由表4可以看出,氟化铵用量对钙、镁去除率均有极显著的影响,体系p H和体系温度有一定的影响。从节约能源和满足后续碳化工艺要求的角度考虑,实验确定的最佳条件为:氟化铵用量系数为1.7,p H为5.7,温度为30℃。在最佳条件下进行验证性实验,钙和镁的去除率均达到98%以上。另外,实验还考察了反应时间的影响,反应1 h后,继续增加反应时间不能增加去除钙镁的效果;因此,反应时间取1 h。反应结束后,需静置数小时再进行固液分离。
2.3 除重金属
重金属含量过高将严重影响碳酸锰产品的性能和质量。实验所得氯化锰溶液中重金属离子有Pb,Zn。由于锰的标准电位与 Pb、Zn的标准电位之差在0.2 V以上,且 Mn的电位更负,理论上,可以采用金属锰除去溶液中的大部分重金属[14~15]。当锰粉加入量为2 g/L,80~90℃下置换反应1 h,静置48 h后过滤得到氯化锰净化液,测得置换除杂前后Pb、Zn的浓度变化见表5。
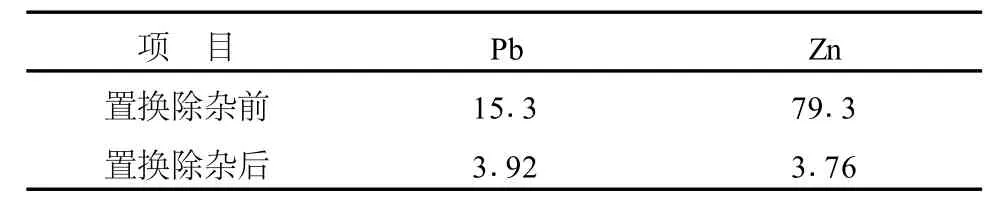
表5 置换除杂前后Pb和Zn的浓度变化 mg/L
由表5可见,Pb、Zn的去除率分别为74.4%和95.3%,满足后续碳化工艺要求。
2.4 碳酸锰的制备
除杂后的氯化锰净化液,以滴加的方式加入到浓度为1 mol/L的碳酸氢铵溶液中,35℃下搅拌反应1 h,并维持体系pH在6.8~7.2之间。静置陈化数小时,抽滤得到的碳酸锰固体经洗涤、干燥,制得合格的碳酸锰产品。
3 结论
1)氯化铵焙烧—水浸富集回收菱锰矿中的锰,经过浸出液净化除杂;净化液碳化结晶,制备出各项指标均符合化工行业标准(HG/T 2836-1997)的碳酸锰产品。
2)以MnO2做氧化剂,水解中和可以完全除去杂质Fe;重金属 Pb、Zn可用锰粉置换去除,并满足后续碳化工艺要求。
3)采用硫酸锰初步除钙,氟化铵二次除钙、镁的除杂方式,实现了锰与钙、镁的有效分离。通过正交实验确定了氟化铵除钙、镁的最佳条件:氟化铵用量系数为1.7,体系温度为30℃,体系pH为5.7。在最佳条件下,钙和镁的去除率均达到98%以上。
[1]谭柱中,梅光贵,李维健,等.锰冶金学[M].长沙:中南大学出版社,2004.
[2]袁明亮,梅贤功,庄剑鸣,等.贫锰矿的深加工与综合利用分析[J].矿产保护与利用,1994,(5):39-41.
[3]王尔贤.中国锰矿石的开采与深加工[J].电池工业,2007,12(4):268-272.
[4]张泾生.中国锰业面临的机遇和挑战[J].中国锰业,2007,25(1):1-4.
[5]张文山 ,石朝辉 ,梅光贵 . 湿法冶金(包括 Zn、Mn、Ni、Co 等)除铁的几种主要方法[J].中国锰业,2006,24(2):40-42.
[6]陈家镛.湿法冶金中铁的分离和应用[M].北京:冶金工业出版社,1991.
[7]T.T ekin,M.Bayramoglu.Kineticsof the reductionof MnO2with Fe2+ions in acidic solutions[J].Hydrometallurgy,1993,(32):9-20.
[8]Helen E.Farrah.Solubility of calcium sulfate salts in acidic manganese sulfate solutions from 30 to 105℃[J].Hydrometallurgy,2007,(86):13-21.
[9]袁明亮,邱冠周.硫酸锰溶液结晶分离硫酸镁的水系相图原理[J].中南工业大学学报,2003,31(3):212-214.
[10]沈华强,张旭.氟化沉淀法净化硫酸锌溶液中钙镁的热力学分析[J].昆明理工大学学报,2000,25(4):25-28.
[11]刘洪刚,朱国才.氟化锰沉淀脱除还原氧化锰矿浸出液中钙镁[J].矿冶 ,2007,16(4):25-28.
[12]刘洪刚,朱国才.溶剂萃取法脱除锰矿浸出液中钙镁的研究[J].中国锰业,2008,26(1):34-37.
[13]郭人民.用硫酸锰和碳酸氢铵制高纯碳酸锰[J].现代化工,1996,(9):26-28.
[14]傅献彩.物理化学[M].北京:高等教育出版社,2005.
[15]孔繁振,李军旗,杨书怀,等.氯化锰水溶液净化除杂的研究[J].贵州工业大学学报,2007,36(5):28-31.
