废铁屑还原软锰矿制备高纯硫酸锰工艺研究
2011-12-31蔡振勇易清风刘汉勇方明略龚学华符国庆
蔡振勇,易清风,刘汉勇,方明略,龚学华,符国庆
(1.湖南科技大学化学化工学院,湖南湘潭 411201;2.湘西自治州金戈锰业有限责任公司,湖南吉首 416000)
硫酸锰在锰系产品中具有重要的地位,不但在工业、农业上有着重要而广泛的用途,而且其它的锰产品大多数是通过硫酸锰生产出来的[1]。据勘察,我国低品位软锰矿的储藏量有几千万吨,由于还原技术的不成熟严重制约着软锰矿资源的开发利用,如何解决还原技术问题显得尤为重要[2]。综合国内外的研究分析,软锰矿还原制备硫酸锰分为焙烧还原法和湿法还原两大类。焙烧还原法有微波还原焙烧法[3]、硫酸化焙烧法[4];湿法还原有两矿一步法[5]、二氧化硫浸出法[6]、硫酸亚铁浸出法[7]、双氧水还原法[8]、微生物浸出法[9]、甘蔗糖蜜浸出法[10]等。此外,随着人们对硫酸锰的质量要求越来越高,高纯硫酸锰产品具有更广阔的市场前景。本文采用废铁屑作为还原剂还原软锰矿制备硫酸锰浸出液,经过中和调节p H及加入硫化剂、氟化剂等除去杂质离子、静置净化等步骤,最后浓缩结晶得到高纯一水硫酸锰。
1 实验部分
1.1 实验试剂
软锰矿由湖南湘西某公司提供,其主要成分是二氧化锰,其中还含有少量铁、钴、镍、铜、二氧化硅等。软锰矿主要成分见表1。
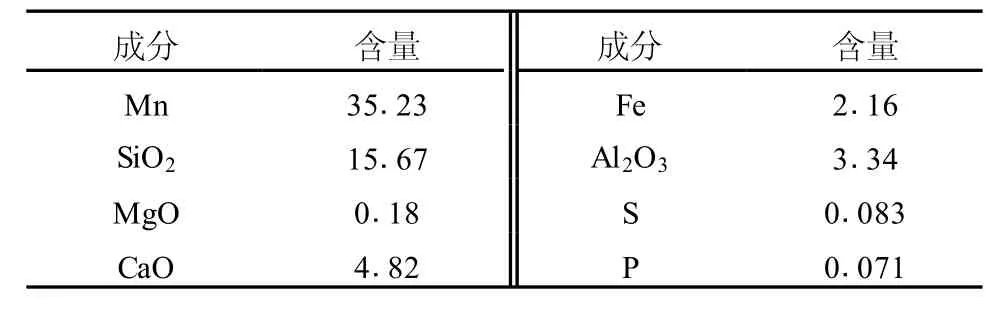
表1 软锰矿的化学成分分析 %
硫酸是市售工业级硫酸;铁屑是机械加工产生的废铁屑,使用前用热碱液(Na2CO3)浸泡0.5 h,清水冲洗后备用。
DF-1010S集热式恒温加热磁力搅拌器(巩义市予华仪器有限公司);SHZ-D循环水式真空泵(巩义市予华仪器有限公司)等。
1.2 实验原理
在酸性环境中软锰矿中的M nO2被铁屑还原为二价锰进入溶液,主要的反应方程式有:

1.3 实验方法
将软锰矿、硫酸、废铁屑按照一定的比例混合均匀后,在一定的温度下还原浸出,浸出完成后,加入碳酸钙中和调节pH值至5~6除去铁,加入硫化钡除去重金属离子,减压过滤,所得的硫酸锰粗滤液加入二氟化锰进行二次深度除杂,浓缩结晶制备高纯度一水硫酸锰晶体。按照实验方法,其工艺流程如图1。

图1 高纯硫酸锰生产工艺流程
1.4 分析方法
浸出液中M n2+的含量采用 EDTA络合滴定分析法确定。浸出液中的Fe2+离子必须氧化到Fe3+才能通过调节pH值来达到除去目的,溶液中Fe2+采用铁氰化钾溶液检验,重金属离子(主要有Ni2+、Co2+等)采用丁二酮肟试剂检验。
2 结果与讨论
2.1 Fe/MnO2的摩尔比对锰浸出率的影响
实验条件为:H2SO4/MnO2的摩尔比 n(H2SO4/MnO2)为 2.1∶1,反应温度 50 ℃,反应时间80 min,软锰矿的锰浸出率η(%)与Fe/MnO2摩尔比 n(Fe/MnO2)的关系如图2所示。

图2 Fe/MnO2摩尔比对锰浸出率影响
由图2可知,随着 n(Fe/MnO2)的增大,锰的浸出率迅速增大,当 n(Fe/MnO2)为0.78时,锰的浸出率达到95%以上,再增大其比例锰的浸出率基本保持不变。n(Fe/MnO2)对锰浸出率的影响因素主要有:
1)若 Fe与MnO2的反应按照式(5)进行,则 n(Fe/MnO2)的理论比为0.67∶1,若铁转变为亚铁离子后再与软锰矿反应,则 n(Fe/MnO2)的理论值为2.0∶1,因此适当增加铁的量有利于锰的浸出;
2)实际的反应过程中,部分铁屑与硫酸会反应而形成Fe2+,而铁与Fe2+均可以作还原剂参与反应,所以铁屑与亚铁离子同步还原软锰矿,这与实验所得的数据是一致的;
3)软锰矿中还含有少量的一氧化锰,在反应过程中不消耗铁屑而直接与硫酸反应生成硫酸锰。考虑 n(Fe/M nO2)增加时,还原能力只是略有增加而且还给下步净化造成困难,故实验确定最佳的 n(Fe/MnO2)为 0.78∶1。
2.2 H2SO4/MnO2的摩尔比对浸出率的影响
实验条件:Fe/MnO2的摩尔比 n(Fe/MnO2)为0.78∶1,反应温度50℃,浸出时间80 min,软锰矿的锰浸出率η(%)与 H2SO4/MnO2摩尔比 n(H2SO4/MnO2)的关系如图3所示。

图3 H2 SO4/MnO2摩尔比对锰浸出率影响
从图3看出,硫酸用量是影响锰浸出率的重要影响因素之一,随着硫酸用量的增加,锰浸出率迅速提高,当 n(H2SO4/MnO2)为 2.1∶1时锰浸出率达到95%以上,再增加硫酸用量,锰浸出率的变化很少。由理论分析可知,若根据反应式(5),则 n(H2SO4/MnO2)为2.0∶1,又因铁屑会消耗少量的酸,且反应溶液需要在一定的酸度下进行。考虑硫酸过多将消耗大量的中和剂并且结合图3所得实验结果,故实验确定最佳的H2SO4/MnO2的摩尔比为2.1∶1。
2.3 反应温度对浸出率的影响
实验条件:n(Fe/MnO2)为 0.78∶1,n(H2SO4/MnO2)为2.1∶1,浸出时间 80 min,软锰矿的锰浸出率η(%)与温度 T(℃)关系如图4所示。

图4 反应温度对锰浸出率影响
由图4可见,当温度小于50℃时,锰的浸出率几乎正比于温度,随温度的升高而升高,50℃时锰浸出率达到95%以上,再升高温度锰的浸出率几乎没有变化,故实验确定最佳的反应温度为50℃。
2.4 反应时间对浸出率的影响
实验条件:n(Fe/MnO2)为 0.78∶1,n(H2SO4/MnO2)为2.1∶1,反应温度50℃,软锰矿的锰浸出率η(%)与时间 t(min)关系如图5所示。

图5 反应时间对锰浸出率影响
由图5可知,当反应时间小于80 min,锰浸出率随浸出时间的延长呈现线性关系,锰浸出率提高明显,当反应时间超过80 min后锰浸出率不再随时间延长而增加,只是有稍微的变化,延长时间对浸出率便没有显著的意义,故实验确定最佳的反应时间为80 min。
2.5 中和除杂净化
浸出反应完成后,浸出液中的主要离子是M n2+和 Fe3+,溶液中还有 Co2+、Ni2+、Al3+、Fe2+、Cu2+、Pb2+等杂质离子,必须将杂质离子除去以制备高纯度的硫酸锰溶液。实验采取加入少量的双氧水[11]将少量的Fe2+离子氧化为 Fe3+离子,用铁氰化钾溶液定性检验Fe2+离子是否完全氧化为Fe3+离子,加入碳酸钙中和调节溶液的p H值至5~6,使溶液中Fe3+离子水解沉淀为氢氧化铁,同时溶液中的A l3+离子在此p H值的范围内也将生成沉淀一起除去,然后加入适量的硫化钡除去溶液中的重金属离子,其反应式为:
2Mn++n S2-=M2Sn↓
式中 Mn+——Ni2+、Co2+、Cu2+、Pb2+等重金属离子。
用丁二酮肟溶液检测溶液没有亮红色出现为反应终点,最后将溶液过滤得到硫酸锰的粗滤液,滤液颜色为粉红色。
2.6 硫酸锰粗滤液的深度除杂净化
经上步中和除杂净化后的溶液中还含有较多的Ca2+、M g2+等离子,必须进一步除去。向所得硫酸锰的粗滤液加入二氟化锰继续反应30 min,以除去溶液中Ca2+和Mg2+。其主要反应式为:
Ca2++2F-=CaF2↓
Mg2++2F-=M gF2↓
Ca2+、Mg2+和 F-形成难溶的氟化物沉淀,混合物须静置后过滤,得到高纯度硫酸锰溶液。
2.7 浓缩结晶
硫酸锰是一种水溶性的盐,易溶于水,在水中的溶解度特殊。根据文献可知[12],当硫酸锰溶液的温度小于50℃时,硫酸锰的溶解度随着温度的升高而升高,超过此温度反而随温度的升高而降低,溶液温度超过50℃时,结晶出来的晶体为一水硫酸锰,呈玫瑰红色,单斜晶系。纯水中硫酸锰的溶解度,50℃时为 58 g/100 g,80℃为 48 g/100 g,90℃为 42 g/100 g,100℃为34 g/100 g。将净化后的溶液在85~90℃的范围内浓缩结晶,结晶后即进行热过滤,得到高纯一水硫酸锰固体,母液返回后再次浓缩结晶,所得高纯一水硫酸锰的品质分析见表2。
3 结论
1)采用废铁屑作为还原剂在酸性环境中从软锰矿中浸出制备硫酸锰,该工艺流程简单,条件温和。我国拥有丰富的软锰矿资源,开发从软锰矿中高效浸出锰工艺,为锰系产品的可持续发展开辟了新的途径,对缓解市场需求的紧张局面具有积极作用。

表2 高纯硫酸锰的化学成分分析 %
2)本文通过单因素实验确定了浸出的最佳工艺条件:n(Fe/M nO2)为 0.78∶1,n(H2SO4/MnO2)为2.1∶1,反应温度 50℃,反应时间 80 min,在此工艺条件下锰浸出率在95%以上。
3)采用硫化钡除去钴、镍等重金属离子,二氟化锰除去钙、镁等离子,经过两步除杂和结晶分离后,得到高纯度一水硫酸锰固体,产品质量优于国家标准。
4)以该工艺为基础,可以电解制备二氧化锰,高纯碳酸锰等锰系列产品。
[1]谭柱中,梅光贵,李维健,等.锰冶金学[M].湖南:中南大学出版社,2004,667-679.
[2]李同庆.低品位软锰矿还原工艺技术与研究进展[J].中国锰业,2008,26(2) :4-14.
[3]王海川,周云,吴宝国,等.微波辅助加热氧化锰矿还原动力学研究[J].中国稀土学报,2004,22(专辑):212-215.
[4]白玉兴,张振伟,姜润田,等.中贫品位软锰矿直接还原为硫酸锰工艺研究[J].无机盐工业,2001,33(6):6-7.
[5]袁明亮,梅贤功,陈工,等.两矿法浸出软锰矿的工艺与理论[J].中南工业大学学报,1997,28(4):329-332.
[6]王强,詹海青,何建新,等.软锰矿浆烟气脱硫技术的研究与应用[J].中国锰业,2007,25(4):19-23.
[7]Das S C,Sahoo P K,Rao P K.Extraction of manganese from low-grade manganese Ores by FeSO4leaching[J].Hydrometallurgy,1982,8(1):35-47.
[8]Zhang Wensheng,Cheng Chuyong.Manganese metallurgy review.Part I:Leaching of ore/secondary materiales and recovery of electrolytic/chemical manganese dioxide[J].Hydrometallurgy,2007,89(3/4):137-159.
[9]李浩然,冯雅丽.微生物催化还原浸出氧化锰矿矿中锰的研究[J].有色金属,2001,53(3):5-8.
[10]粟海峰,孙英云,文衍宣,等.废糖蜜还原浸出低品位软锰矿[J].过程工程学报,2007,7(6):1089-1093.
[11]华毅超,陈国松,张红漫,等.工业硫酸锰湿法还原生产工艺[J].南京工业大学学报,2004,26(5):50-53.
[12]袁明亮,梅贤功,姜涛.结晶法分离MnSO4和MgSO4的若干问题讨论[J].中国锰业,1997,15(3):40-43.
