连续流发酵条件下不同发酵类型产氢细菌的产氢特性分析
2011-12-26张露思任南琪郑国香
张露思,任南琪,高 磊,郑国香,3
(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090;
2.哈尔滨工业大学建筑设计研究院,黑龙江 哈尔滨 150090;
3.东北农业大学农业工程中心,黑龙江 哈尔滨 150030)
连续流发酵条件下不同发酵类型产氢细菌的产氢特性分析
张露思1,2,任南琪1,高 磊1,郑国香1,3
(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090;
2.哈尔滨工业大学建筑设计研究院,黑龙江 哈尔滨 150090;
3.东北农业大学农业工程中心,黑龙江 哈尔滨 150030)
运用连续流实验装置,考察了E.harbinenseYUAN-3,C.butyricum1.209和E.cloacae1.2022在其各自的优化培养基条件下产氢能力.对反应体系pH值、累积产气及产氢量、产氢速率、比产氢速率及液相末端产物进行了对比分析.结果表明:C.butyricum1.209的繁殖速度很快,pH值在3.6~4.3之间,有利于乙醇发酵和丁酸发酵产氢细菌的释氢;发酵80h的时间里,E.harbinenseYUAN-3在最短的时间内开始产气,并且在较短时间内上升,随后保持稳定;从单位体积产氢量上来看,C.butyricum1.209相对于E.harbinenseYUAN-3和E.cloacae1.2022都显示较强的优势.
生物制氢;乙醇发酵;丁酸发酵;混合酸发酵
有机废水厌氧发酵法生物制氢是利用两相厌氧生物处理工艺中的产酸相作为制氢单元,从有机废水中制取氢气,达到集生物制氢和有机废水处理为一体的双重功效.有机废水的产酸发酵主要存在4种发酵类型:乙醇发酵,丙酸发酵、丁酸发酵和混合酸发酵[1-5].普遍认为,废水厌氧生物处理过程中出现的主要问题之一是启动过程常难于控制[6],发酵法生物制氢反应器作为两相厌氧系统的产酸相,同样面临着启动过程慢,目标发酵产物具有一定的不确定性等问题,因此启动过程完成后有可能形成上述3种发酵类型中的任何一种.而不同的发酵类型其产氢能力存在较大差异,即发酵类型将直接影响系统的产氢能力.
连续流生物制氢反应器的产氢效能,在很大程度上取决于反应器所形成的发酵类型,而反应器形式的发酵类型与反应器启动时对生态因子的调控有很大的关系[7-8].对于生物制氢反应器来说,启动时反应器运行的第一步是关键的一步,不同的启动方式可以决定不同微生物菌群的结构和功能,进而演替成不同的顶级群落并形成不同的发酵类型,影响反应器运行的效果.目前,在启动生物制氢反应器的过程中,宫曼丽博士通过生态因子的调控[9],确定了启动时的各项生态因子参数,以此作为依据,可以做到反应器定向启动,实现乙醇发酵、丁酸发酵、混合酸发酵等,但依然面临启动周期长、产氢能力提高缓慢等问题,因此快速高效的启动生物制氢反应器对于工程应用具有重要意义.
本文以E.HarbineseYUAN-3,C.butyricum1.209和E.cloacae1.2022为代表菌株,在其各自的优化培养基条件下,运用连续流实验装置,分别对乙醇发酵、丁酸发酵和混合酸发酵产氢细菌的产氢能力进行对比分析,以便更全面的了解这3种代谢类型发酵、生长及其他优良性能.
利用葡萄糖(20g/L)作为底物,厌氧发酵装置内装入2.5L的发酵液及适量污泥,按反应溶液体积的10%分别接种三株产氢细菌,在非灭菌条件下进行氢气生产的连续培养实验.发酵液中添加适量的微量元素和维生素等物质,发酵时间为80h,温度为(35±1)℃,培养液流速是625mL/h,利用pH=6的磷酸盐缓冲溶液调节发酵液的pH值,使进水pH值控制在6.0~6.5.
1 实验菌种及接种污泥
1.1 实验菌种
乙醇发酵产氢细菌为哈尔滨产乙醇杆菌E.HarbineseYUAN-3,来源于哈尔滨工业大学环境生物技术研究中心;丁酸发酵产氢细菌为丁酸梭菌C.butyricum1.209,来源于中科院菌种保藏中心;甲酸型产氢细菌为阴沟肠杆菌E.cloacae1.2022,来源于中科院菌种保藏中心.
1.2 接种污泥
接种污泥来自哈尔滨文昌污水处理厂二沉池,先用糖蜜废水及少量的N和P曝气培养,使生物量增加.当污泥接种量为6.5g/L时,投加到发酵罐中进行连续流产氢试验.
2 实验装置与实验方法
2.1 实验装置
连续流实验装置采用离位灭菌玻璃发酵罐进行批次培养试验.
2.2 实验方法
葡萄糖浓度测定采用葡萄糖氧化法试剂盒(GOD-PAP);pH值测定采用pH计测定(Cyberscan,Model 510);氢气含量测定采用上海分析仪器厂生产的SC-Ⅱ型气相色谱仪,热导池检测器,不锈钢柱,柱长与直径尺寸为2m×5mm,载体为 TDS-01(3.33×105~3.33×105nm),载气为 N2,流速为70mL/min,室温测定,进样量为500μL.
液相末端产物测定采用上海分析仪器厂生产的GC122型气相色谱仪,不锈钢柱,柱长为2m(内径为5mm),载体为GDX103(3.33×105~3.33×105nm),氢火焰监测器,汽化室为200℃,柱温为190℃,检测室温度为240℃,载气为N2,N2流速为50mL/min,氢气流速为50mL/min,空气流速为500mL/min.取1mL培养液,加入6mol/L HCl 1~2滴,在5 000rpm下离心15min,取上清液2μL进样检测.
3 结果与讨论
3.1 发酵过程中pH的对比
发酵液的pH变动情况是衡量反应系统产氢状态的一个很关键的指标,它的波动将直接反映出产氢体系的运行状况.图1为发酵液的pH曲线波动图,E.HarbineseYUAN-3,C.butyricum1.209 和E.cloacae1.2022在发酵启动和运行初期的24h内,发酵液的pH变动均较大,分别从最初的6.1,5.5和5.9降到了4.2,4.2和3.4.
由于输入的新鲜培养液里有磷酸盐缓冲液的调节,使E.HarbineseYUAN-3和C.butyricum1.209反应体系的pH控制在3.6~4.3之间,这一pH范围有利于乙醇发酵和丁酸发酵产氢细菌的释氢.而对照E.cloacae1.2022的pH曲线变化趋势显示,在发酵24h内pH下降到3.5,波动范围也较大,在2.9~3.9之间波动.
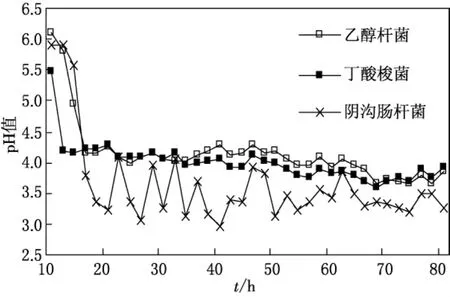
图1 连续流培养条件下不同发酵类型产氢菌pH变化曲线
3.2 单位体积产气量和产氢量的对比
获得发酵产氢性能优良及具有高效、稳定生产氢气的产氢菌是比较3种代谢途径的主要目的,而鉴定哪一种代谢类型的产氢细菌具有高产氢能力的最直接指标是参考其氢气的产量.图2给出乙醇发酵产氢细菌E.HarbineseYUAN-3、丁酸发酵产氢细菌C.butyricum1.209和混合酸发酵产氢细菌E.cloacae1.2022连续培养条件下的单位体积产气量的变化曲线图,从接入产氢细菌后的10h左右,产氢细菌需要利用现有的发酵营养物质进行大量的繁殖,为产氢做好充分的准备,因此,这段时间几乎未监测到有气体生成.随着菌体繁殖的继续进行,开始逐渐监测到氢气(见图3),但气体总量还很小,随后逐渐加大.

图2 连续流培养条件下不同发酵类型产氢菌单位体积产气量变化曲线

图3 连续流培养条件下不同发酵类型产氢菌单位体积产氢量变化曲线
当发酵培养24h时开始进行培养液的输入和发酵液的排出,从而开始连续流培养阶段.由于菌体不断获得新鲜营养液,代谢逐渐旺盛,累积产气和产氢呈现持续递增趋势.在发酵进行到第28小时开始,E.HarbineseYUAN-3,C.butyricum1.209和E.cloacae1.2022开始产氢,并且C.butyricum1.209的释氢能力更强一些,迅速上升到2.46mmol/L时,开始趋于稳定.当发酵结束时,E.HarbineseYUAN-3的单位体积产气量和产氢量分别达到2.67和1.57mmol/L;C.butyricum1.209的发酵产气曲线显示,产气的初始时间为28h,延后于E.HarbineseYUAN-3,进入连续培养后,产气逐渐加大,发酵80h时,单位体积产气量和产氢量分别为2.57和1.90mmol/L;E.cloacae1.2022的发酵曲线显示,产气初始时间也是28h,跟C.butyricum1.209产气时间一样,但其产气量却远远小于C.butyricum1.209,上升速度也较C.butyricum1.209缓慢,当反应结束时,单位体积产气量和产氢量分别达到2.04和0.82mmol/L.发酵80h的时间里,E.HarbineseYUAN-3在最短的时间内开始产气,并且在较短时间内上升并且保持稳定,但从产氢量上来看,C.butyricum1.209的产氢量较E.HarbineseYUAN-3高.
3.3 单位体积产氢速率和比产氢速率的对比
单位体积产氢速率和比产氢速率是衡量反应体系的产氢性能的关键指标,其中,比产氢速率也叫氢气生产速率,是表明菌种转换底物为氢的能力大小的重要参数.图4和5显示了连续培养状态下,E.HarbineseYUAN-3,C.butyricum1.209和E.cloacae1.2022单位体积产氢速率和比产氢速率的变动曲线.
结果表明,在运行初始的0~24h阶段,三株产氢菌的比产氢速率较低,处于0~0.59(n(H2)/n(葡萄糖)).随着培养时间的增加,单位体积产氢速率和比产氢速率显示快速增长的趋势,培养24~34h阶段,其单位体积产氢速率和比产氢速率都迅速上升,此时E.HarbineseYUAN-3,C.butyricum1.209和E.cloacae1.2022的单位体积产氢速率分别达到了48.09,39.75和26.07mmol/L·h;比产氢速率分别达到了5.5,5.29和2.48(n(H2)/n(葡萄糖)).进入连续培养阶段后,新鲜营养液的输入引起C.butyricum1.209的单位体积产氢速率产生波动,趋于快速上升的势头.发酵40h时,单位体积产氢速率和比产氢速率分别获得最大值,即87.60和5.90(n(H2)/n(葡萄糖)).随着反应体系的继续,单位体积产氢速率呈现逐渐下降的趋势,但比产氢速率变化不大,即C.butyricum1.209的比产氢速率在连续培养阶段波动范围在5.0~5.9(n(H2)/n(葡萄糖))之间.
E.HarbineseYUAN-3连续培养过程中,单位体积产氢速率和比产氢速率的变化曲线结果显示,最初的24h发酵时间里,E.HarbineseYUAN-3产生很少的气体,随着培养时间的继续进行,菌体代谢逐渐加强,产气增加,单位体积产氢速率和比产氢速率也逐渐增加,培养32h时,E.HarbineseYUAN-3的单位体积产氢速率和比产氢速率分别为24.03和2.14(n(H2)/n(葡萄糖)),基础阶段的产氢及产氢速率稍低于C.butyricum1.209.进入连续培养后,E.HarbineseYUAN-3的单位体积产氢速率和比产氢速率都出现一定程度的波动,发酵时间为44h时获得最大比产氢速率和单位体积产氢速率,分别为5.29(n(H2)/n(葡萄糖))和72.42mmol/L·h.随着发酵体系的逐渐稳定,单位体积产氢速率逐渐降低,比产氢速率在4.17~4.95(n(H2)/n(葡萄糖))范围内波动.E.cloacae1.2022在连续培养过程中,最初的30h发酵时间里,E.cloacae1.2022几乎没有H2产生,随着培养时间的继续进行,菌体代谢逐渐加强,产气逐渐增加,单位体积产氢速率和比产氢速率也逐渐增加,培养34h时,E.cloacae1.2022的单位体积产氢速率和比产氢速率分别为20.67和1.34(n(H2)/n(葡萄糖)),基础阶段的产氢及产氢速率明显低于E.HarbineseYUAN-3和C.butyricum1.209.进入连续培养后,E.cloacae1.2022的单位体积产氢速率和比产氢速率都出现一定程度的波动,发酵时间为50h时获得最大比产氢速率和单位体积产氢速率,分别为2.63(n(H2)/n(葡萄糖))和37.66mmol/L·h.随着发酵体系的逐渐稳定,单位体积产氢速率逐渐降低,比产氢速率在2.34~2.63(n(H2)/n(葡萄糖))范围内波动.

图4 连续流培养条件下不同发酵类型产氢菌单位体积产氢速率变化曲线
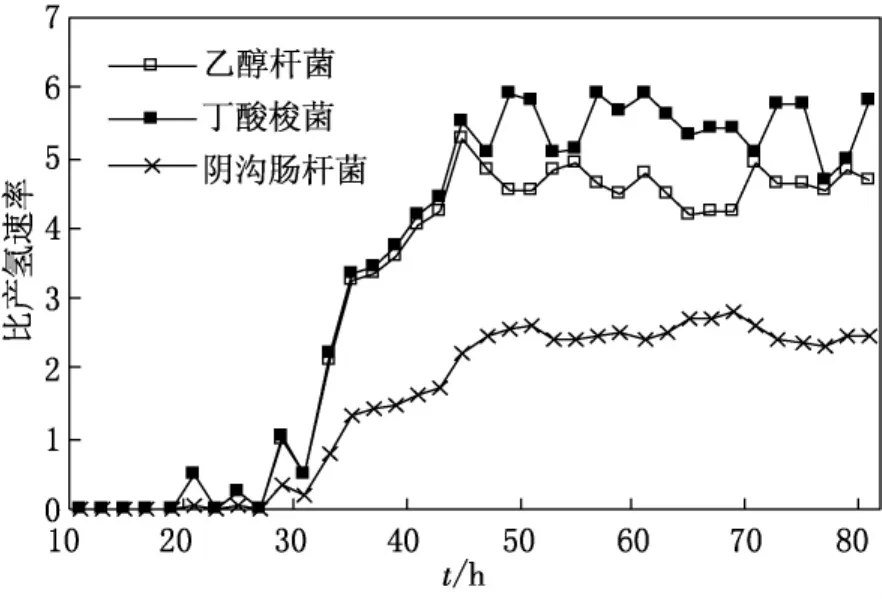
图5 连续流培养条件下不同发酵类型产氢菌比产氢速率变化曲线
3.4 液相末端产物的变化
3种产氢细菌的代谢类型差异直接影响到其发酵性能,图6—8显示的是乙醇发酵产氢细菌E.HarbineseYUAN-3、丁酸型发酵产氢细菌C.butyricum1.209和混合酸发酵产氢细菌E.cloacae1.2022连续培养液相末端产物的变化曲线图,在前期的0~24h内,三株菌的挥发酸总量变化都不大,在一定范围内波动,发酵24h时三者的挥发酸总量迅速上升,分别达到1 155,1 147和1 852mg/L.进入连续培养阶段,挥发酸总量继续增加,在24~40h,C.butyricum1.209的挥发酸总量增加幅度较大(见图7),C.butyricum1.209平均增加速度为74mg/L·h,高于E.HarbineseYUAN-3的平均增长速度(62mg/L·h)和E.cloacae1.2022的平均增长速度(61mg/L·h).40h以后反应体系的挥发酸总量在1 466~2 510mg/L之间波动,挥发酸总量最大值(2 510mg/L).相比之下,E.HarbineseYUAN-3的挥发酸在发酵时间为40h时获得最大值(2 157mg/L),E.cloacae1.2022的挥发酸在发酵时间为42h时获得最大值(2 947mg/L).

图6 连续流培养条件下乙醇发酵产氢细菌E.Harbinese YUAN-3液相末端产物变化曲线

7 连续流培养条件下丁酸发酵产氢细菌C.butyricum1.209液相末端产物变化曲线
液相末端产物总量的大小反映产氢运行体系的菌群代谢状况,而它的具体组成种类和比例将反映出产氢运行体系的代谢类型.根据图6分析,发现乙醇和乙酸仍然是E.HarbineseYUAN-3的主要液相末端产物,在反应运行前期,即0~10h阶段,乙醇和乙酸的浓度逐渐增加,乙酸的浓度略比乙醇高,但随着菌体代谢的逐渐增强,葡萄糖利用率加快,生物量也逐渐增加,乙醇的浓度逐渐大于乙酸.发酵24h时,乙醇和乙酸的摩尔浓度比值达到1.68.当进入连续培养阶段后,乙醇和乙酸的质量浓度分别在752~1 531mg/L和496~815mg/L之间变动,乙醇和乙酸的摩尔浓度比值维持在1.47~3.22之间.C.butyricum1.209的液相末端产物的组成除乙醇和乙酸外,还监测到少量浓度的丙酸和大量的丁酸(见图7).发现丁酸和乙酸是C.butyricum1.209的主要液相末端产物,在反应运行前期,即0~10h阶段,丁酸和乙酸的浓度逐渐增加,乙酸的浓度略比丁酸高,但随着菌体代谢的逐渐增强,葡萄糖利用率加快,生物量也逐渐增加,丁酸的浓度逐渐大于乙酸.发酵30h时,丁酸和乙酸的摩尔浓度比值达到2.62.当进入连续培养阶段后,丁酸和乙酸的质量浓度分别在735~1 531mg/L和403~853mg/L之间变动,丁酸和乙酸的摩尔浓度比值维持在1.37~2.44之间.E.cloacae1.2022的液相末端产物主要以乙酸和甲酸为主,并有少量的乙醇、丙酸和丁酸.在反应运行前30h阶段,甲酸的浓度逐渐增加,此时乙酸和丙酸的浓度略比甲酸高,但随着菌体代谢的逐渐增强,葡萄糖利用加快,生物量也逐渐增加,甲酸的浓度逐渐大于乙酸,丙酸含量逐渐下降.发酵30h时,甲酸和乙酸的摩尔浓度比值达到1.14.当进入连续培养阶段后,甲酸和乙酸的质量浓度分别在735~1 421mg/L和474~802mg/L之间变动,甲酸和乙酸的摩尔浓度比值维持在1.33~3.23之间.

图8 连续流培养条件下混合酸发酵产氢细菌E.cloacae 1.2022液相末端产物变化曲
4 小结
本章主要考察了乙醇发酵产氢细菌E.HarbineseYUAN-3、丁酸发酵产氢细菌C.butyricum1.209和混合酸发酵产氢细菌E.cloacae1.2022在其各自的优化培养基条件下,运用连续流实验装置,分别对乙醇发酵、丁酸发酵和混合酸发酵产氢细菌的产氢能力进行对比分析并得到如下结论:
(1)E.HarbineseYUAN-3,C.butyricum1.209和E.cloacae1.2022在发酵启动和运行初期的24h内,发酵液的pH 变动均较大,分别从最初的6.10,5.46和5.90降到了4.16,4.23和3.37,pH 在3.6~4.3范围内有利于乙醇发酵和丁酸发酵产氢细菌的释氢.
(2)发酵80h的时间里,E.HarbineseYUAN-3的在最短的时间内开始产气,并且在较短时间内上升并且保持稳定.在运行初始的0~24h阶段,三株产氢菌的比产氢速率较低,处于0~0.59(n(H2)/n(葡萄糖))范围内.随着培养时间的增加,单位体积产氢速率和比产氢速率显示快速增长的趋势,培养24~34h阶段,其单位体积产氢速率和比产氢速率都迅速上升.E.cloacae1.2022基础阶段的产氢及产氢速率明显低于E.HarbineseYUAN-3和C.butyricum1.209.
(3)3种产氢细菌在前期的0~24h内的挥发酸总量变化都不大,发酵24h时三者的挥发酸总量迅速上升,在24~40h这一阶段,C.butyricum1.209的挥发酸总量增加幅度较大,40h以后反应体系的挥发酸总量在1 466.11~2 510.68mg/L之间波动,挥发酸总量最大值为2 510.68mg/L.相比之下,E.HarbineseYUAN-3的挥发酸在发酵时间为40h时获得最大值为2 157.64mg/L,E.cloacae1.2022的挥发酸在发酵时间为42h时获得最大值为2 947.93mg/L.
[1] REN N Q,WANG B Z.Ethanol-type fermentation form carbohydrate in high rate acidogenic reactor[J].Biotechnology and Bioengineering,1997,54(5):428-433.
[2] ZHAO XIN,XING DEFENG,ZHANG LU,et al.Characterization and overexpression of a[FeFe]-hydrogenase gene of a novel hydrogen-producing bacterium ethanoligenens harbinense[J].International Journal of Hydrogen Energy,2010,35:9598-9602.
[3] N REN,T XIE,D XING.Composition of extracellular polymeric substances influences the autoaggregation capability of hydrogen-producing bacterium ethanoligenens harbinense[J].Bioresour Technol,2009,100:5109-5113.
[4] LEE D Y,LI Y Y,OH Y K,et al.Effect of iron concentration on continuous H2production using membrane bioreactor[J].Int J Hydrogen Energ,2009,34:1244-1252.
[5] COHEN A,GEMERT J M,R ZOEREMEYER J,et al.Breure main characteristics and stoichiometric aspects of acidogenesis of soluble carbohydrate containing wastewater[J].Proc Biochem,1984,19(6):228-232.
[6] LEE DY,LI YY,OH Y K,et al.Effect of iron concentration on continuous H2production using membrane bioreactor[J].Int J Hydrogen Energy,2009,34:1244-1252.
[7] SKONIECZNY MT,YARGEAU V.Biohydrogen production from wastewater by clostridium beijerinckii:effect of pH and substrate concentration[J].Int J Hydrogen Energy,2009,34:3288-3294.
[8] HSIAO C L,CHANG J J,WU J H,et al.Clostridium strain co-cultures for biohydrogen production enhancement from condensed molasses fermentation solubles[J].Int J Hydrogen Energy,2009,34:7173-7181.
[9] 宫曼丽.连续流生物制氢反应器的定向启动及群落演替规律[D].哈尔滨:哈尔滨工业大学,2006:108-120.
Effects of factors on fermentative hydrogen producing bacteria of different types by continuous flow test
ZHANG Lu-si1,2,REN Nan-qi1,GAO Lei1,ZHENG Guo-xiang1,3
(1.State Key Laboratory of Urban Water Resource and Environment,Harbin Institute of Technology,Harbin 150090,China;
2.The Architectural Design and Research Institute,Harbin Institute of Technology,Harbin 150090,China;
3.The Centre of Agricultural Engineering,Northeast Agricultural University,Harbin 150030,China)
Continuous flow test device was adopted so that analyses and comparisons were made on the hydrogen-generating capacity ofE.harbinenseYUAN-3,C.butyricum1.209andE.cloacae1.2022 under their respective optical culture conditions.The following conclusion was arrived at through analyses and comparisons on biomass of cells,pH value of reaction system,accumulated volume of gases and hydrogen generated,hydrogen-generating speed,specific hydrogen-generating speed,and products at the end of liquid phase:C.butyricum1.209multiplied rapidly;pH value within 3.6~4.3 was beneficial for the hydrogen-release of alcoholic fermentative bacteria and butyric acid fermentative bacteria;E.harbinenseYUAN-3began to generate gases within the shortest time in the first 80hof fermentation,and the yield of gases rose within a short time and then it kept stable;however,C.butyricum1.209was superior toE.harbinenseYUAN-3andE.cloacae1.2022in hydrogen yield per unit volume,utilization rate of glucose and hydrogen content.
biohydrogen production;ethanol-type fermentation;butyric acid fermentative;mixed acid fermentative
X 322
610·10
A
1000-1832(2011)03-0106-06
2011-05-26
城市水循环过程中污染物转化规律与安全保障基础研究项目(50638020);中国博士后科学基金资助项目(AUGA41309045);黑龙江省博士后基金资助项目(AUGA41100165).
张露思(1981—),女,博士研究生,讲师,主要从事生物制氢研究;通信作者:郑国香(1972—),女,副研究员,主要从事生物能源利用与转化研究.
石绍庆)
