海洋卡盾藻日本株过氧化氢产生的影响因素
2011-12-21陈文静江天久暨南大学赤潮与水环境研究中心广东广州5063华南师范大学生命科学学院广东广州50630
江 涛,陈文静,吴 霓,江天久,* (.暨南大学赤潮与水环境研究中心,广东 广州 5063;.华南师范大学生命科学学院,广东 广州 50630)
海洋卡盾藻日本株过氧化氢产生的影响因素
江 涛1,陈文静2,吴 霓1,江天久1,2*(1.暨南大学赤潮与水环境研究中心,广东 广州 510632;2.华南师范大学生命科学学院,广东 广州 510630)
对海洋卡盾藻日本株(Chattonella marina Japan,CMJP)在不同盐度、营养盐条件及不同生长期的过氧化氢产生特点进行了研究.结果表明:H2O2浓度峰值出现在CMJP对数生长期(4~8d),以第6d达到最大,为0.97×10-4nmol/cell.在N:P为8:1和16:1的情况下,CMJP生长较快,藻细胞在对数生长末期之前一直保持较高密度.CMJP产生的H2O2量与藻类生长呈现出一定的相反趋势,在藻细胞适宜生长的N:P下,产生的H2O2浓度较小.在N:P为16:1时单个藻细胞的H2O2量最低(0.40×10-4nmol/cell),仅是N:P为32:1时(1.17 ×10-4nmol/cell)的1/3,N:P为8:1时,单个藻细胞的H2O2浓度为0.63 ×10-4nmol/cell. CMJP在盐度为20,25psu时生长较好且藻细胞达到较高密度,在盐度为10,15,30psu时藻密度较低,表明低盐和高盐条件均不利于CMJP的生长.盐度对 CMJP过氧化氢的产量有一定的影响,在高盐度下单个藻细胞的H2O2产量增加,盐度为30psu时,H202浓度最高(1.1×10-4nmol/cell).
海洋卡盾藻;过氧化氢;活性氧
海洋卡盾藻(Chattonella marina)属于针胞藻门(Rhaphidophyceae),卡盾藻属(Chattonella),为单细胞藻类.自1964年在日本濑户内海首次出现后, 海洋卡盾藻赤潮时有发生,是日本海域的主要有害赤潮藻.我国首次记载的海洋卡盾藻赤潮发生于1991年3月大鹏湾盐田海域[1],随后该藻赤潮在广东沿海频繁爆发.目前海洋卡盾藻已成为我国南方重要的有害赤潮原因种,该藻赤潮发生频率逐渐增加,范围不断扩大,危害日益严重,已经成为近海渔业生产的巨大威胁.
针胞藻门赤潮藻均能产生ROS,其中卡盾藻属ROS产生效率最高[2],而ROS被证实是导致鱼类死亡的关键因素之一[3-5].Twiner等[6]指出,赤潮异湾藻产生的ROS能够改变鱼鳃的结构和功能,导致鱼类窒息而亡.另外,ROS也会影响鱼类的酶活性,如鲱鱼接触到海洋卡盾藻后次级腮小叶的碳水化酶的活性显著降低[7].Oda等[8]研究表明,海洋卡盾藻向水体中释放 H2O2的量和藻细胞内H2O2浓度及生长阶段均存在一定的关系,以对数生长期H2O2产量最大[8-9],但有关影响海洋卡盾藻 H2O2产生的因素研究尚不够深入.为进一步探索海洋卡盾藻对鱼的毒性机制,本文对海洋卡盾藻(日本株)在不同生长阶段,盐度,营养条件下过氧化氢的产生特点进行了研究,以期为海洋卡盾藻赤潮灾害的预防和控制提供参考.
1 材料与方法
1.1 仪器和试剂
实验所需仪器主要包括:荧光分光光度计(USA).
实验所需试剂主要包括:30%过氧化氢溶液(生化试剂,International lab,USA),对羟基苯甲酸(Alfa, USA),辣根过氧化物酶(Sigma, USA),过氧化氢酶(2-5000U/mg,Sigma, USA),95%4-甲氧基苯甲醛(上海试剂一厂),其他试剂均为国产分析纯.
1.2 藻种培养
海洋卡盾藻日本株(Chattonella marina Japan strain, CMJP)由香港城市大学Doris Au教授惠赠.自然海水经0.45µm微孔滤膜过滤,在120℃下高温灭菌20min,冷却到室温.CMJP以f/2培养液进行培养.取对数生长末期的CMJP,以1:4的比例接种于三角瓶中,置于人工气候箱中,培养温度25℃,光照强度为3000lx,光暗循环L:D=12h:12h.以下实验除注明外,培养条件与此相同.
1.3 实验方法
1.3.1 试剂配制 辣根过氧化物酶溶液(1000U/mL):取辣根过氧化物酶5.0mg,溶于1mL超纯水中,4℃避光保存.
过氧化氢酶溶液:取过氧化氢酶 10.0mg,溶于1mL超纯水中,4℃避光保存.
对羟基苯甲酸(PHPA)溶液(1.5mmol/L):称取对羟基苯甲酸0.023g溶解至100mL,4℃避光保存.
过氧化氢溶液(0.1mol/L):取 30%过氧化氢溶液1.0mL,稀释至10.0mL,避光保存.
1.3.2 海洋卡盾藻日本株过氧化氢检测的有效性 过氧化氢测定方法采用对羟基苯甲酸法[10].在辣根过氧化物酶和过氧化氢酶的催化下,过氧化氢将 PHPA氧化成荧光二聚体(PHPA)2.在激发波长(Ex)为 320nm下,对发射波长(Em)范围400~600nm内进行扫描,确定最大发射波长.
为了验证CMJP是否产生过氧化氢和PHPA方法对其检测的有效性,首先对处于对数生长期的CMJP进行过氧化氢的测定.取1mL藻细胞培养液于10mL试管中,依次加入2mL 1.5mmol/L的PHPA溶液,30μL辣根过氧化物酶溶液,在过氧化氢酶存在或缺少时分别测定30s内荧光光谱.
1.3.3 过氧化氢标准曲线的测定 向 6支试管中分别按序加入 1.0mL不同梯度的过氧化氢溶液,2.0mL 1.5mmol/L的PHPA溶液,30μL辣根过氧化物酶溶液,使过氧化氢的最终浓度分别为3.3,6.6,13.2,19.8,26.4,33.0μmol/L.在过氧化氢酶存在或缺少的时候分别测定 30s内荧光强度,取两者的差值为荧光强度.
1.3.4 不同生长时期的过氧化氢产生曲线 将处于对数生长期的CMJP重新接种后,每2d取藻液用0.1mL浮游植物计数框进行镜检计数.藻液取样后进行过氧化氢的测定,并绘制过氧化氢的产生曲线.
1.3.5 盐度和不同营养条件的影响 (1)设置 5种不同的氮磷比(4:1,8:1,16:1,32:1,64:1),按照以上5种氮磷比配制相应的培养基;(2)用超纯水将自然海水稀释成10,15,20,25,30psu等5个盐度梯度.每组实验设置 3个平行(保证起始密度大于1.0×103cells/mL).每 2d对藻细胞进行计数(第2,4,6,8,10,12d),第4,6,8d对藻细胞培养液取样进行过氧化氢产量测定.
2 结果与分析
2.1 PHPA法对海洋卡盾藻日本株过氧化氢检测的有效性
在激发波长为320nm下,对(PHPA)2的荧光二聚体发射波长扫描,结果表明过氧化氢对对PHPA氧化产物的最大发射波长为 405nm.本实验采用405nm为检测发射波长.CMJP培养液在未添加过氧化氢酶时,荧光发射光谱最大强度为1.91a.u.,添加过氧化氢酶后最大强度为14.74a.u.(图1),说明CMJP能够产生过氧化氢.根据Hyslop等的方法[6],测得过氧化氢的荧光标准曲线为y=0.3711x-0.7301 (R2=0.9759),其中y为荧光强度(a.u.),x为过氧化氢浓度.
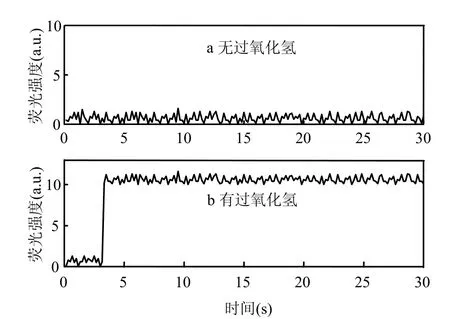
图1 CMJP培养液在缺少过氧化氢酶和添加过氧化氢酶后的荧光强度曲线Fig.1 Florescence spetrum of CMJP with the catalase absence and presence
2.2 海洋卡盾藻日本株不同生长时期过氧化氢的测定
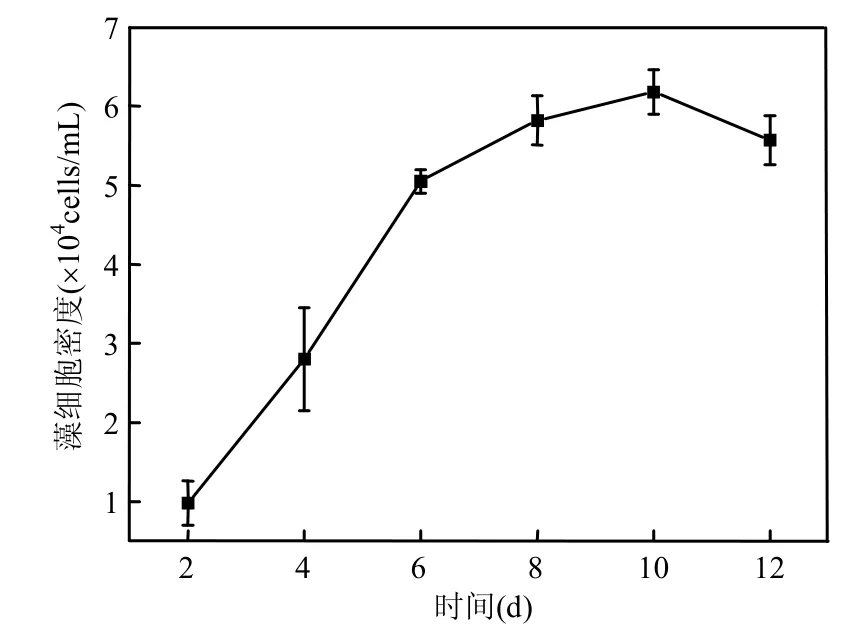
图2 海洋卡盾藻日本株的生长曲线Fig.2 Growth curve of CMJP
CMJP在接种后4d进入对数生长期,第10d藻细胞达到最大值(图2).过氧化氢浓度峰值出现在CMJP对数生长期(4~8d),以第6d达到最大(图3).CMJP在整个生长周期中产生的过氧化氢最高含量约为 0.97×10-4nmol/cell.为了减小随机误差,在随后的实验中,均采用第4,6,8d过氧化氢浓度的平均值进行比较.
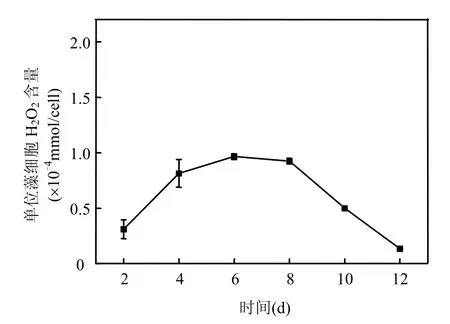
图3 海洋卡盾藻日本株过氧化氢的产生曲线Fig.3 Concentration-time profiles of peroxide hydrogen production
2.3 氮磷比对海洋卡盾藻日本株生长以及过氧化氢产生的影响
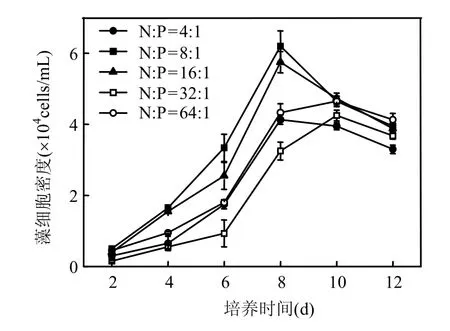
图4 不同氮磷比条件下海洋卡盾藻日本株的生长曲线Fig.4 Growth of CMJP under different N:P ratios
CMJP在不同N:P培养条件下8d进入指数生长末期.在4~8d,CMJP在N:P为8:1和16:1时藻细胞密度较高,其中以N:P为8:1时最高,表明该藻在此N:P条件下适宜于生长(图4).但CMJP产生H2O2的量与藻类生长呈现出一定的相反趋势,在藻细胞适宜生长的N:P条件下,H2O2浓度较小.在N:P为8:1时,单位体积培养液中H2O2浓度最小(0.68μmol/L),N:P为 16:1时,H2O2浓度为0.96μmol/L,而N:P为4:1时,单位体积培养液中H2O2浓度达到 1.84μmol/L.对单个藻细胞 H2O2含量来讲,在 N:P为 16:1时的 H2O2量最低(0.40×10-4nmol/cell),N:P为32:1时单个藻细胞的H2O2量最高(1.17 ×10-4nmol/cell) (图5).
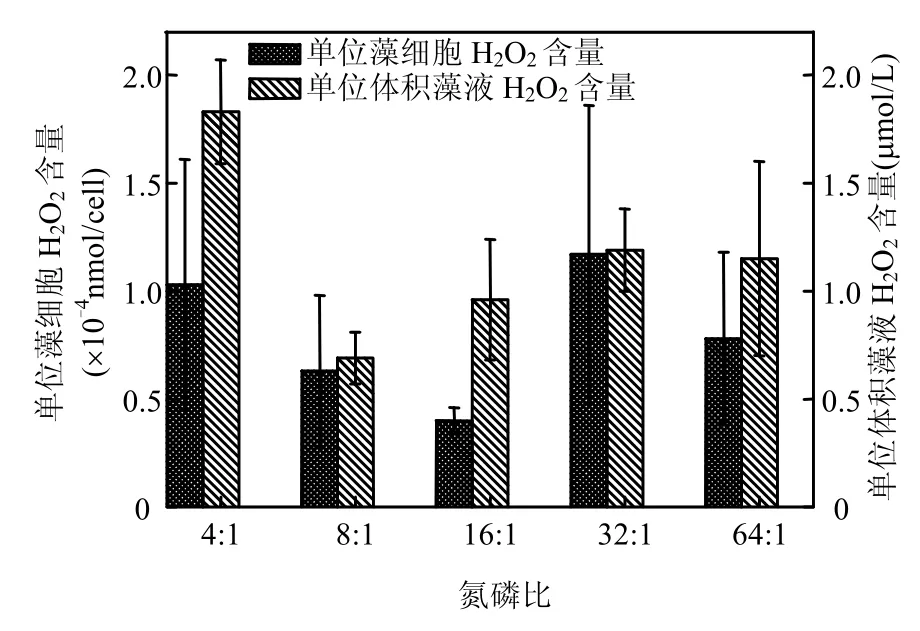
图5 不同氮磷比条件下海洋卡盾藻日本株的过氧化氢产量Fig.5 Hydrogen peroxide concentration of CMJP under different N:P ratios
2.4 盐度对海洋卡盾藻日本株生长以及过氧化氢产生的影响
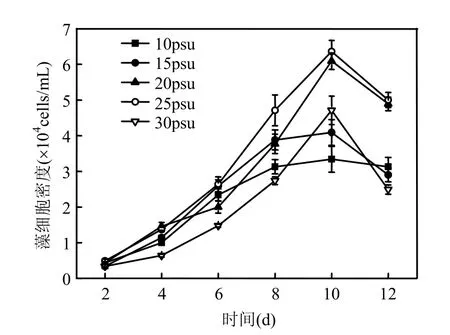
图6 不同盐度条件下海洋卡盾藻日本株的生长曲线Fig.6 Growth of CMJP under different salinity
CMJP在盐度为20,25psu时生长较好且藻细胞达到较高密度,在盐度为10,15,30psu时藻密度较低,表明CMJP最适生长盐度为20~25psu,低盐和高盐条件均不利于CMJP的生长(图6).盐度对CMJP过氧化氢的产量有一定的影响:在盐度为30psu时,单位体积藻液和单个藻细胞的H2O2量最高,分别达到1.3μmol/L和1.1×10-4nmol/cell;盐度在10~25psu范围内,单位体积藻液及单个藻细胞的H2O2量差异不明显(图7).
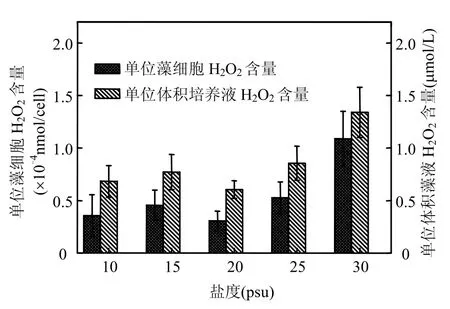
图7 不同盐度条件下海洋卡盾藻日本株的过氧化氢浓度Fig.7 Hydrogen peroxide concentration of CMJP under different salinity
3 讨论
本研究结果显示,海洋卡盾藻日本株能够产生微量H2O2.CMJP过氧化氢产量的峰值出现在对数生长期,随后迅速降低(图3).Oda等[8]研究表明,海洋卡盾藻向水体中释放 H2O2的量和藻细胞内 H2O2浓度及生长阶段均存在一定的关系,以对数生长期H2O2产量最大[8-9].微量活性氧在藻类某些生理现象的调控中发挥着重要的作用,特别是在细胞内信号转导方面[9],CMJP对数生长期H2O2的大量产生可能与藻细胞本身的新陈代谢或者酶代谢有关[11].过氧化物歧化酶(SOD)和过氧化氢酶均能够显著抑制海洋卡盾藻的生长,从而推测H2O2和O2-是海洋卡盾藻生长过程中必需存在的产物[8].研究表明,低浓度的活性氧能够显著地促进三角褐指藻(Phaeodactylum tricornutum)、杜氏藻(Dunaliella sp.)和青岛大扁藻(Platymonas helgolandica)等藻类的生长[12],从而进一步验证了活性氧是某些微藻生长过程中必需的物质;但在高浓度活性氧的作用下,微藻的生长又受到明显的抑制,说明高浓度的活性氧对微藻生长产生完全相反的生物学效应[12].
CMJP适宜生长的N:P值为8:1~16:1,但在此N:P值情况下,单位体积培养液或单个藻细胞H2O2量较低;CMJP在其他N:P值时生长受到抑制,但H2O2产量却较高(图4,图5).环境条件能够影响浮游植物细胞的化学组成,营养盐限制一般会导致细胞内营养的减少[13].氮、磷限制可能会影响正常的细胞功能,如氮缺乏能降低植物的光合作用和呼吸作用,并且能增加氮还原酶、NADPH-谷氨酰胺脱氢酶和谷氨酰胺合成酶的活性[14].在氮、磷限制条件下,藻细胞酶活性的变化可能是导致 CMJP过氧化氢产量增加的原因.Liu等[9]认为,水体中N:P对海洋卡盾藻H2O2产率没有影响,与本研究的实验结果存在差异.本实验是直接测量不同条件下藻液中 H2O2浓度,而Liu等[9]采用藻细胞浓缩再悬浮后30min测定H2O2的产率.两者采用不同的测量方法可能是导致结论不一致的主要原因.
盐度能通过参与渗透调节而控制细胞生长,是影响海洋卡盾藻细胞形态的重要物理因子[15].微藻对盐度有一定的耐受范围,较低和较高的盐度均不利于海洋微藻生长.先前研究表明,海洋卡盾藻澳大利亚株对盐度的耐受范围为 15~50psu[15],而日本株最适宜生长的盐度为25psu,耐受范围为 10~35psu[16],与本研究结果相似.有关盐度影响海洋卡盾藻过氧化氢产量的研究较少.本研究结果表明,盐度在 10~25psu范围内,单位体积藻液及单个藻细胞的 H2O2量变化不明显,而高盐度(30psu)则刺激H2O2产生.
海洋卡盾藻是典型的鱼毒性赤潮原因种,其导致鱼类死亡的机制还存在争议.本课题组研究表明,海洋卡盾藻能够产生溶血毒素,其粗提液对兔血红细胞膜具有明显的破坏作用,经薄层色谱检测得出至少含有4 种组分,其中1 种可能为脂类,3 种为糖脂类[17].本文则进一步证实该藻能够产生 H2O2.另外,卡盾藻属赤潮藻还可能产生神经毒素,游离脂肪酸等有害物质[5,18].该藻赤潮爆发时,这些有毒物质是否共同存在?是哪种物
质的毒性起到主体作用?这些有毒物质对鱼类的毒性是否存在协同作用?为什么相同种类的赤潮在不同地点爆发时毒性差异巨大,环境因素起到多大的控制作用? 这一系列问题都需要对鱼毒性赤潮的毒性机理进行深入研究.
4 结论
4.1 H2O2浓度峰值出现在 CMJP对数生长期(4~8d),以第6d达到最大.
4.2 CMJP产生的H2O2量与藻类生长呈现出一定的相反趋势,在藻细胞适宜生长的N:P下,产生的H2O2浓度较小.在N:P为16:1时单个藻细胞的H2O2量最低.
4.3 盐度对CMJP过氧化氢的产量有一定的影响,在高盐度下单个藻细胞的 H2O2产量增加,盐度为30psu时,H2O2浓度最高.
[1] 齐雨藻,洪 英,吕颂辉,等.南海大鹏湾海洋褐胞藻赤潮及其成因 [J]. 海洋与湖沼, 1994,25(2):132-138.
[2] Marshall J A, Salas M, Oda T. Superoxide production by marine microalgaeI. Survey of 37 species from 6 classes [J]. Marine Biology, 2005,147:541–549
[3] Oda T, Nakamura A, Midori S. Generation of reactive oxygen species by Raphidophycean phytoplankton [J]. Bioscience, Biotechnology, and Biochemistry, 1997,61:1658–1662.
[4] Ishimatsu A. Histological analysis of the mechanisms of Chattonella-induced hypoxemia in Yellowtail [J]. Fisheries Science, 1996,62(1):50-58.
[5] Marshall J A, Nichols P D, Hamilton B, et al. Ichthyotoxicity of Chattonella marina (Raphidophyceae) to damselfish (Acanthochromis polycanthus): the synergistic role of reactive oxygen species and free fatty acids [J]. Harmful Algae, 2003,2(4): 273-281.
[6] Twiner M J, Trick C G. Possible physiological mechanisms for the production of hydrogen peroxide by the ichthyotoxic flagellate Heterosigma akashiwo [J]. Journal of Plankton Research, 2000,22:1961-1975.
[7] Woo S P S, Liu W H, Au D W T, et al. Antioxidant responses and lipid peroxidation in gills and erythrocytes of fish (Rhabdosarga sarba) upon exposure to Chattonella marina and hydrogen peroxide: Implications on the cause of fish kills [J]. Experimental Marine Biology and Ecology, 2006,336:230-241.
[8] Oda T, Moritomi J, Kawano I, et al. Catalase-and superoxide dismutase-induced morphological changes and growth inhibition in the red tide phytoplankton Chattonella marina [J]. Bioscience, Biotechnology and Biochemistry, 1995,59:2044-2048.
[9] Liu W H, Au D W T, Anderson D M, et al. Effects of nutrients, salinity, pH and light:dark cycle on the production of reactive oxygen species in the alga Chattonella marina [J]. Experimental Marine Biology and Ecology, 2007,346:76-86.
[10] Hyslop P A, Sklar L A. A quantitative fluorimetric assay for the determination of oxidant production by polymorphonuclear leukocytes: its use in the simultaneous fluorimetric assay of cellular activation processes [J]. Analytical Biochemistry, 1984, 141:380-386.
[11] Kim D, Nakamura A, Okamoto T, et al. Mechanism of superoxide anion generation in the toxic red tide phytoplankton Chattonella marina: possible involvement of NAD(P)H oxidase [J]. Biochimica et Biophysica Acta, 2000,1524:220-227.
[12] 谢 荣,唐学玺,李永祺,等.活性氧对 3种海洋微藻生长的影响[J]. 海洋学报, 2001,23(1):94-101.
[13] Cembella A D, Antia N J, Harrison P J. The utilization of inorganic and organic phosphorous compounds as nutrients by eukaryotic microalgae: a multidisciplinary perspective: part 2 [J]. Critical Reviews in Microbiology, 1984,11:13-81.
[14] Everest S A, Hipkin C R, Syrett P J. Enzyme activities in some marine phytoplankters and the effect of nitrogen limitation on nitrogen and carbon metabolism in Chlorella stigmatophora [J]. Marine Biology, 1986,90:165-172.
[15] Marshall, J A, Hallegraeff, G M. Comparative ecophysiology of the harmful alga Chattonella marina (Raphidophyceae) from South Australian and Japanese waters [J]. Plankton Research, 1999,21:1809-1822.
[16] Yamaguchi M, Imai I, Honjo T. Effects of temperature, salinity and irradiance on the growth rates of the noxious red tide flagellates Chattonella antiqua and C. marina (Raphidophyceae) [J]. Nippon Suisan Gakkaishi, 1991,57(7):1277-1284.
[17] 张 文,江天久,王 锐.海洋卡盾藻(香港株)溶血毒素的提取和分离 [J]. 生态科学, 2008,27(6):457-463.
[18] Okaichi T. Marine environmental studies on outbreaks of red tides in neritic waters [J]. Journal of Oceanography, 1983,39(5):267-278.
Study on production of peroxide hydrogen by Chattonella marina Japan strain.
JIANG Tao1, CHEN Wen-jing2, WU Ni1, JIANG Tian-jiu1,2*(1.Research Center of Harmful Algae and Aquatic Environment, Jinan Unversity, Guangzhou 510632, China;2.College of Life Science, South China Normal University, Guangzhou 510630, China). China Environmental Science, 2011,31(11):1864~1869
The induced peroxide hydrogen (H2O2) under different stages of C. marina which was treated at different salinity and nutrient conditions was studied. The results showed that high concentration of H2O2was observed during the logarithmic phase from 4 to 8 d, with the maximum value of 0.97×10-4nmol/cell on the 6th day. Under the N:P ratio of 8:1 and 16:1, CMJP possessed the relative higher growth rate and cell concentration. However, H2O2concentration was relatively low at those optimal N:P ratios, indicating the production of H2O2is negative to the growth of C. marina. The lowest concentration of peroxide hydrogen of CMHK was 0.40×10-4nmol/cell with the N:P ratio of 16:1, which was only one third of that with the N:P ratio of 32:1 (1.17 ×10-4). The concentration of peroxide hydrogen per cell was 0.63 ×10-4nmol/cell when N:P ratio was 8:1. The optimal salinities for the growth of CMJP were 20 and 25psu, where cell concentrations were relatively higher. However, cell concentrations were lower at the salinity of 10, 15 and 30psu, showing the growth of CMJP was depressed at relatively low and high salinity. Salinity also influenced the production of peroxide hydrogen. The concentration of peroxide hydrogen per cell was 1.1 ×10-4nmol/cell, the highest value among the experiments, at the salinity of 30 psu.
Chattonella marina;peroxide hydrogen;reactive oxygen species
X171
A
1000-6923(2011)11-1864-06
2011-02-17
国家自然科学基金资助项目(U0733006,41106090);国家“973”项目(2010CB428702);中央高校基本科研业务费专项资金(21610103,11610425);广东省自然科学基金资助项目(S2011040003113)
* 责任作者, 研究员, tjiangtj@jnu.edu.cn
江 涛(1978-),男,山东安丘人,博士,助理研究员,主要研究方向为海洋环境化学.发表论文10篇.
