长期暴露于全氟十三酸的青鳉鱼体内分布和生物富集
2011-12-21于艳艳胡建英赵砚彬北京大学城市与环境学院北京100871
于艳艳,胡建英,彭 辉,万 祎,赵砚彬 (北京大学城市与环境学院,北京 100871)
长期暴露于全氟十三酸的青鳉鱼体内分布和生物富集
于艳艳,胡建英*,彭 辉,万 祎,赵砚彬 (北京大学城市与环境学院,北京 100871)
研究了将青鳉鱼长期暴露于不同浓度的全氟羧酸类物质全氟十三酸(PFTriDA)后的器官分布和富集系数.结果显示, PFTriDA最高富集在性腺;其次是卵、肝脏;浓度最低的部分是残体.除了性腺之外,该器官分布与野生中华鲟的一致.在相同暴露浓度下,雄鱼体内各器官的PFTriDA的含量高于雌鱼,机理模型计算进一步表明高母子传递系数是造成雌雄差异的可能原因.随着PFTriDA暴露浓度的升高,鱼体内同一器官的生物富集系数(BCF)呈现下降趋势.
全氟化合物(PFCs);全氟十三酸(PFTriDA);器官分布;生物富集;青鳉鱼
由于全氟化合物(PFCs)具有环境持久性、广泛存在性和潜在的毒性,这类物质已经引起了广泛的关注[1-2].但是到目前为止的研究更多地集中在全氟辛磺酸(PFOS)和全氟辛酸(PFOA)物质上[3-4].全氟十三酸(PFTriDA)是全氟化合物中的一种长链全氟羧酸.野外调查证实[5],在中华鲟(Acipenser sinensis)体内,PFTriDA的浓度远高于PFOS和PFOA,并且母子传递系数高达5.5,可能影响处于敏感时期的胚胎的发育.一些体外、体内毒性试验也表明[6-8]长链全氟羧酸具有更强的细胞毒性,诱导肝脏中的氧化应激反应,抑制脂肪酸β-氧化及PPAR下游基因表达等生物毒性.
生物富集系数(BCF)反映了机体从周围水环境中富集环境污染物的能力,是化学物质生态风险评价的关键因子之一[9].目前关于PFOS的研究发现,其在实验室暴露条件下BCF值在210~5400之间[9-10].对于不同链长PFCs的BCF的研究表明,与相同碳链的羧酸类物质相比,磺酸类物质具有较大的BCF值;对羧酸类物质来说,BCF随着链长的增加而增加[9].但到目前为止,尚没有关于PFTriDA的BCF的报道.以往的BCF研究往往局限于比较短的暴露时间.考虑到野生生物不同于实验室暴露,其终生暴露在化学物质之中,并通过母子传递导致生物体在最敏感的胚胎时期遭受高浓度的PFCs暴露而影响繁殖,因此有必要通过整个生命周期暴露PFTriDA研究子代的BCF.
本研究将刚孵出的青鳉鱼暴露于不同浓度的PFTriDA至繁殖期,检测PFTriDA在不同器官包括肌肉、肝脏、性腺和卵中的浓度,并计算了该物质在不同暴露浓度下的不同器官中的 BCF,为PFTriDA的生态风险评价提供理论依据.
1 材料与方法
1.1 试剂
PFTriDA、全氟十二酸(Perfluorododecanoate Acid, PFDoDA),四丁基硫酸氢铵(TBAS)和二甲基亚砜(DMSO)购自 Sigma公司(Louis, MO, USA)、色谱纯的甲醇和甲基叔丁基醚(MTBE)购自Fisher公司(New Jersey, USA).
1.2 暴露实验
青鳉鱼(Medaka, Oryzias latipes)属于Orange-Red品系.养殖和暴露期间条件为水温(25±1)°C,水硬度(以 CaCO3计)(81.1±1.2)mg/L, pH7.9±0.1,DO (7.8±0.3)mg/L.光周期控制在昼:夜=16h:8h.饲料为新孵化的活体卤虫幼体,每天喂2次.
采用刚孵化的青鳉鱼苗(0dph),暴露至繁殖期,约80d.PFTriDA配制成浓度为2500mg/L的DMSO溶液后,按梯度稀释,以 DMSO溶液/水=0.002%(体积比)比例配制实验暴露用水.设计了6个PFTriDA暴露浓度梯度:0(对照组,用于去除背景值),0.04,0.2,1.0,5.0和50.0μg/L.每组养殖20对青鳉鱼(雌雄各20条),设2个重复.最初30d放在2L的结晶皿中,养殖水体积为1.5L,每天半量换水.后期每组挑选 16对发育较好的青鳉鱼(雌雄各 16条)放置在方缸,采用流水装置,养殖水体积为14L,每天流动的水量为14L.暴露期间,每隔1周从各个实验组取100mL养殖水,用于检测 PFTriDA的实际暴露浓度;暴露至繁殖期约80d,清晨光周期开始0.5h后,分别从各暴露组中随机选择 3条产卵的雌鱼,采集鱼卵,用吸水纸分别吸干鱼体表和鱼卵水分,分别称重,随后解剖取肝脏和性腺及余下的残体并分别称重,同时随机选择 3条雄鱼,与雌鱼处理方式相同.样品均保存在-20℃,用于分析不同器官中的PFTriDA浓度.
1.3 浓度分析
低浓度组(0,0.04,0.2,1.0μg/L)水样用离心机以9000r/min的转速离心10min.取上清液100mL,加入内标PFDoDA后用Waters Oasis WAX(6cc, 500mg)萃取柱进行富集.上样前,依次用 4mL含有 0.5%(体积比)氨水的甲醇溶液、4mL的甲醇和4mL的纯水活化WAX柱,然后以约10mL/min的速率上样.然后用4mL的0.025mol/L乙酸钠溶液(pH4)淋洗WAX柱以去除部分杂质,然后用氮气将其吹干.再用4mL含有0.5%(体积比)氨水的甲醇溶液洗脱,氮吹浓缩至1mL,富集倍数为100倍.萃取液用 GHP滤器过滤后进入 UPLC-MS/ MS分析.
高浓度组(5.0和50.0μg/L)水样,采用液液萃取的方法进行样品预处理.水样用离心机以9000r/min的转速离心10min.取上清液500μL水样到15mL的聚丙烯离心管,加入内标PFDoDA后依次加入1mL的0.5mol/L的TBAS溶液,2mL的 0.25mol/L的碳酸钠溶液,混合均匀后加入5mL的MTBE,然后300r/min振荡30min后,超声波振荡20min.3600r/min离心10min后,用巴氏吸管将上层有机相转移到另一个 15mL的聚丙烯离心管中,重复提取过程2次并将上层有机相合并,氮吹浓缩至1mL.萃取液用GHP滤器过滤后进入UPLC-MS/MS分析.
1.4 生物样品处理
将各种生物样品进行组织匀浆后转移到15mL的聚丙烯离心管,其余操作与高浓度组水样处理方式相同.
1.5 LC-MS-MS分析
目标物质分离采用ACQUITY UPLC液相色谱仪(Waters, USA).为了消除UPLC管路和流动相中本身存在的 PFCs对目标物质测定的干扰,将一根50mm的ACUITY UPLC BEH C18色谱柱(1.7μm粒径,2.1mm×50mm,Waters, USA)联接于溶剂混合器(Filter Mixer)与进样器六通阀之间,使UPLC中的PFCs杂质在与样品混合之前先于该色谱柱上保留一段时间从而与样品中的目标物质相分离.PFCs的分离采用 100mm 的ACUITY UPLC BEH C18色谱柱(1.7μm 粒径,2.1mm×100mm,Waters,USA).流动相为甲醇与含5mmol/L乙酸铵的纯水,流速为0.2mL/min.采用梯度分离,甲醇的比例在6min内从10%线性提高到65%,然后在1min内线性提高到75%,在以后的4min内提高到100%,保持2min后回到初始比例平衡3min.柱温为40℃,进样体积为5μL.
目标物质定量采用Quattro Premier XE串联四级杆质谱联用仪(Waters Corp.,USA).质谱采用ESI负离子源,MRM 监测模式.质谱操作参数设定:毛细管电压 2.5kV;锥孔电压 30V;倍增电压650V;脱溶剂气流量 800L/h;锥孔气流量 50L/h;源温度110℃;脱溶剂气温度350℃.
1.6 质量控制
加标回收率分别用未暴露的水样和鱼样进行.在 500mL自来水中加入 200ng/L的PFTriDA(n=3),用固相萃取柱富集,回收率为81%±10%,方法检出限为 0.5ng/L,样品内标回收率为 71%~97%;对于水样的 MTBE萃取方法(n=3),在500μL自来水样中加入5μg/L PFTriDA,加标回收率为 94%±7%,方法检出限为 0.5μg/L,样品内标回收率为79%~119%;在0.3g鱼体样品中加入1μg/g PFTriDA(n=3),然后用MTBE萃取,加标回收率为86%±12%,方法检出限为1ng/g,样品内标回收率为67%~114%.
为了消除方法空白,所用的器皿都分别用甲醇冲洗3次.另外每批样品都带1空白样品,结果表明整个实验过程没有空白,并获得了很好的仪器标准线(0,20,40,80,160,320,640,1200和 2400 pg/mL,R2>0.99).
1.7 生物富集模型计算及数据分析
鱼体中的污染物总量变化等于每天吸收的量再减去排出的量,可以用式(1)表示[11].

式中:Cb为鱼体浓度;Cw为水体浓度;Gw为每天交换的水体;Ew为PFTriDA的吸收效率;Wb为鱼体重; kd为排泄系数;kegg为母子传递系数;Wegg为卵的质量,当雄鱼时Wegg=0,由于精子相对于卵质量很小,忽略不计.
慢性暴露的结果使PFTriDA基本处于平衡状态,鱼体浓度保持不变,则式(1)可改写为式(2).

根据鱼类代谢能量,Gw可由式(3)计算.
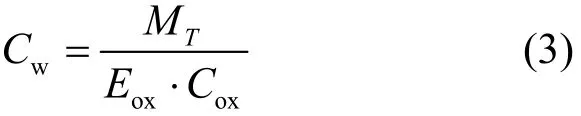
式中: MT为总代谢能量;Eox为氧气利用率, 0.45[11];Cox为培养水体中氧气含量.
MT和鱼体的重量和温度有关,可以用式(4)表示:

式中: T为绝对温度,K.
而水中氧气浓度由式(5)计算:

数据分析采用 SPSS统计软件包.数据显著差异分析采用独立样本 t检验,显著性水平为0.05.所有数据和图表均以“平均值±标准偏差”方式表示.
2 结果与讨论
2.1 PFTriDA在青鳉鱼体内器官分布
暴露期间养殖水中 PFTriDA的实测浓度(n=6,括号中数值为设计浓度)分别为 0.08± 0.03(0.04)、0.25±0.07(0.2)、1.32±0.20(1.0)、5.17± 4.23(5.0)和43.72±6.87(50.0)μg/L.
PFTriDA在雌鱼体内不同器官中的浓度顺序是性腺>卵>肝脏>残体(图1),除了性腺之外,其器官分布与野生中华鲟一致[5].除最高暴露浓度组(50.0μg/L)外,雌鱼性腺中 PFTriDA浓度高于鱼卵中浓度.这是因为在本实验中虽然雌鱼性腺充满了各个时期的卵细胞,但成熟卵细胞在排出体外时会吸水导致体积有所增加,从而使卵中PFTriDA的浓度要低于性腺中浓度.母子传递系数(ELR)用卵中PFTriDA的浓度和母体肝脏中浓度的比值来表示[5].PFTriDA在0.04,0.2,1.0,5.0和50.0μg/L的暴露浓度下,母子传递系数分别为1.51±0.60,1.00±0.47,1.25±0.33,0.92±0.26和6.79± 0.92.值得注意的是在 50.0μg/L暴露组,PFTriDA的母子传递系数高达 6.79,甚至超过野生中华鲟的5.5,有关机理需要进一步研究.
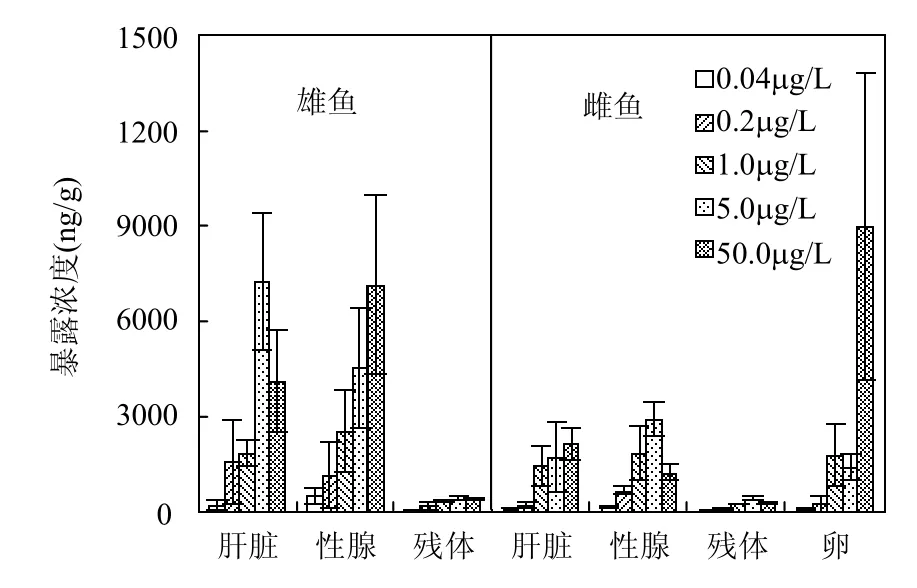
图1 不同暴露浓度下各器官PFTriDA 的浓度Fig.1 PFTriDA concentrations in different tissues at different exposure concentrations
在相同暴露浓度下雄鱼体内各器官的PFTriDA的浓度高于雌鱼(图1),特别是50.0μg/L暴露组中雌鱼体内的PFTriDA浓度远低于雄鱼,这一结果与PFOA暴露黑头呆鱼的结果相似[12],但是却不同于 PFOS暴露黑头呆鱼的结果[13].一些相关研究阐述了PFCs在雌雄鱼体内的差异性富集.Schult等[12]进行了经口摄入PFOA后,其在黑头呆鱼体内的吸收和排泄的性别差异的研究,认为性激素诱导的有机阴离子转移通道的变化导致了 PFOA在鱼体内包括肾小管重吸收和分泌的肾运输活性的雌雄差异,从而使得PFOA在雌鱼体内的清除速率远远大于雄鱼.这一结果与实验室暴露大鼠的结果一致[14-15].而Gerald等[13]也认为是化学物质排泄速率的性别差异导致了PFOS在雌雄鱼体内浓度的差异.并通过验证试验发现,PFOS、PFOA、PFDA、PFDoDA这4种物质在雄性虹鳟鱼体内的排泄速率要远高于雌鱼,导致雄鱼体内浓度低于雌鱼.这与本研究的结果相反.另外,母子传递也可能是导致 PFCs雌雄差异性的主要原因.Greg等[10]通过实验室暴露发现,斑马鱼经历过1个生殖周期后成鱼体内大约10%的PFOS通过母子传递的方式传递到鱼卵中,使得鱼卵中PFOS的浓度[(116±13.3)μg/g]远高于成鱼[(72.1±7.6)μg/g].青鳉鱼雌鱼性成熟之后在雄鱼的刺激下,每天都会产卵,而PFTriDA的高母子传递系数可能使雌鱼通过卵排泄大量的PFTriDA,从而导致雌鱼体内PFTriDA浓度低于雄鱼.

表1 长期暴露后PFTriDA在青鳉鱼不同器官的生物富集系数(BCF)Table 1 Bioconcentration factor (BCF) of PFTriDA in different tissues of medaka after long-term exposure
2.2 PFTriDA在青鳉鱼卵及其他器官中的BCF
表1列出了PFTriDA暴露80d后在青鳉鱼不同器官的BCF.PFTriDA在雌鱼体内的BCF是11.0~686.6,低于其在雄鱼体内的 BCF(12.6~1046.4).由于 PFCs具有很强的亲水性(pKa<0.5)[16],以及优先与蛋白质结合,使得其富集机理不同于传统的持久性有机污染物的亲脂性分配过程,可能是由于与体内不同器官的蛋白质结合导致.例如有研究表明[17-18,25],PFCs在肝脏中的高浓度富集是因为与肝脏中的蛋白如肝脏脂肪酸结合蛋白(L-FABP)结合.而 PFCs在卵中的高浓度富集原因目前尚不清楚,Peng等[5]发现,PFCs的母子传递系数和蛋白结合能力有显著相关性,表明 PFCs在鱼卵中的高浓度富集可能也是同一些蛋白如卵黄蛋白结合导致.
在最低的暴露浓度组(0.04μg/L),PFTriDA在青鳉鱼雌鱼和雄鱼肝脏中的BCF分别为1260.1± 871.8和2940.80±1793.03,远低于Martin等[9]的虹鳟幼鱼短期暴露实验中 PFUnA、PFDoDA和PFTA(暴露浓度分别为 0.48,0.20和0.014μg/L,在肝脏中的BCF分别为4900,18000和30000)的BCF,但是和 PFDA(暴露浓度为 0.71μg/L,在肝脏中的BCF为1100)的BCF相似.根据Martin等[9]的实验数据,发现全氟羧酸在虹鳟幼鱼肝脏中的 BCF随着碳链的增加而增加,这样PFTriDA的BCF应该介于PFDoDA和PFTA的BCF之间,即18000~30000.这可能与实验动物的物种差异性或暴露用鱼的生长期及暴露时期的选择有关.

图2 青鳉鱼不同器官中PFTriDA的暴露浓度与BCF之间的相关性Fig.2 Ln-linear correlation between exposure concentrations of PFTriDA and BCF in different tissues of medaka
PFTriDA在相同器官中的BCF随着暴露浓度的增加而减小,暴露浓度与BCF之间有显著的对数线性相关性(图2).这一现象在以往的其他物质PCP、2,4-DCP、TBT和4-NP研究中也有类似报道,是影响评价野外生物富集性及生态效应的重要因素[19-21].而对本实验而言,可能是因为高浓度下的PFTriDA暴露使得体内的血清白蛋白等与PFTriDA的结合能力趋近饱和(接近文献报道的体外实验浓度5µmol/L[22]),从而使游离态比例升高而增加排泄能力、降低富集系数.这一研究结果说明以往的高浓度暴露实验数据不能简单外推到野外环境中,而本研究为评价环境中PFTriDA的BCF提供了理论基础.
2.3 青鳉鱼雌雄鱼体内浓度预测及解析
在长期暴露的稳态假设下,根据方法 1.7中所列方程(1-5)并结合相应的暴露浓度,对青鳉鱼雌雄鱼体内PFTriDA的浓度进行了预测.由于文献中报道的排泄常数kd值[11]是在与0.04μg/L相似的浓度下获得,为此对0.04μg/L暴露组青鳉鱼体内浓度进行了预测.表2列出了用于计算的各参数值.最终雌雄鱼体内的PFTriDA的预测浓度分别为 77.8,280.4ng/g,与鱼体内的实测浓度(雌鱼101.1,雄鱼236.4ng/g)比较接近(图3).

表2 青鳉鱼雌雄鱼体内浓度预测的各种参数Table 2 Parameters used to predict the internal concentration of PFTriDA in medaka
目前关于PFCs在生物体内的性别差异性富集已经在大鼠、鱼体内报道,其中激素水平对阴离子转运蛋白的竞争作用可能是导致某些物种PFCs性别差异的重要原因[12,14].然而在具有高母子传递系数的卵生生物中,母子传递过程可能是导致性别差异性富集的另一重要原因[23].而本研究预测结果和实测结果都表明,PFTriDA在雌鱼中的富集浓度远低于雄鱼,通过计算得到雌鱼通过母子传递排泄的PFTriDA的量在总排泄量中所占的比重高达 65.3%,从而也证明母子传递是导致雌雄富集能力的差异性原因之一.

图3 0.04μg/L暴露组青鳉鱼雌雄鱼体内浓度预测值和实测值比较Fig.3 Predicted value and measured value of internal concentration of PFTriDA at 0.04μg/L treatment in medaka
3 结论
3.1 PFTriDA浓度最高的器官是性腺,其次是卵、肝脏,而在包括鳃、脑、肠道、肌肉等部分的残体中的PFTriDA浓度最低.
3.2 在相同暴露浓度下,雄鱼体内各器官的PFTriDA的含量高于雌鱼,根据机理模型的计算结果推断,高母子传递系数可能是造成雌雄差异的原因之一.
3.3 随着 PFTriDA暴露浓度的升高,青鳉鱼体内同一器官的生物富集系数(BCF)呈下降趋势,这可能是导致风险评价出现偏差的重要原因.
[1] Giesy J P, Kannan K. Global distribution of perfluorooctane sulfonate in wildlife [J]. Environmental Science and Technology, 2001,35(7):1339-1342.
[2] Giesy J P, Kannan K. Perfluorochemical surfactants in the environment [J]. Environmental Science and Technology, 2002, 36(7):146A-152A .
[3] Shoeib M, Harner T, Vlahos P. Perfluorinated chemicals in the Arctic atmosphere [J]. Environmental Science and Technology, 2006,40(24):7577-7583.
[4] Scott B F, Spencer C, Mabury S A, et al. Poly and perfluorinated carboxylates in north American precipitation [J]. Environmental Science and Technology, 2006,40(23):7167-7174.
[5] Peng H, Wei Q W, Wan Y, et al. Tissue distribution and maternal transfer of poly- and perfluorinated compounds in Chinese Sturgeon (Acipenser sinensis): Implications for reproductive risk [J]. Environmental Science and Technology, 2010,44(5):1868-1874.
[6] Zhang H, Shi Z, Liu Y, et al. Lipid homeostasis and oxidative stress in the liver of male rats exposed to perfluorododecanoic acid [J]. Toxicology and Applied Pharmacology, 2008,227(1):16-25.
[7] Hickey N J, Crump D, Jones S P, et al. Effects of 18 perfluoroalkyl compounds on mRNA expression in chicken embryo hepatocyte cultures [J]. Toxicological Sciences, 2009, 111(2):311-320.
[8] Wei Y H, Shi X J, Zhang H X, et al. Combined effects of polyfluorinated and perfluorinated compounds on primary cultured hepatocytes from rare minnow (Gobiocypris rarus) using toxicogenomic analysis [J]. Aquatic Toxicology, 2009,95(1): 27-36.
[9] Martin J W, Mabury S A, Solomon K R, et al. Bioconcentration and tissue distribution of perfluorinated acids in rainbow trout (Oncorhynchus mykiss) [J]. Environmental Toxicology and Chemistry, 2003,22(1):196-204.
[10] Sharpe R L, Benskin J P, Laarman A H, et al. Perfluorooctane sulfonate toxicity, isomer-specific accumulation, and maternal transfer in zebrafish (Danio rerio) and rainbow trout (Oncorhynchus mykiss) [J]. Environmental Toxicology and Chemistry, 2010,29(9):1957-1966.
[11] Russell R W, Gobas F, Haffner G D. Maternal transfer and in ovo exposure of organochlorines in oviparous organisms: A model and field verification [J]. Environmental Science and Technology, 1999,33(3):416-420.
[12] Lee J J, Schultz I R. Sex differences in the uptake and disposition of perfluorooctanoic acid in fathead minnows after oral dosing [J]. Environmental Science and Technology, 2010,44(1):491-496.
[13] Ankley G T, Kuehl D W, Kahl M D, et al. Reproductive and developmental toxicity and bioconcentration of perfluorooctane sulfonate in a partial life-cycle test with the fathead minnow (Pimephales promelas) [J]. Environmental Toxicology and Chemistry, 2005,24(9):2316-2324.
[14] Kudo N, Katakura M, Sato Y, et al. Sex hormone-regulated renal transport of perfluorooctanoic acid [J]. Chemico-Biological Interactions, 2002,139(3):301-316.
[15] Hundley S G, Sarrif A M, Kennedy G L. Absorption, distribution, and excretion of ammonium perfluorooctanoate (APFO) after oral dministration to various species [J]. Drug and Chemical Toxicology, 2006,29(2):137-145.
[16] Goss K U. The pK(a) values of PFOA and other highly fluorinated carboxylic acids [J]. Environmental Science and Technology, 2008,42(2):456-458.
[17] Heuvel J, Kuslikis B I, Vanrafelghem M J, et al. Disposition of perfluorodecanoic acid in male and female rats [J]. Toxicology and Applied Pharmacology, 1991,107(3):450-459.
[18] Jones P D, Hu W Y, De Coen W, et al. Binding of perfluorinated fatty acids to serum proteins [J]. Environmental Toxicology and Chemistry, 2003,22(11):2639-2649.
[19] Kondo T, Yamamoto H, Tatarazako N, et al. Bioconcentration factor of relatively low concentrations of chlorophenols in Japanese medaka [J]. Chemosphere, 2005,61(9):1299-1304.
[20] Yang R Q, Zhou Q F, Jiang G B. Butyltin accumulation in the marine clam Mya arenaria: An evaluation of its suitability for monitoring butyltin pollution [J]. Chemosphere, 2006,63(1):1-8. [21] Lietti E, Marin M G, Matozzo V, et al. Uptake and elimination of 4-nonylphenol by the clam Tapes philippinarum [J]. Archives of Environmental Contamination and Toxicology, 2007,53(4): 571-578.
[22] Han X, Snow T A, Kemper R A, et al. Binding of perfluorooctanoic acid to ratand human plasma proteins[J].Chem. Res. Toxicol., 2003,16(6):775-781.
[23] Newsted J L, Beach S A, Giesy J P, et al. Pharmacokinetics and acute lethality of perfluorooctane sulfonate (PFOS) to the mallard and northern bobwhite [J]. Archives of Environmental Contamination and Toxicology, 2006,50(3):411–420.
[24] Morrison H A, Whittle D M, Metcalfe C D, et al. Application of a food web bioaccumulation model for the prediction of polychlorinated biphenyl, dioxin, and furan congener concentrations in Lake Ontario aquatic biota [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1999,56(8): 1389-1400.
[25] 谢显传,王晓蓉,张幼宽,等.荧光光谱法研究全氟辛酸与牛血清白蛋白的相互作用 [J]. 中国环境科学,2010,30(11):1496-1500.
Tissue distribution and bioconcentration of long-term exposure to perfluorotridecanoate acid (PFTriDA) in the medaka (Oryzias Latipes).
YU Yan-yan, HU Jian-ying*, PENG Hui, WAN Yi, ZHAO Yan-bin (College of Urban Environmental Sciences, Peking University, Beijing 100871, China). China Environmental Science, 2011,31(9):1548~1554
While perfluorotridecanoate acid (PFTriDA), a long-chain perfluorinated carboxylic acid, has been widely detected in environment and wildlife in recent years, there is still lack of mechanism information on the tissue distribution and bioconcentration in fish. The tissue distribution and bioconcentration in the medaka (Oryzias Latipes) exposed to different concentrations of PFTriDA was assessed. The highest concentration of PFTriDA was detected in gonad, followed by egg, liver and carcass, which was similar to the tissue distribution in wild Chinese Sturgeon (Acipenser sinensis) except for gonad. For all tissues, male accumulated higher concentrations than female, which was demonstrated to be mainly due to high maternal transfer efficiency in adult female. The bioconcentration factor (BCF) was found to be decreased with increasing the exposure concentration of PFTriDA.
perfluorinated compounds (PFCs);perfluorotridecanoate acid (PFTriDA);tissue distribution;bioconcentration;medaka
X503.225,X835
A
1000-6923(2011)09-1548-07
2010-12-13
国家“973”项目(2007CB407304)
* 责任作者, 教授, hujy@urban.pku.edu.cn
于艳艳(1985-),女,山东文登人,山东师范大学生命科学学院硕士研究生,北京大学城市与环境学院客座研究生,研究方向为PFCs毒性效应及机制.
