生物表面活性剂用于逆胶束体系的构建及微水相条件优化
2011-12-21崔凯龙袁兴中曾光明梁运姗韩增辉湖南大学环境科学与工程学院
崔凯龙,袁兴中*,曾光明,梁运姗,韩增辉,张 胜,彭 馨 (1.湖南大学环境科学与工程学院,
生物表面活性剂用于逆胶束体系的构建及微水相条件优化
崔凯龙1,2,袁兴中1,2*,曾光明1,2,梁运姗1,2,韩增辉1,2,张 胜3,彭 馨1,2(1.湖南大学环境科学与工程学院,
对生物表面活性剂应用于逆胶束体系构建及微水相的条件优化进行了研究.通过与化学表面活性剂(阳离子表面活性剂CTAB、阴离子表面活性剂AOT、非离子表面活性剂Tween-80)的对比可知,生物表面活性剂鼠李糖脂RL具有高增溶性、低使用量、微环境所需条件温和等优点.通过荧光法测得RL在异辛烷中的临界胶束浓度CMC为0.055mmol/L,相对于化学表面活性剂需要更少的量即可形成逆胶束.电导法测得其最佳含水率W为32.1,比其他逆胶束的最佳含水率大,表明其能够增溶更多的水,导致了RL构建的逆胶束粒径相对其他胶体的大,这也为酶解反应提供了足够的反应空间.本实验也通过紫外法测定了pH、离子强度对于逆胶束中漆酶活性的影响,RL体系的最佳pH为5.2、最佳KCl浓度为0.05mol/L,pH与离子强度分别是通过酸碱度、带电电荷与表面活性剂极性端相互作用来影响酶活.
生物表面活性剂;逆胶束;微环境条件优化;酶活
逆胶束萃取技术克服了传统方法对酶蛋白分离纯化的诸多不足,受到酶纯化技术领域越来越多的关注[1].表面活性剂是构成逆胶束油包水结构的关键因素,而在已有研究中大多使用化学表面活性剂.由于化学表面活性剂具有难溶性、难降解性和毒性,且非常容易包裹难溶性物质而形成胶体,同时也因为它是那些具有环境风险的有机物在环境中存在和转移的载体,会成为环境中普遍存在的二次污染物[2-3].
生物表面活性剂是直接从微生物发酵得来的,具有非常高的生物降解性,较低的毒性,一定的胶团催化能力和非常低的临界胶束浓度,对于逆胶束形成有深远意义[4].只有当表面活性剂的浓度超过临界胶束浓度 CMC时,才能够形成逆胶束
[5],目前表面活性剂在水相中(水包油结构)的CMC已经测得,而油相中(油包水结构)表面活性剂的 CMC仍然不甚明确.逆胶束体系的含水率W0(c[水]/c[表面活性剂])对于胶体的粒径、形状有很大影响[6],不同的含水率会改变溶入其中的酶的活性以及酶纯化的效率.逆胶束的“水核”微环境决定了酶的溶解性以及纯化过程能否顺利进行[7],所以考察微环境 pH、离子强度对酶活性影响对于构建逆胶束体系有着至关重要的作用.
本研究以鼠李糖脂(RL)为生物表面活性剂代表,采用对比的方法与CTAB、AOT、Tween-80 3种化学表面活性剂在结构特征和催化性能方面进行分析研究.由于酶纯化过程受到诸多因素的影响,确定 RL构建的逆胶束的最佳状态为其推广到工业使用奠定了实验基础.本实验以堆肥试验中应用较多的木质纤维素酶漆酶为例,对RL构建的逆胶束进行了全面的分析,由实验结果可知,这种“绿色”的表面活性剂在酶纯化工艺中有着突出的实际意义.

表1 各表面活性剂的基本性质[8]Table 1 Fundamental properties of surfactants
1 材料与方法
1.1 实验材料及仪器
表面活性剂:化学表面活性剂CTAB(天津市大茂化学试剂厂)、AOT(上海阿拉丁试剂公司)、Tween-80(天津市博迪化工有限公司);生物表面活性剂单鼠李糖脂(本实验室自制[9]).各种表面活性剂的性质见表1.
油相:异辛烷(天津市大茂化学试剂厂);水相:超纯水;助表面活性剂:正己醇(国药集团化学试剂有限公司);其他试剂:木质纤维素降解酶代表物(5mg/mL漆酶溶液),0.01mol/L KCl溶液,柠檬酸/柠檬酸钠缓冲溶液系列,0.1mg/mL ABTS溶液,罗丹明B.
主要仪器:DDSJ-307型电导率仪,紫外分光光度计,TDA-8002电热恒温水浴锅,HZQ-C空气浴振荡培养箱,TGL-16G型离心机,超声波振荡器,荧光分析仪(Perkin Elmer instrument, LS55, US.),Zeta电位-粒径仪Zetasizer Nano ZEN3600 (Malvern Instruments, Malvern,U.K.).
1.2 实验方法
1.2.1 配制混合溶剂 逆胶束溶剂能够影响到水核中酶的活性和稳定性,有研究证明异辛烷是一种对逆胶束体系中酶的性质影响最小的溶剂,相对于己烷和辛烷等有机溶剂,酶在异辛烷体系中的活性最高[10].大部分的表面活性剂由于没有合适的亲水亲油指数(HLB)而不能形成逆胶束(见表 1),所以需要助表面活性剂的加入来改进这种情况.助表面活性剂能够增加表面活性剂的溶解性,同时能够促进表面活性剂极性端的结合,形成逆胶束[11].现在一些油溶性醇类是用得比较多的助表面活性剂,本实验采用正己醇为助表面活性剂.本实验以异辛烷/正己醇(二者体积比均为 1:1)混合溶液为溶剂,各部分实验均以此为基础.
1.2.2 测量荧光发射强度 在上述溶剂中配制浓度为4.975×10-6mol/L的罗丹明B(RB)有机溶液作为探针.再以该探针溶液作为溶剂,针对四种表面活性剂各配置一系列不同浓度油相溶液,通过荧光仪测量各溶液中RB的发射强度,绘制RB发射强度随表面活性剂浓度的变化图,以此确定油相中各表面活性剂的临界胶束浓度.相关参数为:激发波长357nm,激发狭缝宽度10nm,发射狭缝宽度8nm,扫描速度500nm/min.
1.2.3 测量电导率及粒径 将各物质按如下配比混匀,异辛烷:正己醇:tween-80(CTAB、AOT和RL):水=5mL:5mL:1mL(或 0.5g):V(水),分别针对4个体系各添加一系列不同浓度的水,然后将混合液在超声波振荡器超声1h使其完全溶解混匀.用 0.01mol/L KCl溶液来校准电导率仪,之后测其电导率,绘制电导率随 W0变化的曲线,确定最佳含水率.在5CMC条件下,按照一定比例缩放最佳含水率来配置逆胶束体系,测量四种逆胶束体系中不同表面活性剂浓度下的胶束粒径.
1.2.4 测量漆酶酶活 在5CMC条件下,最佳含水率W条件下配制逆胶束溶液.逆胶束水相由不同值缓冲溶液(不同浓度KCl溶液)、底物ABTS溶液和降解酶漆酶酶液三部分按照体积比 2:1:1组成.将配置后的逆胶束体系采用紫外分光光度计测量漆酶酶活,绘制酶活随pH、离子强度的变化曲线.定义 1个酶活力单位(U)为 1μmol的ABTS每min被转化所需的酶量.
2 结果与讨论
2.1 油相中罗丹明B的荧光特性分析
只有当表面活性剂浓度达到临界胶束浓度(CMC)才能够形成逆胶束,目前各种表面活性剂在水相中的临界胶束浓度已被测得(表1),而逆胶束中的溶剂为油相,油相中临界胶束浓度还未知,所以本实验以 RB为探针采用荧光法测得异辛烷溶剂中各表面活性剂的浓度.表面活性剂对RB有着增溶作用,不同浓度,不同类型的表面活性剂对 RB的增溶能力不一样,在超过临界胶束浓度(CMC)后,溶液的增溶能力会有一个突变[2].由图1可以看出,四种油相溶液的荧光强度均有一个明显的拐点,而拐点位置的浓度即为该表面活性剂在油相中的临界胶束浓度.以临界胶束浓度 CMC为分界,荧光发射强度变化分为两个过程.当表面活性剂浓度小于CMC时,RB主要以单体的形式存在,随着表面活性剂浓度的升高,由于表面活性剂的增溶作用,荧光强度逐渐加强.当表面活性剂浓度达到CMC时,胶体开始形成,此时体系最稳定,RB单体开始逐渐聚合形成聚集体,因而它的荧光也就减弱了[12-13].当表面活性剂浓度大于CMC时,随着浓度的增加,游离的单体逐渐增多,荧光强度出现缓慢增长,增长率小于或等于第一个过程的变化率.
可以看出,CTAB、AOT、Tween-80、RL的临界胶束浓度分别为0.6,0.17,0.008,0.055mmol/L.均比其在水中的临界胶束浓度小一些.数值越小,说明需要形成逆胶束所需的表面活性剂量越少,这也是AOT和Tween-80是应用最广泛的化学表面活性剂的原因之一.RL的临界胶束浓度也相对偏小,表明其很少用量即可形成逆胶束.在临界胶束浓度CMC附近,CTAB溶液的荧光发射强度最大可以达到 576.31a.u.,AOT最大可以达到626.07a.u.,Tween-80最大可以达到 585.47a.u.,而生物表面活性剂RL荧光发射强度最大可以达到858.30a.u.,且平均发射强度大于化学表面活性剂形成的胶体.充分说明生物表面活性剂对于RB有着很强的增溶作用,容易形成更大粒径的胶体,在这种情况下形成的逆胶束能够有效地加快酶解反应,提高酶的纯化效率.
2.2 逆胶束体系的电导性质分析
影响逆胶束“水核”体积及粒径的重要因素是含水率,逆胶束含水率 W0与表面活性剂的离子性、种类,助表面活性剂的种类,水溶液的pH、离子强度等有关.反映不同含水率对于逆胶束水核性质影响的重要指标为电导率,电导率可以直观的描述水核微环境的状态[14].由图2可以看出,电导率随着 W0先上升,然后趋于稳定.两个状态的拐点由于电导率最高,反应最稳定,微环境条件适宜,即为逆胶束的最佳含水率W,当含水率小于W时,由于没有达到表面活性剂的增溶水量,电导率随着含水量的增加而增大;当含水率大于W时,由于已经超过表面活性剂的增溶水量,体系开始变的浑浊,粘度增加,从而影响导电粒子的相互移 动,引起电导率的下降.

图1 不同表面活性剂浓度下的罗丹明B荧光光谱Fig.1 Fluorescence spectra of RB in reversed micelle at different surfactant concentration
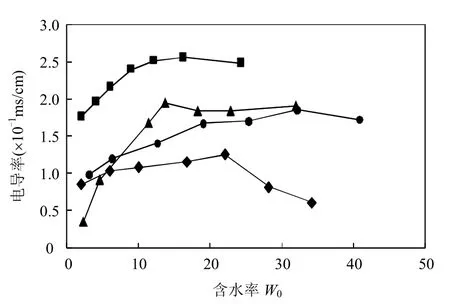
图2 逆胶束电导率随含水率的变化Fig.2 Variation of conductivity of reversed micelle with the water content
CTAB、AOT、Tween-80、RL的最佳含水率W分别为:10.5、13.5、22.0、32.1.当逆胶束体系处于较低 W0时,水分子与表面活性剂的极性端通过分子间作用力而紧密结合,水核微环境非常稳定,难以发生物质交换.随着W0的增加,水核中会有大量自由水存在,这些自由水以非常快的速度在不同水核间进行物质交换,有研究标明,尽管只有1‰的碰撞会导致胶束间的物质交换,但会有效的增强整个体系的电导率[15].一般来说,由于水核粒径大小随着 W0的变大而变大,所以增溶水量较大的逆胶束溶液适合于萃取相对分子质量大的水溶性物质如蛋白质等,对于酶的纯化,鼠李糖脂构建的逆胶束有相对较强的增溶水性,水核粒径较大,为酶纯化过程提供了很好的微环境[3].
2.3 逆胶束体系的粒度特性及其分布状况
逆胶束粒径与含水量W0、胶束聚集状态、胶束电荷等因素有关.根据实验测得结果,可将逆胶束体系中粒径分布分为两种形态:当粒径小于10nm时为小粒径,当粒径大于10nm为大粒径.单体逆胶束的粒径一般在0~10nm之间,由于分子热运动做布朗运动,会吸附空气中的电荷而发生中合作用,再通过高速碰撞形成聚集体,导致大粒径逆胶束聚集体的形成.也有研究表明,正己醇的加入有助于增大逆胶束的粒径[16].由图 3可以看出,在小于W时,逆胶束粒径基本上随着含水率的增加而增加,大于W之后,粒径分布没有一定的规律,这与单体逆胶束之间的相互吸引和聚集作用有关.由于鼠李糖脂 RL的增溶性较强,所以其逆胶束粒径明显较其他几种化学表面活性剂大,这对于酶反应及纯化过程提供了自由的空间,有助于酶反应的快速进行和酶纯化的效率提高[17].
如图4所示,小粒径逆胶束在四种体系中均占据相对较少的含量,原因是单体逆胶束一旦形成,就会以各种各样的方式而形成聚集体,只会有一小部分的单体游离在体系中而被检测到.相对来说CTAB体系的小粒径含量较高,原因是单体逆胶束所带电荷强度较高,导致不同单体间的排斥力较大,相对较难形成聚集体;而RL体系的小粒径含量较低,在一些体系中小粒径的含量接近为0,原因在于生物表面活性剂粒径较大,活性强,单体碰撞概率大,有助于聚集体的形成,加强了单体间的物质交换,这将有助于萃取过程的发生[18].虽然小粒径所占比例变化不大,但是基本上在最佳含水率 W附近,小粒径所占比例均相对较高,这说明在最佳含水率W时,体系中的单体逆胶束较多,原因在于此时单体所带电荷均匀,体系相对稳定,碰撞的发生是对等的,这对于研究逆胶束纯化过程有重大的意义.

图3 不同含水率下的各逆胶束粒径Fig.3 Particle diameter of reversea micell under different water content
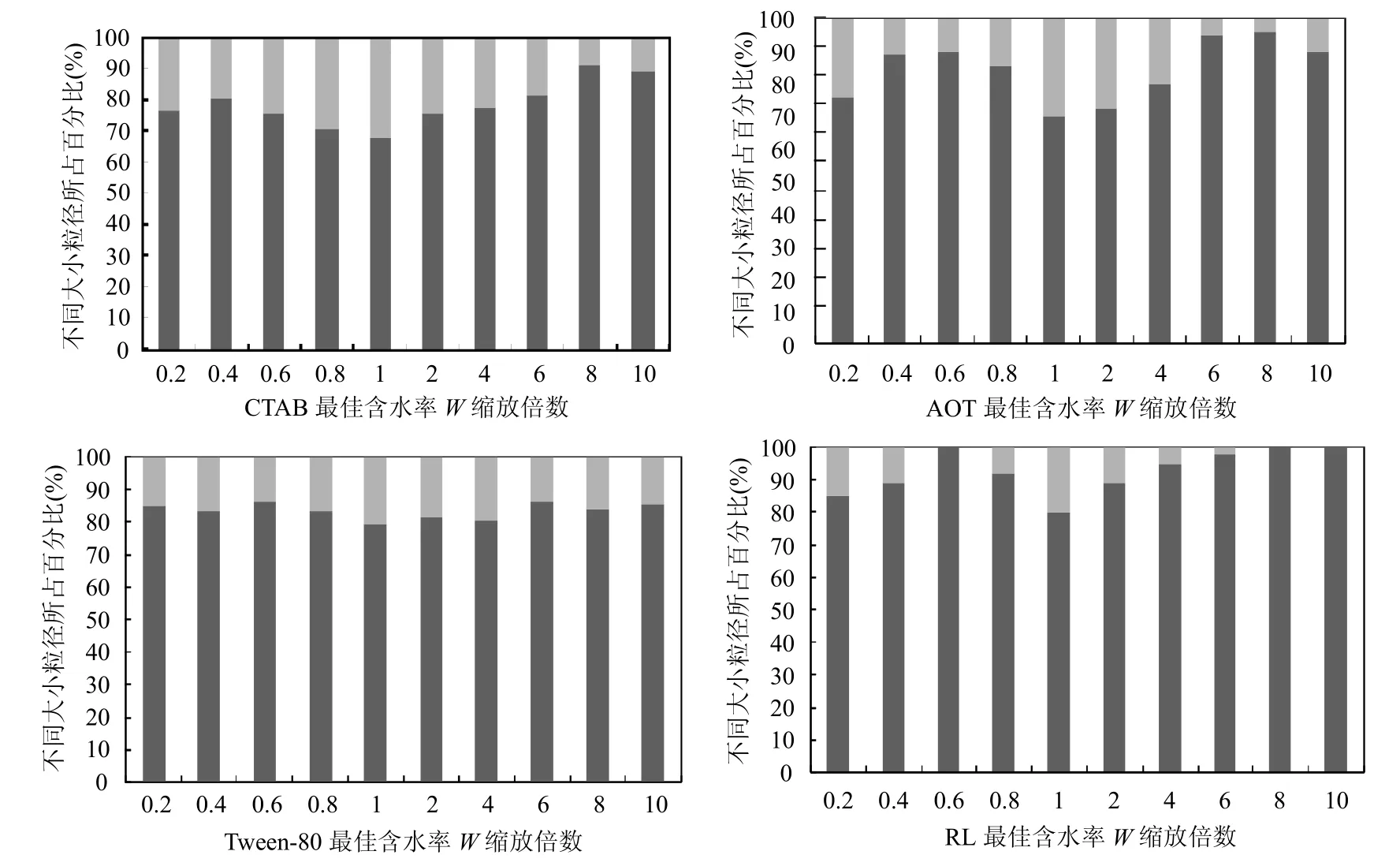
图4 大、小粒径逆胶体含量随含水率的分布Fig.4 Distribution of big and small reversed micelle with water content
2.4 漆酶在逆胶束体系中的活性分析
酶反应及萃取的发生场所为水核,所以本组实验针对逆胶束微水相不同的pH值及离子强度进行了酶活测量,通过不同微环境状态的改变,了解木质纤维素酶的酶活随这些状态的改变,进而确定最佳微环境状态.
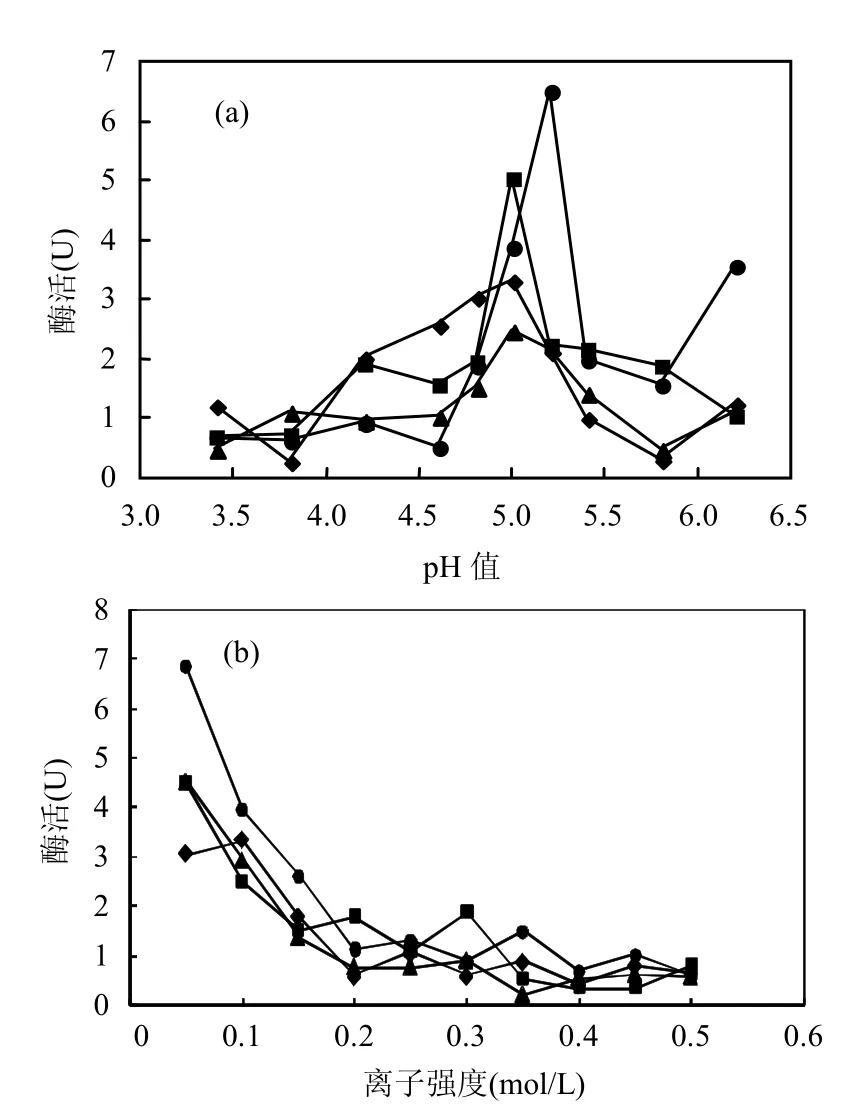
图5 不同pH值、离子强度下的逆胶束体系酶活性Fig.5 Enzyme activaty of reversed micelle under pH、inoic strength
酶分子所处微环境的酸碱度决定了其所带电荷的种类,因此,酸碱度不仅决定了酶分子在逆胶束体系中的溶解度,而且也有可能引起酶分子与逆胶束表面活性剂层之间相互作用的改变[5]. pH值对于酶活的影响作用是非常大的,从图5(a)可以看出,在pH值从3.2~6.5的变化范围内,4个体系的酶活随 pH值变化图呈钟罩型,过大或者是过小的pH值对于酶活来说均是不利的,除RL外 3种化学表面活性剂体系的最佳 pH值均为5.0,而RL体系的最佳pH值为5.2,这说明漆酶最适pH值在逆胶束体系中相对于水相体系变化不大,受到表面活性剂极性端的影响很小[19].同时可以看出RL体系的酶活相对较高,催化效率高,表明生物表面活性剂对于酶反应发生具有一定促进作用.
离子强度对于酶在水核中的溶解度有很大的影响,从而会影响逆胶束中漆酶酶活.从图5(b)可以看出,四种逆胶束体系中酶活随着离子强度的增加而减小,尤其是在离子强度较小时,下降幅度较大,但是当离子浓度达到一定量后,其对酶活大小基本没影响.离子强度越大,逆胶束内表面双电层就会变薄,从而减弱了酶蛋白与逆胶束内表面之间的相互吸引,从而降低了酶蛋白的溶解,同时盐溶液和表面活性剂或酶蛋白的相互作用,可改变溶解性能,离子强度越大,酶的溶解性能越差[20].在0.25mol/L附近,酶活趋于稳定,为了保证在逆胶束体系中酶的活性少受影响,选取KCl盐溶度为0.05mol/L为体系最佳离子强度.
3 结论
3.1 鼠李糖脂 RL作为生物表面活性剂构建逆胶束体系,在异辛烷/正己醇体系按照体积比 1:1的条件下,测得油相中临界胶束浓度 CMC为0.055mmol/L.而保证体系活性最佳的其他条件为:含水率W0为32.1, pH值为5.2,KCl水溶液离子浓度为0.05mol/L.
3.2 由于鼠李糖脂 RL构建的逆胶束体系的临界胶束浓度较低,所以形成逆胶束所需浓度较低,而且该体系荧光发生强度最大可达 858.30a.u.,说明其具有很好的增溶性.逆胶束水核粒径最大可达50.4nm,能够给酶反应提供较大的空间.
3.3 按照给定的溶剂配比,同样的pH与离子强度条件下,以木质纤维素酶漆酶为例,鼠李糖脂RL构建的逆胶束体系中酶活可达到 7U,明显高于其他体系,RL逆胶束对于漆酶酶活力有促进作用.
[1] Sosaku I, Shinji S. Formation of biocompatible reversed micellar systems using phosphorlipids [J]. BioEngin., 2000,6:193-199.
[2] Cristina M L, Carvalho, Joaquim M S. Cabral.Reverse micelles as reaction media for lipases [J]. Biochimie, 2000,82:1063-1085.
[3] Chen N, Fan J B, Xiang J, et al. Enzymatic hydrolysis of microcrystalline cellulose in reverse micelles [J]. Biochimica et Biophysica Acta, 2006,1764:1029–1035.
[4] Xie Y W, Ye R Q, Liu H L. Synthesis of silver nanoparticles in reverse micelles stabilized by natural biosurfactant [J]. Colloids and Surfaces A:Physicochem. Eng. Aspects, 2006,279:175–178.
[5] Konstantza T, Zdravka L. Reversed micelle solvents as tools of enzyme purifcation and enzyme-catalyzed conversion [J]. Biotechnology Advances, 2008,26:516–532.
[6] Ken’ichi K, Tadao S. Effects of the water content on the growth rate of AgCl nanoparticles in a reversed micelle system [J]. Journal of Colloid and Interface Science, 2005,286:520–525.
[7] Torny E, Johan B, Folke T. Mechanism of surfactant effect in enzymatic hydrolysis of lignocellulose [J]. Enzyme and Microbial Technology, 2002,31:353–364.
[8] 周家华,崔英德.表面活性剂 HLB值的分析测定与计算.I HLB值的分析测定 [J]. 精细石油化工, 2001,2: 11-14.
[9] Liang Y S,Yuan X Z,Zeng G M,et al. Biodelignifica- tion of rice straw by Phanerochaete chrysosporium in the presence of dirhamnolipid [J]. Biodegradation, 2010,21(4): 615-624.
[10] Wang Y D, Gan Q, Shi C Y, et al. Separation of phenol from aqueous solutions by polymeric reversed micelle extraction [J]. Chemical Engineering Journal, 2002,88:95–101.
[11] 刘 恋,田森林,宁 平.Tween-20胶束溶液对甲苯的增溶吸收作用规律及预测 [J]. 中国环境科学, 2010,30(5):615-618.
[12] 杨 涛,李文娟,周从山.芘荧光探针光谱法测定 CTAB临界胶束浓度 [J]. 石化技术与应用. 2007,25(1):48-50.
[13] 杨丽琨,褚 莹,刘 阳,等.含有 BaMoO4纳米粒子的逆胶束溶液与罗丹明B的相互作用 [J]. 化学学报, 2005,63(1):18-22.
[14] Nikola K, Tomisic V, Hrust V, et al. Association of counterions with micelles [J]. Colloids and Surfaces A: Physicochem. Eng. Aspects, 2003,222:95-101.
[15] 郭晓歌,赵俊廷.不同逆胶束体系增溶水的比较 [J]. 精细化工石油进展, 2008,9(2):22-24.
[16] Poonam K, Sonalika V, Tokeer A, et al. Optimizing the hydrodynamic radii and polydispersity of reverse micelles in the Triton X-100/water/cyclohexane system using dynamic light scattering and other studies [J]. Colloids and Surfaces A:Physicochem. Eng. Aspects, 2007,293:162–166.
[17] Field C O, Freedman R B, Robinson B H. Enzyme hyperactivity in AOT water-in-oil microemulsions is induced by ‘lone’ sodium counterions in the water-pool [J]. Faraday Discuss, 2005,129: 247–263.
[18] Wang Y D, Gan Q B, Shi C Y, et al. Separation of phenol from aqueous solutions by polymeric reversed micelle extraction [J]. Chemical Engineering Journal, 2002,88:95–101.
[19] María A B, Elsa B A, Juana J S, et al. Kinetics of reactions catalyzed by enzymes in solutions of surfactants [J]. Advances in Colloid and Interface Science, 2008,136:1-24.
[20] Elena A E, Natalia L Z, Yuri F Z. Effect of surface potential of reverse micelle on enzyme–substrate complex formation [J]. Colloids and Surfaces A:Phy- sicochem. Eng. Aspects, 2008,317: 297–302.
Application of biosurfactant on the construction of reversed micelle and the optimization of its microenvironment.
CUI Kai-long1,2,YUAN Xing-zhong1,2*, ZENG Guang-ming1,2, LIANG Yun-shan1,2, HAN Zeng-hui1,2, ZHANG Sheng3, PENG Xin1,2(1.College of Environmental Science and Engineering, Hunan University, Changsha 410082, China;2.Key Laboratory of Environmental Biology and Pollution Control (Hunan University), Ministry of Education, Changsha 410082, China;3.College of Environmental Science and Engineering, Beijing Forestry Universtiy, Beijing 100083, China). China Environmental Science, 2011,31(9):1444~1450
Construction of reversed micelle (RM) by biosurfactant and the optimization of its microenvironment have been investigated. Compared with three kinds of chemical surfactants (cation surfactant: CTAB、anion surfactant: AOT、 nonion surfactant:Tween-80), rhamnolipid (RL), a typical biosurfactant, has the advantages of higher solubilization ability for water, lower dosage in the construction of RM, milder microenvironment for construction and so on. The Critical Micelle Concentration(CMC) of RL solubilized in isooctane detected through the method of fluorescence was 0.055mmol/L, therefore RM could be constructed by it with relatively lower dosage. It was found that the optimum hydration degree W was 32.1 through conductivity measurement, higher than the optimum hydration degree of other RMs, indicating that RL could highly increase the water solubility. Therefore, the RM constructed by RL had larger particle diameter than other ones, which also supplied sufficient space for enzymolysis reaction. UV spectrum was analysed to find out how pH and ionic strength affected enzyme activity of laccase in RM. And it has been found that while the pH was 5.2, the concentration of KCl was 0.05mol/L, the optimal condition of RL system could be reached. pH and ionic strength impacted the enzyme activity through the interaction between polar end of surfactant and pH value as well as charge of the microenvironment.
biosurfactant;reversed micelle;optimization of microenvironment;enzyme activity
湖南 长沙 410082;2.环境生物与控制教育部重点实验室(湖南大学),湖南 长沙 410082;3.北京林业大学环境科学与工程学院,北京 100083)
X131
A
1000-6923(2011)09-1444-07
2010-12-23
国家自然科学基金资助项目(50978087)
* 责任作者, 教授, yxz@hnu.cn
崔凯龙(1988-),男,河南许昌人,湖南大学环境科学与工程学院硕士研究生,研究方向为废物资源化.发表论文1篇.
