三丁基锡对热带爪蟾蝌蚪甲调基因mRNA表达的影响
2011-12-20曹庆珍张小利刘俊奇黄民生施华宏
曹庆珍, 朱 攀, 袁 静, 张小利, 刘俊奇, 黄民生, 施华宏
(华东师范大学 环境科学系 上海城市化过程与生态恢复重点实验室,上海 200062)
三丁基锡对热带爪蟾蝌蚪甲调基因mRNA表达的影响
曹庆珍, 朱 攀, 袁 静, 张小利, 刘俊奇, 黄民生, 施华宏
(华东师范大学 环境科学系 上海城市化过程与生态恢复重点实验室,上海 200062)
用三丁基锡(TBT)对热带爪蟾(Xenopus tropicalis)NF51阶段蝌蚪进行48 h和96 h暴露.结果显示,50 ng·L-1和200 ng·L-1TBTCl暴露对胚胎的存活率没有影响.50 ng·L-1TBTCl暴露组TRβ和DI 3 mRNA在蝌蚪尾巴中的表达比对照组增加了1~2.3倍.200 ng·L-1TBTCl暴露组48 h时,TSHβmRNA在蝌蚪尾巴中的表达比对照组上调了2.0倍.96 h后,TBTCl暴露组的RXRαmRNA在脑和尾中的表达均比对照组减少了约0.4倍,而RXRβmRNA在尾巴中的表达上调了5.9倍.96 h后,50 ng·L-1TBT暴露组MCT8 mRNA在尾部的表达上调了3.2倍,而200 ng·L-1组在脑部的表达是对照组的0.23倍.PPARγmRNA在TBTCl暴露组蝌蚪脑和尾中的表达均比对照组增加了1~2倍.上述结果表明,TBT能引起蝌蚪多个甲调基因mRNA表达的变化,并具有明显的组织差异性.这些mRNA涉及到甲状腺激素的合成、运输、转化和作用等多个过程,表明TBT对爪蟾具有甲状腺激素干扰效应.同时,通过对一些相关mRNA的检测表明,TBT可能通过与维甲酸核受体(RXR)结合而对蝌蚪产生甲状腺激素干扰效应.由此可见,分子指标在筛选甲状腺激素干扰物的过程中不仅具有快速灵敏的特点,而且有助于解析污染物的致毒作用模式.
爪蟾; TBT; 甲调基因表达
0 引 言
20世纪60年代开始,有机锡化合物作为金属有机化合物的一种被广泛应用于杀虫剂、除草剂、防污漆和聚氯乙烯合成的热、光稳定剂催化剂等.其中用于海洋船体防污的三丁基锡(TBT)涂料最多,它对海洋污损生物具有良好的杀生效果,被称为海洋杀生剂.但它的广泛运用也造成了全球范围内水域的普遍污染[1],世界各地的海水、底泥和生物中都发现了有机锡化合物的存在[2].
大量调查资料表明,TBT在环境中仅处于1~2 ng·L-1的极低质量浓度水平,就会对海洋浮游生物、软体动物和某些鱼苗等敏感的水生生物产生慢性和急性毒性[3].TBT对生物的毒性作用主要包括免疫毒性、生殖毒性和神经毒性等,并会通过食物链的富集影响生态系统[4].同时,TBT还是一种典型的环境内分泌干扰物,其最显著的特征是能引起腹足类的性畸变现象[5,6].环境中许多化学污染物可以影响生物体甲状腺激素(THs)的合成、分泌、运输、作用和代谢等过程,这类污染物被统称为甲状腺激素干扰物(TDCs).本课题组前期研究发现,环境浓度的TBT(25 ng·L-1TBTCl)能对非洲爪蟾(Xenopus laevis)幼蛙甲状腺组织结构造成严重损伤,表明TBT是一种潜在的甲状腺激素干扰物[7].然而,人们对TBT的甲状腺激素干扰机制还知之甚少.
两栖类变态发育过程是由甲状腺激素专门调控的.甲状腺激素进入靶细胞后与甲状腺激素核受体(TR)结合为复合物,然后与变态相关的靶基因的TR反应元件(TRE)作用,调控靶基因的表达并最终影响变态发育的过程[8],这些在变态过程中受甲状腺激素调节的基因被称为甲调基因.因此,甲调基因可以作为筛选甲状腺干扰物的有效分子标志物,同时还可用于分析污染物的致毒作用模式.
热带爪蟾(X.tropicalis)是发育生物学中一种新的模式动物,由于个体小、生活周期短和基因组结构简单而较非洲爪蟾更有研究优势.本文以热带爪蟾蝌蚪为模型,通过环境浓度TBT短期暴露,检测TBT对蝌蚪的甲调基因及其他相关基因的mRNA的影响,确定TBT的甲状腺激素干扰效应,并探讨其可能的干扰致毒作用模式,同时,为运用热带爪蟾快速筛选环境甲状激素干扰物提供科学依据.
1 材料与方法
1.1 试剂
氯化三丁基锡(TBTCl;CAS:1461-22-9;97%)购自 Merck公司;二甲基亚砜(DMSO)购自Sigma-Aldrich公司;Trizol裂解液和SYBR Premix Ex Taq(Perfect Real Time,Takara)购自上海皓嘉科技发展有限公司;RevertAidTMFirst Strand cDNA Synthesis Kit(Fermantas)购自深圳中晶生物有限公司;引物由上海赛百盛基因技术有限公司合成.
1.2 胚胎的获取和蝌蚪的饲养
挑选性成熟热带爪蟾14对,采用人工注射hCG的方法诱导产卵.每只爪蟾都进行2次注射,待蛙抱对产卵结束后收集胚胎,将产卵较好的3对蛙的胚胎混合,待其孵化后饲养至NF51阶段.蝌蚪饲养条件如下:室温25℃,明暗周期12 h/12 h;自来水经活性炭和微孔过滤系统处理后进入养殖箱循环,硬度150~250 mg·L-1(CaCO3),余氯浓度低于3μg·L-1,pH 7.0~8.0,溶解氧浓度高于5 mg·L-1.挑选达到NF51阶段发育良好的蝌蚪用于实验.
1.3 暴露实验
根据Nieuwkoop等(1956)的方法判断蝌蚪的发育阶段,在5 L的玻璃缸(20 cm×20 cm×20 cm)内加4 L经活性炭和微孔过滤系统处理过的自来水,每缸放20只NF51阶段的蝌蚪.TBTCl用DMSO助溶,暴露浓度为50 ng·L-1和200 ng·L-1,对照组加等量的DMSO.温度和光照同上,每天早、中和晚各喂鱼饲料(惠弘水族开发有限公司)一次.实验共设1个对照组和2个暴露组.每组4缸,共12缸,每天半换液1次,分别在48 h和96 h取样分析.
1.4 RNA的提取
分别在48 h和96 h从每缸取5只蝌蚪,将脑部或尾部组织分别合并,各取约0.1 g作为1个样品.在0.1 g组织中加入1 mL Trizol裂解液并匀浆,在匀浆液中加入200μL氯仿抽提RNA;静止5 min后再在4℃下经12 000 r/min冷冻离心15 min,移取上清液,加入500μL异丙醇沉淀RNA;再次冷冻离心后去上清液,取底部RNA沉淀,再加入75℅乙醇1 mL清洗2~3次.最后室温下自然晾干RNA10 min,加20μL的DEPC水溶解RNA,-70℃保存.
1.5 cDNA的合成
在RNA/DNA定量分析仪上测RNA的光吸收值,检测其纯度.根据260 nm处的光吸收值计算进行逆转录时加入RNA的体积.加入等量RNA后再加入DEPC水至11μL,然后加入1μL的OligdT混匀,放到PCR仪中72℃变性5 min.暂停,取出置于冰上2 min.在超净工作台上每个样品中依次加入4μL逆转录缓冲液、2μL dNTP、1μL逆转录酶和1μL逆转录酶抑制剂,制备混合液,然后在每个PCR管中加入8μL混合液,混匀后放到PCR仪中继续进行逆转录,设置37℃5 min,42℃60 min,70℃10 min,10℃暂时保存等程序.最后,取出保存于-40℃.
1.6 实时定量PCR
用SYBR green荧光染料进行实时定量PCR.引物是用Primer Express 3.0软件进行设计(见表1),然后委托上海赛百盛基因技术有限公司合成.目的基因(TRα,TRβ,DI2,DI3,TSHβ,b/zip,RXRα,RXRβ,RXRγ,MCT8和PPARγ)和内参基因(EF1α)的扩增效率基本一致,E>99%,R2>0.985.

表1 热带爪蟾 (Xenopus tropicalis)蝌蚪甲调基因引物列表Tab.1 The thyroid hormone response genes primers of Xenopus tropicalis tadpoles
将cDNA稀释到同一浓度50 ng·L-1,再制备PCR混合液.按样品的量制备混合液,依次加入SYBRPremix Ex Taq(Takara,含有DNA聚合酶、Buffer、dNTP和SYBRGreen I等试剂)10μL、上游引物0.4μL、下游引物0.4μL、ROX校正液0.4μL和RNase-free水6.8μL.然后,按照实验设计小心加入18μL混合液到每个八联管加样孔中.最后,每个孔中加入2μL的cDNA,混匀.加样完毕盖好管盖,按顺序放入7300型实时荧光定量PCR仪(ABI公司)中,然后设定程序:第一步,95℃30 s;第二步,40个循环:95℃5 s,60℃31 s.最后运行程序即可.
1.7 数据统计与分析
本实验采用2-△△CT方法比较浓度组的样品和对照组的样品目标基因之间的相对表达差异,数据以平均值±标准差表示,n=4.然后用SPSS 16.0软件中的ANOVA中的HSDTukey检验方法进行差异分析,然后用OriginPro 8.0作图.
2 结果与讨论
2.1 TBTCl对TRα、βmRNA的影响
48 h和96 h后,对照组和暴露组蝌蚪的存活率均为100%.暴露组TRαmRNA在尾部的表达比对照组有明显的增加,50 ng·L-1TBTCl暴露组TRβmRNA在尾巴的表达比对照组增加了的1~2倍(见图1).
本课题组前期研究发现,环境浓度的TBT(25 ng·L-1TBTCl)能对非洲爪蟾(Xenopus laevis)幼蛙甲状腺组织结构造成严重损伤,表明TBT是一种潜在的甲状腺激素干扰物[5].这些mRNA涉及到甲状腺激素的合成、运输、转化、合成和代谢等多个过程.其中,TR是甲状腺信号途径中的关键分子,爪蟾的TR有α和β两种亚型,在不同的发育阶段表达水平不同,并且其表达水平与甲状腺激素水平密切相关[9].污染物能通过影响甲状腺激素水平或其它途径引起TR mRNA表达发生变化,TR mRNA的表达水平是评价甲状腺干扰作用的重要分子标志物.已有研究表明,四溴双酚A是典型的甲状腺激素干扰物,能上调非洲爪蟾TH基因的表达[10],本实验结果也表明,TBT能诱导蝌蚪尾巴中TRα、βmRNA的上调,而对脑部TR mRNA的表达没有明显影响.这一方面说明TBT能干扰TR mRNA的表达,另一方面说明这种干扰作用具有组织差异性.

图1 TBT对热带爪蟾(Xenopus tropicalis)蝌蚪(NF51)脑和尾巴TRα和TRβmRNA表达的影响Fig.1 Effects of tributyltin on TRαand TRβmRNA expressions in the brains and tails of Xenopus tropicalis tadpoles
2.2 TBTCl对脱碘酶mRNA的影响
48 h后,50 ng·L-1的TBTCl暴露组DI 2和DI 3 mRNA在脑部和尾巴的表达比对照组均有不同程度的增加,在脑部的表达与对照组相比上调了1.1倍,在尾部则上调了1.2~2.3倍.96 h后,200 ng·L-1的TBTCl暴露组的DI 3 mRNA在尾巴的表达比对照组增加了3.0倍(见图2).
脱碘酶(IDs)是THs在动态循环过程中非常重要的一类酶,它能够催化体内THs脱碘转化过程,调控甲状腺激素的合成和转运.本实验结果显示,50 ng·L-1的TBT对蝌蚪的脑部和尾巴的DI 2和DI 3 mRNA均有不同程度的诱导作用.尤其在96 h暴露后,200 ng·L-1的TBTCl暴露组DI 3 mRNA在尾巴的表达比对照组增加了3.0倍.这说明TBT对脱碘酶基因具有诱导作用,特别是在尾巴部位诱导最明显,可能影响蝌蚪尾巴以后的生长和吸收.2.3 TBTCl对TSHβ和b/zip mRNA的影响
48 h后,TSHβmRNA在200 ng·L-1的TBTCl暴露组的蝌蚪尾中的表达比对照组增加了2.1倍,与其在50 ng·L-1的TBTCl暴露组的蝌蚪脑部表达是一致的.96 h后,TSHβmRNA在200 ng·L-1的TBTCl暴露组在蝌蚪脑部的表达则比对照组减少了0.53倍;200 ng·L-1的TBTCl暴露组的b/zip mRNA在脑部和尾巴中的表达均比对照组减少了0.51倍(见图3).
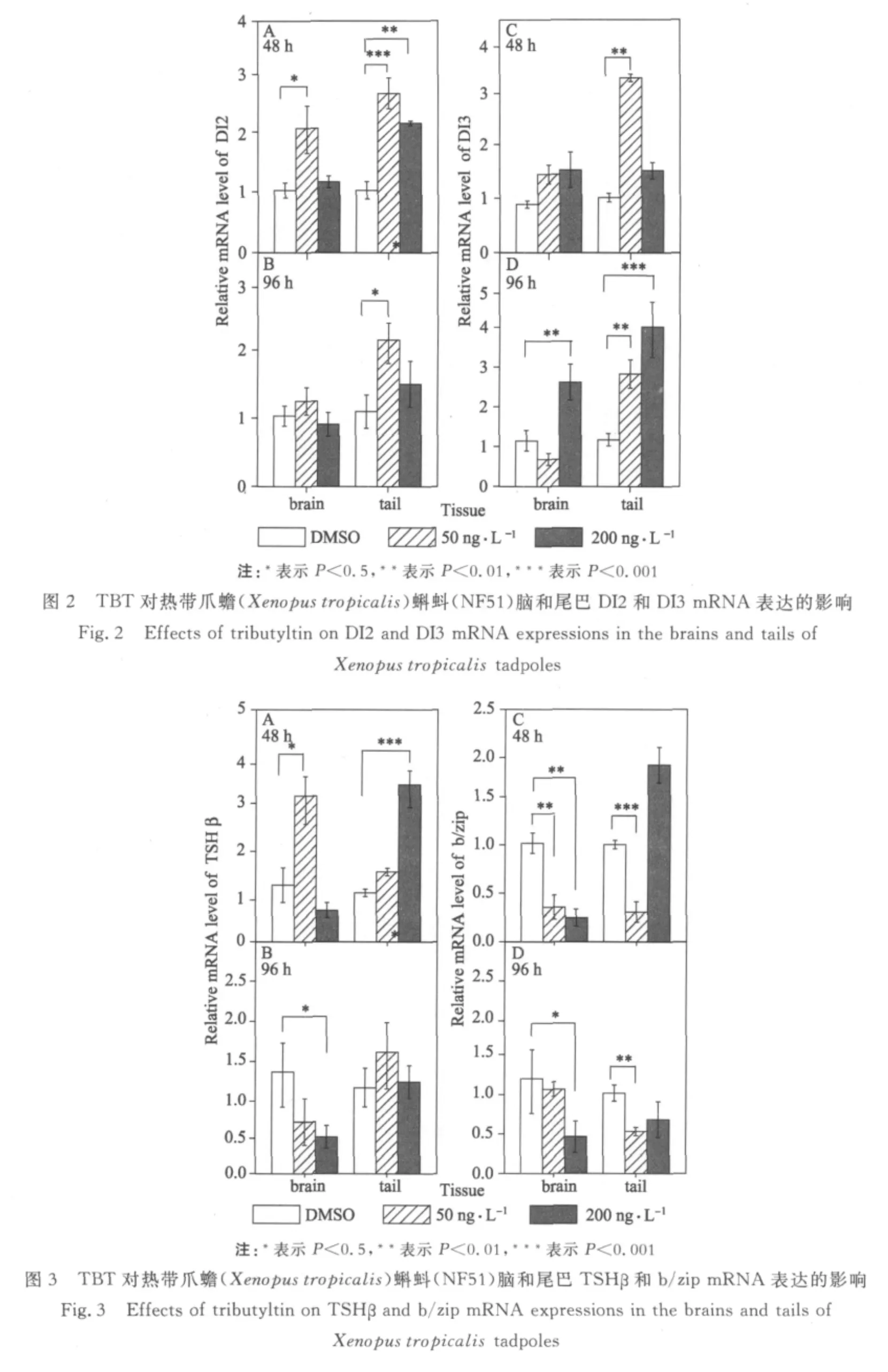
促甲状腺素(TSH)能够刺激甲状腺分泌甲状腺激素,但同时又受到机体甲状腺激素水平的反馈调控;b/zip是一种与变态相关的TR靶基因反应元件.有研究显示,TSH和b/zip的mRNA表达可以作为检测甲状腺干扰干扰效应的分子标志物[11,12].Helbing等研究了爪蟾蝌蚪脑中TSH mRNA表达,结果发现,T4和T3暴露不同程度地抑制了TSH mRNA的表达[13];Opitz等发现另一种甲状腺抑制剂——乙撑硫脲(ETU,25 mg·L-1和50 mg·L-1)可明显增强爪蟾脑中TSH mRNA的表达[14].本实验结果显示,TBT对蝌蚪尾巴中TSHβmRNA有诱导作用,对蝌蚪脑部TSHβmRNA有抑制作用;对b/zip mRNA在脑部和尾中都有明显抑制作用,表明TBT可能改变了蝌蚪的甲状腺激素水平.
2.4 TBTCl对RXR mRNA的影响
48 h后,RXRγmRNA在200 ng·L-1的TBTCl暴露组在蝌蚪脑中的表达比对照组减少了0.48倍.96 h后,TBTCl暴露组的RXRαmRNA在脑和尾中的表达均比对照组减少了约0.4倍,200 ng·L-1的TBTCl暴露组的RXRβmRNA则在脑部表达比对照组减少了0.51倍,而在尾巴中表达则比对照组增加了5.9倍(见图4).

图4 TBT对热带爪蟾(Xenopus tropicalis)蝌蚪(NF51)脑和尾巴RXR mRNA表达的影响Fig.4 Effects of tributyltin on RXR mRNA expressions in the brains and tails of Xenopus tropicalis tadpoles
RXRs是维生素A衍生物9-顺视黄酸的核受体,可与TR形成TR-RXR异二聚体.有研究认为甲状腺激素的作用是通过异二聚体中TR成分激活转录的,在此过程中RXR是一个沉默的伴侣(silent partner)[15].但也有研究显示,RXR不是沉默伴侣,可以通过结合其配体调节 TR-RXR的活性,从而影响两栖类的变态发育[16].Nishikawa等[17]指出 TBT与RXR具有极强的结合能力.Iwamuro研究表明,抗甲状腺激素干扰物双酚A能下调RXRγ基因的表达[18].本文结果也表明,200 ng·L-1TBTCl暴露组对蝌蚪脑中RXRβ和γmRNA的表达有抑制作用,说明TBT可能通过与RXR受体结合而干扰了甲状腺信号通路.
2.5 TBTCl对PPARγ和MCT8 mRNA的影响
48 h和96 h后,200 ng·L-1TBTCl暴露组PPARγmRNA在蝌蚪脑和尾巴中的表达比对照组均增加了1~2倍.48 h后,TBTCl暴露组MCT8 mRNA在蝌蚪脑部的表达比对照组明显增加,上调了1~2.3倍,而在尾巴中没有变化;96 h后,200 ng·L-1TBTCl暴露组MCT8 mRNA在脑部的表达是对照组的0.23倍,而其在50 ng·L-1TBTCl暴露组尾中的表达比对照组增加了3.2倍(见图5).
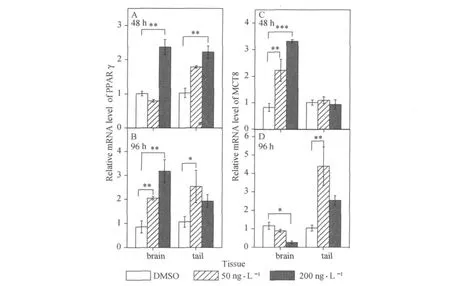
图5 TBT对热带爪蟾(Xenopus tropicalis)蝌蚪(NF51)脑和尾巴PPARγ和MCT8 mRNA表达的影响Fig.5 Effects of tributyltin on PPARγand MCT8 mRNA expressions in the brains and tails of Xenopus tropicalis tadpoles
过氧化物酶体增殖物激活受体(PPARs)是调节目标基因表达的核内受体转录因子超家族,可与RXR结合形成异二聚体PPAR-RXR[19].在本实验中PPARγmRNA在48 h和96 h暴露后,在蝌蚪脑和尾巴中比对照组均有明显增加,进一步表明TBT有可能与RXR相结合.MCT8是细胞间转运甲状腺激素的特殊蛋白[20,21].暴露组MCT8 mRNA在尾巴中也有明显增加,表明TBT能够引起甲状腺激素向细胞转运的过程.
3 结 论
本文运用TBT对热带爪蟾NF51阶段蝌蚪进行短时间暴露.结果表明,TBT能引起蝌蚪头部和尾部多个甲调基因mRNA表达的变化,但mRNA的表达具有明显的组织差异性.这些mRNA涉及到甲状腺激素的合成、运输、转化、合成和代谢等多个过程,表明TBT对爪蟾具有甲状腺激素干扰效应.同时,通过对一些相关基因mRNA的表达的检测表明TBT可能通过与RXR结合而对蝌蚪产生甲状腺激素干扰效应.由此可见,分子指标在筛选甲状腺激素干扰物的过程中不仅具有快速灵敏的特点,而且有助于解析污染物的致毒作用模式.
[1] CHAMP M A.A review of organotin regulatory strategies,pending actions,related costs and benefits[J].Sci Total Environ,2000,258:21-71.
[2] HALL L W.Tributyltin environmental studies[J].Mar Pollut Bull,1988,19:431-438.
[3] CARLSSON G,KULKARNI P,LARSSON P,et al.Distribution of BDE-99 and effects on metamorphosis of BDE-99 and-47 after oral exposure in Xenopus tropicalis [J].Aquat Toxicol,2007,84:71-79.
[4] RUDEL H,MULER J,STEINHANSES J,et al.Retrospective monitoring of organotin compounds in freshwater fish from1988 to 2003:Results from the German environmental specimen bank[J].Chemosphere,2007,66(10):1884-1894.
[5] SHI H H,HUANG C J,YU X J,et al.Generalized system of imposex and reproductive failure of females in gastropods along the coastal waters of Mainland China[J].Mar Ecol Prog Ser,2005,304:179-189.
[6] OEHIMANN J,BENEDETTO P D,TILLMANN M,et al.Endocrine disruption in prosobranch mollusks:evidence and ecological relevance[J].Ecotoxicology,2007,16:29-43.
[7] 王蕾,刘青坡,郭素珍,等.TBT对非洲爪蟾甲状腺组织的影响 [J].华东师范大学学报:自然科学版,2008(6):75-81.
WANG L,LIU Q P,GUO S Z,et al.Effects of tributyltin on thyroid histology of Xenopus laevis[J].Journal of East China Normal University:Natural Science,2008(6):75-81.
[8] SHI Y B,RITCHIE J W,TAYLOR P M.Complex regulation of thyroid hormone action:multiple opportunities for pharmacological intervention[J].Pharmacol Therapeut,2002,94(3):235-251.
[9] KRAIN L P,DENVER R J.Developmental expression and hormonal regulation of glucocorticoid and thyroid hormone receptors during metamorphosis in Xenopus laevis[J].Endocrinol,2004,181(1):91-104.
[10] JAGNYSCH O,OPITZ R,LUTZ I,et al.Effects of tetrabromobisphenol A on larval development and thyroid hormone-regulated biomarkers of the amphibian Xenopus laevis[J].Environ Res,2006,101:340-348.
[11] HUANG H,CAI L,REMO B F,et al.Timing of metamorphosis and the onset of the negative feedback loop between the thyroid gland and the pituitary is controlled by typeⅡiodothyronine deiodinase in Xenopus laevis[J].Proc Natl Acad Sci USA,2001,98(13):7348-7353.
[12] CAI L,BROWN D D.Expression of type II iodothyronine deiodinase marks the time that a tissue responds to thyroid hormone 2induced metamorphosis in Xenopus laevis [J].Dev Biol,2004,266(1):87-95.
[13] HELBING C C,BAILEY C M,JI L,et al.Identification of gene expression indicators for thyroid axis disruption in a Xenopus laevis metamorphosis screening assay.Part 1.Effects on the brain[J].Aquat Toxicol,2007,82(4):227-241.
[14] OPITZ R,LUTZ I,NGUYEN N H,et al.Analysis of thyroid hormone receptor beta mRNA expression in Xenopus laevis tadpoles as a means to detect agonism and antagonism of thyroid hormone action[J].Toxicol Appl Pharmacol,2006,212(1):1-13.
[15] 裘佳,陈虹,黄秉仁.甲状腺激素受体在调节靶基因转录中的激活和抑制作用 [J].生命的化学,2009,29(3):370-373.
QIU J,CHEN H,HUANG B R.Transcriptional activation and repression regulation in target gene by thyroid hormone receptors[J].Life Chem,2009,29(3):370-373.
[16] LI D,YAMADA T,WANG F,et al.Novel roles of retinoid X receptor(RXR)and RXR ligand in dynamically modulating the activity of the thyroid hormone receptor/RXR heterodimer[J].Biol Chem,2004,279(9):7427-7437.
[17] NISHIKAWA J.Imposex in marine gastropods may be caused by binding of organotins to retinoid X receptor[J].Mar Biol,2006,149:117-124.
[18] IWAMURO S,YAMADA M,KATO M,et al.Effects of bisphenol A on thyroid hormone-dependent up-regulation of thyroid hormone receptorαandβand down-regulation of retinoid X receptorγin Xenopus tail culture[J].Life Sci,2006,79:2165-2171.
[19] BORDJI K,GIRLLASEA J P,GOUZE J N,et al.Evidence for the presence of peroxisome proliferator-activated receptor(PPAR)αandγand retinoid receptor in cartilage PPARγactivation modulates the effects of interleukin-1βon rat chondrocytes[J].Biol Chem,2000,275:12243-12250.
[20] FRIESEMA E C,GANGULY S,ABDALLA A,et al.Identification of momocarboxylate transporter 8 as a specific thyroid hormone transporter[J].Biol Chem,2003,278(41):40128-40135.
[21] FRIESEMA E C,KUIPER G G,JANSEN J,et al.Thyroid hormone transport by the human momocarboxylate transporter 8 and its rate-limiting role in intracellular metabolism[J].Mol Endocrinol,2006,20(11):2761-2772.
Effects of tributyltin on mRNA expressions of thyroid hormone response genes in Xenopus tropicalis tadpoles
CAO Qing-zhen, ZHU Pan, YUAN Jing, ZHANG Xiao-li,LIU Jun-qi, HUANG Min-sheng, SHI Hua-hong
(Shanghai Key Laboratory of Urbanization Processes and Ecological Restoration,Department of Environment Science,East China Normal University,Shanghai 200062,China)
Xenopus tropicalis tadpoles(NF51)were exposed to TBT for 48 and 96 h,respectively.Exposures to 50 and 200 ng·L-1TBTCl showed no effects on the survival rate of tadpoles.The expression of TRβand DI3 mRNA were significantly increased in the tails by 1~2.3fold in the groups treated with 50 ng·L-1TBTCl.The expression of TSHβmRNA was increased in the tails by 2 fold after 48 h of exposure.RXRαmRNA was decreased by 0.4 fold in the brains and tails,and RXRβmRNA was increased by 5.9 fold in the tails after 96 h of exposure.MCT8 mRNA was increased by nearly 3 fold in the tails in 50 ng·L-1TBT treatment group and decreased by 3 fold or so in the brains in50 ng·L-1TBT treatment group after 96 h of exposure.These results suggest that TBT can result in the changes of multiple mRNA expressions and show high tissue-specific differences.These mRNA are involved in the synthesis,transportations,transformations and actions,which indicate that TBT shows thyroid hormone disrupting effects.The changes of related mRNA expressions indicate that TBT might disrupt the thyroid hormone system of tadpoles by binding with retinoid X receptor.Therefore,biomarkers are not only cost-effective and sensitive endpoints in screening the thyroid disrupting chemicals but also useful in identifying the mode of action of contaminants.
Xenopus tropicalis; TBT; thyroid hormone response genes expressions
Q948
A
10.3969/j.issn.1000-5641.2011.06.008
1000-5641(2011)06-0065-10
2010-12
国家自然科学基金(20877023);国家科技重大专项(2009ZX07317-006)
曹庆珍,女,硕士研究生.E-mail:zhen13953954115@126.com.
施华宏,男,副教授,研究方向为生态毒理学.E-mail:hhshi@des.ecnu.edu.cn.
