siRNA干扰 HIF-1α表达对高糖高胰岛素诱导的肥大心肌细胞的影响
2011-12-15李延辉于艳秋
李延辉 吴 伟 于艳秋
siRNA干扰 HIF-1α表达对高糖高胰岛素诱导的肥大心肌细胞的影响
李延辉 吴 伟*于艳秋1
(中国医科大学附属第一医院急诊科,沈阳110001;1中国医科大学基础医学院病理生理学教研室,沈阳110001)
目的 研究胰岛素受体底物1(insulin receptor substrate 1,IRS1)和缺氧诱导因子1a(hypoxia induciblefactor 1a,HIF-1a)在高糖高胰岛素诱导的肥大心肌细胞中的表达及其之间的关系;观察siRNA沉默HIF-1a基因对高糖高胰岛素诱导的心肌细胞肥大的影响。方法 新生大鼠心肌细胞培养48h后,换用无血清DMEM培养液并分别加入高糖高胰岛素、高糖高胰岛素+HIF-1a-siRNA培养48h,未加入任何药物的心肌细胞在无血清DMEM培养液中继续培养48h作为对照。通过心肌细胞表面积、总蛋白含量指标检测心肌细胞肥大,并利用Real time PCR检测转染前后HIF-1a mRNA表达变化及免疫细胞化学方法检测 HIF-1a及IRS1蛋白水平的表达。结果 高糖高胰岛素可增加心肌细胞表面积、总蛋白含量、HIF-1a mRNA以及 HIF-1a表达,并降低IRS1表达。转染siRNA后使 HIF-1a基因的表达下降,能部分抑制心肌细胞的肥大,降低心肌细胞表面积和总蛋白含量,但对IRS1表达的影响不明显。在对正常对照组和高糖高胰岛素组中IRS1表达量与 HIF-1a表达量进行相关分析表明,两者的表达量成负相关。结论 通过siRNA技术对 HIF-1a的有效沉默可明显地抑制高糖高胰岛素诱导大鼠乳鼠心肌细胞肥大,并且这种作用可能是通过作用于IRS1/PI3K/Akt/M TOR途径来实现的。
缺氧诱导因子1a(HIF-1a); RNA干扰; 胰岛素受体底物1(IRS1); 高糖高胰岛素; 心肌细胞肥大
糖尿病心肌病(Diabetes cardiomyopathy,DCM)是高糖直接侵蚀心肌的结果,是独立于冠心病和高血压以及其他心肌病变的心脏病,其自然病史是一个潜在的亚临床期,在这期间心肌细胞逐渐受到侵蚀,缓慢地出现心肌纤维化和心肌肥厚。在心肌肥厚过程中,高糖高胰岛素血症诱导作用与心肌细胞蛋白的合成及心肌细胞肥大密切相关[1-4],但其中发生发展机制目前尚不完全清楚。最近资料表明胰岛素可通过激活蛋白激酶B(protein kinase B,PKB)增加缺氧诱导因子1a(hypoxia inducible factor 1 alpha,HIF-1a)的蛋白表达水平[5,6],而 HIF-1a表达增多与高糖高胰岛素诱导的心肌细胞肥大之间的关系尚不明确。本实验利用培养的心肌细胞,在高糖高胰岛素诱导心肌细胞肥大的基础上,应用siRNA沉默 HIF-1a基因,观察心肌细胞肥大变化情况,并且通过与胰岛素受体底物1(insulin receptor substrate 1,IRS1)进行相关分析,探讨 HIF-1a基因在高糖高胰岛素诱导心肌细胞肥大时表达变化及其与IRS1的相关性。
材料和方法
1.主要试剂
胰蛋白酶(天津灏洋生物制品科技有限公司),胰岛素、葡萄糖、Ⅱ型胶原酶(sigma),胎牛血清、DMEM低糖培养液(hyclone),BCA蛋白定量试剂盒、兔抗大鼠 HIF-1a多克隆抗体、免疫组化SABC试剂盒(武汉博士德工程有限公司),兔抗大鼠IRS1多克隆抗体(北京博奥森公司),兔抗大鼠心肌肌钙蛋白I(c TnI)抗体(Santa Cruz),FITC标记羊抗兔二抗(北京中杉金桥生物技术有限公司),trizol试剂(invitrogen),real time-PCR试剂盒(Ta KaRa),HIF-1a的 引 物 F:5’CACTGGTGGCTCA GCA GTCTA-3’,R:5’GGA GCTGTGAA TGTGCTGTGA-3’磷酸核糖体磷蛋白 PO(Arbp)F:5’CAGA TGGA TCGGCCA GGAA-3’,R:5’GCGTCTGT CTGCA GA TTGGCTA-3’(上海生工生物有限公司),针对 HIF-1a的siRNA序列由上海吉玛制药技术有限公司合成,基因序列为:sense 5’GCCUCUUCGACAA GCUUAA TT 3’,anti-sense5’UUAA GCUU GUCGAA GA GGCTT 3’。脂质体Lipofectamine2000为 Invitrogen公司产品。
2.动物
1-2d的 Wistar大鼠乳鼠,雌雄不拘,由中国医科大学实验动物部提供。
3.实验方法
3.1 心肌细胞培养
取1-2d的 Wistar大鼠乳鼠5只,无菌条件下开胸取出心脏,用预冷的D-Hanks液洗涤1遍,然后将心脏的心室分离下来,再用预冷的D-Hanks液洗涤2遍,剪成约lmm3碎块,加入 4-5倍体积的0.06%的胰酶并放入37℃恒温振荡水浴箱中,震荡(频率:75r/min)消化心肌组织7.5min,第一次消化后自然沉淀并弃上清,并用D-Hanks液洗涤1遍,然后从第二次开始用0.08%Ⅱ型胶原酶消化四次,每次消化时间为7.5min,消化前后各吹打20次左右,自然沉淀后,吸出每次分离的上清液加等量含lO%胎牛血清的DMEM低糖培养液,吸入两个15ml离心管中,经200目滤网过滤,然后4℃850r/min离心8min,离心后,弃掉上清,各加入1.5ml培养液,轻轻吹打制成均匀的细胞悬液,并将两个细胞悬液混合,放入六孔板的两个孔中,再放CO2培养箱培养60min后,同样方法再次分别放入6孔板的另两个孔中,前2d滴入5-溴脱氧尿嘧啶核苷(Brdu)使其终浓度为 0.1mmol/L,并继续培养,24h、48h都进行换液。
3.2 心肌细胞转染
细胞培养48h后,将配制的siRNA-Lip混合液加入含有细胞和转染液的孔(6孔板或24孔板)中,使每孔转染总体积为lml(六孔板)和0.5ml(24孔板),37℃培养6h;换新鲜含高糖高胰岛素培养液培养培养48h。
3.3 细胞分组
正常对照组:(A组,不加入任何处理因素,5.5mmol/L葡萄糖);高糖高胰岛素培养组(B组,25.5mmol/L葡萄糖+10-7mmol/L胰岛素);干扰组:高糖高胰岛素+HIF-1a-siRNA培养组(C组,含siRNA-Lip混合液的DMEM高糖高胰岛素培养液)、脂质体对照组(含Lip-2000的DMEM高糖高胰岛素培养液)、阴性错配对照组(含Lip-2000的DMEM高糖高胰岛素培养液加错配的siRNA),分别作用48h后备测。
4.心肌细胞肥大检测
4.1 心肌细胞面积测定
取24孔板中有心肌细胞生长的玻片,预冷DHanks液漂洗血清及杂质,4%多聚甲醛固定15min,利用细胞免疫荧光法,得心肌细胞免疫荧光照片后,用MetaMorp h/DP10/BX41医学显微图像分析系统(US/JP,UIC/OL YMPUS公司)测量单个细胞表面积,每张玻片测5个视野,每个视野测l0-l5个细胞,取其平均值。每组重复3次。
4.2 心肌细胞蛋白含量测定
收集六孔板内各组细胞,制成细胞悬液,计数每孔心肌细胞数,沉淀细胞后加入2-3倍体积的细胞裂解液,使心肌细胞膜溶解,离心后吸取上清,用BCA法测定心肌细胞蛋白含量。
5.实时荧光定量聚合酶链反应 (Real-Time Poly-merase Chain Reaction,Real-Time PCR)检测HIF-1a mRNA的表达
5.1 RNA的提取及cDNA的合成
用六孔板培养的心肌细胞进行总 RNA提取(参照 Trizol试剂盒说明逐步操作),成功提取后,用紫外分光光度计测定波长260nm和280nm处吸光度值,计算A260/A280比值(OD值),确定 RNA的含量、浓度和纯度。
5.2 Real-Time PCR
参照Real-Time PCR试剂盒要求的条件对提取的总RNA进行逆转录反应,均采用10μl反应体系,所得cDNA用于 PCR扩增,取10μl PCR扩增产物,使用 TP800 Real-Time PCR仪(Ta KaRa公司),按照试剂说明书提供的参考用量及终浓度范围,制备PCR反应混合液。用25μl反应体系,以最佳 PCR条件,具体如下:95℃,5min;40个 PCR循环(95℃,10s;60℃,20s;72℃,20s;79℃,20s(收集荧光))。为了建立PCR产物的熔解曲线,扩增反应结束后,(95℃,2min;60℃,20s;72℃,20s;99℃,15s,并从72℃缓慢加热到99℃(8min),PCR产物以2%琼脂糖凝胶电泳验证结果,再由 PCR仪采集、分析荧光信号,自动生成荧光强度曲线,计算反应体系中待测基因 HIF-1a及管家基因Arbp的Ct值。计算方法采用双标准曲线法,求出目的基因的相对含量。每组2个复孔(每孔重复3次)。
6.细胞免疫组化检测HIF-1a和IRS1的蛋白表达
取24孔板中有心肌细胞生长的玻片,按照SABC试剂盒说明进行,HIF-1a和IRS1抗体滴度都为1:150,DAB显色。
7.统计学处理
数据分析采用 SPSS 17.0计算机统计软件,计量资料实验数据用均数±标准差(¯x±s)表示,多组均数间的比较采用单因素方差分析,方差齐者用LSD检验,方差不齐者用 Games-Howell检验;相关分析数据采用person相关分析,P<0.05为差异有统计学意义。
结 果
1.HIF-1α-siRNA对高糖高胰岛素诱导的肥大心肌细胞面积的影响
各组间加入不同处理因素48h后,利用细胞免疫荧光法,得心肌细胞图形,测各孔细胞表面积,以对照组心肌细表面积作为100%,高糖高胰岛素培养组的心肌细胞的表面积(134±15)%与对照组相比显著增加(P<0.01),加入 HIF-1a-siRNA的干扰组的心肌细胞表面积(110±7)%与高糖高胰岛素培养组的心肌细胞表面积相比明显降低(P<0.01),与对照组相比仍有增高(P<0.01)(见图1、表1)。

表1 HIF-1a-siRNA对高糖高胰岛素诱导的肥大心肌细胞的表面积和蛋白含量的影响(¯x±s)Table 1 Effects of HIF-1a-siRNA on the Cell surface area and protein levelof hypertrophic cardiomyocytes of neonatal rats induced by high glucose and high insulin(¯x ±s)
2.HIF-1α-siRNA对高糖高胰岛素诱导的肥大心肌细胞蛋白含量的影响
同上加入不同处理因素48h后,用BCA蛋白定量法测定蛋白含量(以104个细胞为测量单位)。与正常对照组相比,高糖高胰岛素培养组心肌细胞蛋白含量增加37.4%(P<0.01),与高糖高胰岛素组相比,加入 HIF-1a-siRNA的干扰组的心肌细胞蛋白含量减少24.3%(P<0.01),但与对照组相比仍增高13.1%(P<0.01)(见表1)。
3.HIF-1α-siRNA对高糖高胰岛素诱导的肥大心肌细胞HIF-1a mRNA的影响
同上加入不同处理因素48h后,用 Real-Time PCR方法对 HIF-1a mRNA进行定量分析(采用相对量表示)。与正常对照组相比,高糖高胰岛素培养组心肌细胞中 HIF-1a mRNA量增加2.26(P<0.01),与高糖高胰岛素组相比,加入 HIF-1a-siRNA的干扰组的心肌细胞中HIF-1a mRNA量减少1.72(P<0.01),但与对照组相比,仍增高 0.54(P<0.01)(见表 1,图 2)。
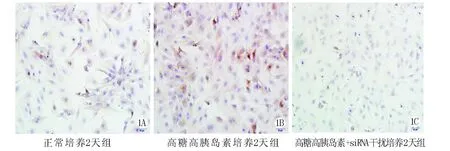
图1 不同处理因素下心肌细胞中 HIF-1α表达的情况(×400)Fig.1 Effects of Different factors on HIF-1αof hypertrophic cardiomyocytes of neonatal rats(×400).
4.HIF-1α-siRNA对高糖高胰岛素诱导的肥大心肌细胞 HIF-1a及IRS-1表达的影响
同上加入不同处理因素48h后,用细胞免疫组织化学方法对 HIF-1a及IRS-1蛋白表达量进行分析。与正常对照组相比,高糖高胰岛素培养组心肌细胞中 HIF-1a蛋白表达量增加 4.407%(P<0.01),而 IRS-1蛋白表达量减少 1.006%(P<0.01),与高糖高胰岛素组相比,加入 HIF-1α-siRNA的干扰组的心肌细胞中 HIF-1a减少2.057%(P<0.01),而 IRS-1 减少 0.004%(P>0.05),但与对照组相比,HIF-1a蛋白表达量仍增高2.35%(P<0.01),IRS-1蛋白表达量仍有减少1.01%(P<0.01)(见图 3、表 2)。

图2 Realtime PCR产物 HIF-1a(169bp)和 Arbp(127bp)的凝胶电泳结果Fig.2 Results of real time PCR products of HIF-1a(169bp)and Arbp(127bp)of the gel electrophoresis

图3 不同处理因素下心肌细胞中IRS-1表达的情况Fig.3 Effects of Different factors on IRS-1 of hypertrophic cardiomyocytes of neonatal rats(×400)
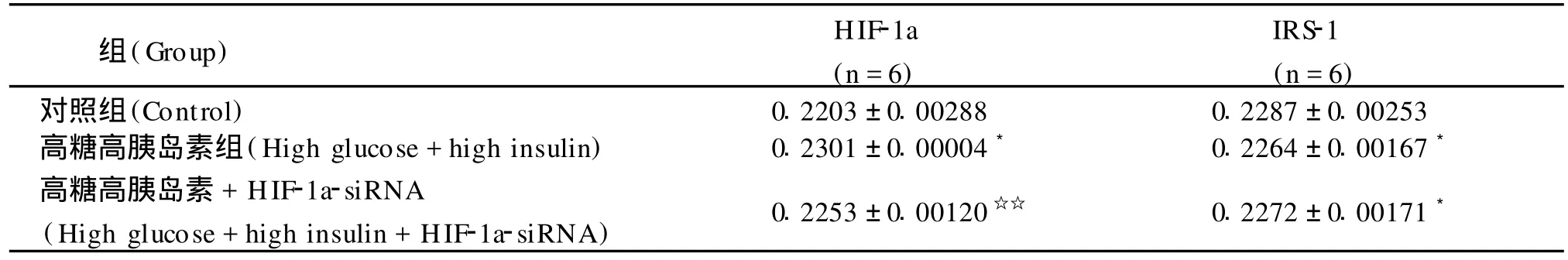
表2 HIF-1α-siRNA对高糖高胰岛素诱导的肥大心肌细胞 HIF-1a及IRS-1表达平均光密度的影响(¯x±s)Table 2 Effects of HIF-1a-siRNA on average optical density of HIF-1a and IRS-1 of hypertrophic cardiomyocytes of neonatal rats induced by high glucose and high insulin(¯x ±s)
5.心肌细胞中 HIF-1a与 IRS1相关性分析在正常对照组与高糖高胰岛素培养组两组中,心肌细胞中HIF-1a表达含量明显与IRS-1表达含量表达成负相关,相关系数r=-0.915。
讨 论
DCM的发病机制复杂,目前尚不十分清楚,如何采取针对性的干预措施,降低糖尿病患者DCM的发病率和提高患者的生存质量,是今后国际上研究的热点之一。
近年来,研究发现[3],在DCM发生心肌细胞肥大过程中高糖高胰岛素具有重要的作用,然而高糖高胰岛素引起心肌肥大的作用机制尚不明确。这种高血糖的代谢变化可能与胰岛素受体底物(Insulin receptor substrate,IRS)/磷酯酰肌醇-3-激酶(phosphatidylinos-itol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB or Akt)/哺乳动物雷帕霉素靶点(mammalian target of rapamycin,m TOR)信号途径有一定关系[6,7],此信号途径中的m TOR可通过p70s6k的磷酸化状态而启动翻译过程进而促进多种蛋白表达包括 HIF-1a[8]。这些蛋白表达的变化将暗含着心肌将从适应性的心肌肥厚到心脏衰竭,影响心脏功能[9,10]。Laughner[11]等研究表明,常氧时PI3K/Akt/m TOR对 HIF-1a的诱导与缺氧对 HIF-1a的诱导不同,可能是通过增加 HIF-la的蛋白合成,而不是通过抑制 HIF-1a的降解实现的。在IRS/PI3 K/Akt/m TOR这条信号途径中,IRS包括 IRS-1、IRS-2、IRS-3和 IRS-4,其中 IRS-1最为重要,它作为码头蛋白结合和激活包括胰岛素在内的信号传导分子,它是胰岛素与其受体结合发挥生物学效应的一个重要介质,特别是在胰岛素代谢效应方面(促进肌肉、脂肪组织摄取利用葡萄糖),它起了主要作用,同时在调节胰岛素分泌过程中它也起到了主要作用[12]。
研究结果显示,HIF-1a-siRNA可部分抑制由高糖高胰岛素引起的心肌细胞肥大,这是由于 HIF-1a-siRNA抑制了 HIF-1a的表达,进而可能减少HIF-1a诱导蛋白的表达。在A和B组中,HIF-1a表达增多,而IRS-1表达减少,两者存在一定的负相关性,表明 IRS-1是其上游信号点,可能通过而IRS/PI3K/Akt/m TOR途径调控的 HIF-1a表达。还有,高糖高胰岛素刺激下,IRS-1表达减少,而HIF-1a表达增多可能与胰岛素抵抗有关。在2型糖尿病患者中,高血糖通过IRS-1的酪氨酸磷酸化抑制细胞内IRS-1蛋白的表达,进而抑制了胰岛素信号传导,引起胰岛素抵抗。而有人通过实验对此提出异议,特异性地破坏IRS-1的老鼠仅表现轻度胰岛素抵抗,不表现明显的糖尿病,这些提示 IRS-1在胰岛素代谢信号传递中不起作用,辅助通路可能代偿 IRS-1的缺乏[13]。本实验表明,IRS-1/PI3K/Akt信号通路可能参与了与 HIF-1a表达增加有关的心肌肥大反应过程;HIF-1a-siRNA可能通过上述途径抑制了胰岛素所致心肌肥大作用从而降低了心肌细胞的表面积和总蛋白含量。总之,高糖高胰岛素所致心肌细胞肥大的作用机制与其有关的细胞信号转导通路之间的关系非常复杂。因此,与其相关的信号通路在心肌细胞肥大发生过程中的作用机制尚需深入研究。
[1]Asghar O,Alsunni A,Khavandi K,et al.Diabetic cardiomyopathy.Clinical Science,2009,116(10):741-760
[2]Khavandi K,Khavandi A,Asghar O,et al.Diabetic cardiomyopathy- a distinct disease?.Clin Endocrinol Metab,2009,23(3):347–360
[3]Boll D,McDermott BJ.Effects of rosiglitazone and interaction with growth-regulating factors in ventricular cell hypertrophy.Eur J Pharmacol,2005,508(1):69-76
[4]Liao Y,Takashima S,Zhao H,et a1.Control of plasma glucose with alpha-glueosidase inhibitor attenuates oxidative stress and slows the progression of heart failure in mice.Cardiovasc Res,2006,70(1):107-116
[5]Tang X,Zhang Q,Shi S,et al.Bisphosphonates suppress insulin-like growth factor 1-induced angiogenesis via the HIF-1alpha/VEGF signaling pathways in human breast cancer cells.Int J Cancer,2010,126(1):90-103
[6]Jiang S,Gavrikova TA,Pereboev A,et al.Adenovirus infection results in alterations of insulin signaling and glucose homeostasis. Am J Physiol Endocrinol Metab,2010,298(6):E1295-304
[7]Ji R,Chou CL,Xu W,et al.EP1 prostanoid receptor coupling to Gi/o up-regulates the expression of hypoxia-inducible factor-1 alpha through activation of a phosphoinositide-3-kinase signaling pathway.Mol Pharmacol,2010,77(6):1025-1036
[8]Miyazawa M,Yasuda M,Fujita M,et al.Granulosa cell tumor with activated m TOR-HIF-1alpha-VEGF pathway.J Obstet Gynaecol Res,2010,36(2):448-453
[9]Canedo CS,Demeulder B,Ginion A,et al.Activation of the cardiac mTOR/p70S6K pathway by leucine requires PDK1 and correlates with PRAS40 phosphorylation.Am J Physiol Endocrinol Metab,2010,298(4):E761-769
[10]Koshikawa N,Hayashi JI,Nakagawara A,et al.Reactive Oxygen Species-generating Mitochondrial DNA Mutation Up-regulates Hypoxia-inducible Factor-1_Gene Transcription via Phosphatidylinositol 3-Kinase-Akt/Protein Kinase C/Histone Deacetylase Pathway.Biological Chemistry,2009,284(48):33185-33194
[11]Laughner E,Taghavi P,Chiles K,et al.HER2(neu)signaling increases the rate of hypoxia-inducible factor 1alpha(HIF-1alpha)synthesis:novel mechanism for HIF-1-mediated vascular endothelial growth factor expression.Mol Cell Biol,2001,21:3995-4004
[12]Dearth RK,Cui X,Kim HJ,et al.Oncogenic transformation by the signaling adaptor proteins insulin receptor substrate(IRS)-1 and IRS-2.Cell Cycle,2007,6(6):705-713
[13]Celi FS,Negri C,Tanner K,et al.Molecular scanning for mutations in the insulin receptor substrate-1(IRS-1)gene in Mexican Americans with Type 2 diabetes mellitus.Diabetes Metab Res Rev,2000,16(5):370-377
Effect of HIF-1α-siRNA on cardiomyocyte hypertrophy induced by high glucose and insulin in neonatal rats
Li Yanhui,Wu Wei﹡,Yu Yanqiu1
(Department of Emergency,The Af f iliated Hospital,China Medical University,Shenyang 110001;1Department of Pathophysiology,Basic Medical College,China Medical University,Shenyang 110001,China)
Objective The expression of insulin receptor substrate 1(IRS1)and hypoxia inducible factor 1a(HIF-1a)in myocardial hypertrophy induced by high glucose and insulin as well as their relationship were studied;The effect of siRNA silencing HIF-1a gene on such cardiomyocyte hypertrophy was observed.Methods Cardiomyocytes of neonatal rats were cultured for 48 hours,and then treated with high glucose plus high insulin or high glucose plus high insulin plus HIF-1a-siRNA in serum f ree DM EM for another 48 hours,w hile control cardiomyocytes were continuously cultured in serum f ree DM EM for another 48 hours.Cardiomyocyte hypertrop hy was determined by myocardial cell surface area and total protein content.HIF-1a mRNA was examined by real time PCR,and the expressions of HIF-1a and IRS1 proteins were detected by immunocytochemistry.Results The cellular surface area,total protein content,HIF-1a and HIF-1a mRNA were significantly increased af ter treatment with high glucose and insulin compared with those of the controls,while IRS1 was significantly decreased.Af ter HIF-1a-siRNA was transfected to cardiac cells of neonatal rats,the cellular surface area and total protein content were decreased,but IRS1 was not significantly affected.The expressions of HIF-1a and IRS1 showed a negative correlation in the control group and the group of high glucose and insulin.Conclusion The application of siRNA targeting HIF-1a can effectively lessen cardiac hypertrophy of neonatal rats induced by high glucose and high insulin,and this effect may be achieved by acting on the IRS1/PI3K/Akt/MTOR pathway.
Hypoxia inducible factor 1a; RNA interference;insulin receptor substrate 1;High glucose and insulin; Myocardial hypertrophy
R322.57
A
10.3870/zgzzhx.2011.03.008
2011-02-14
2011-04-17
辽宁省教育厅科研项目资助(L2010684)
李延辉,男(1984年),汉族,硕士研究生。
*通讯作者(To whom correspondence should be addressed)
