Zn2+-Ida2--CO32--H2O体系浸出液中锌的回收及浸出剂的再生
2011-12-14窦爱春杨天足吴江华张杜超杨际幸
窦爱春,杨天足,吴江华,张杜超,杨际幸,王 安
(中南大学 冶金科学与工程学院,长沙 410083)
氧化锌矿的湿法处理方法主要包括酸浸[1-3]、氨浸[4-5]及碱浸[6-8]工艺,酸浸工艺因为其体系本身为酸性介质,对主金属 Zn溶解不具选择性,浸锌过程中杂质Ca、Mg、Si和Fe等大量溶解。相对而言,氨浸及碱浸工艺对锌有很好的选择性,因此,在处理含锌低于10%的低品位氧化锌矿时,酸浸工艺不如氨浸和碱浸工艺有优势。无论是氨浸还是碱浸工艺,在处理含锌低于10%的低品位氧化锌矿时,均存在着从低浓度的含锌浸出液中回收锌的问题。液固比不同,浸出液中锌浓度也有所不同,一次浸出液中锌含量一般低于20 g/L。
从低浓度含锌浸出液中回收锌的方案主要分为锌富集和锌直接沉积两类。锌富集方案主要包括循环浸出富集和溶剂萃取富集。循环浸出过程中锌富集于原体系中留待后续处理,浸出液经多次循环浸出后,其锌浓度可达电积沉锌要求。唐谟堂等[9]研究了MACA体系循环浸出某含锌 6.59%的低品位氧化锌矿,控制浸出条件如下:常温、液固比(L/S)4:1、搅拌速度300 r/min、浸出时间3 h,体系循环浸出10次以上,其浸出液中锌浓度高于33 g/L,浸出液净化后电积可得1#电锌。但循环浸出过程中需开路出部分浸出液,并添加新鲜浸出剂后方能保证锌浸出率;电积沉锌过程中部分 NH3在阳极区被氧化为 N2而损耗,电积残液返回浸矿时亦需要补充新鲜浸出剂。溶剂萃取富集方案中,锌富集于反萃液中留待后续处理。氨浸工艺中研究较多的萃取剂[10-14]为 P204、Lix54、Cyanex923和Cyanex272等,P204萃锌的主要问题是萃取过程中大量NH3进入负载有机相,反萃时酸耗较高,且含铵的硫酸锌反萃液在电积提锌时存在许多不易解决的问题;其他几种萃取剂萃锌时都存在着价格昂贵、工艺参数较难控制、萃取动力较小等许多缺点,因此,利用溶剂萃取富集锌的工艺没有得到广泛应用。锌直接沉积方案主要包括电沉积、添加沉淀剂沉淀方案,用电沉积方案从含锌低于20 g/L的浸出液中提锌时效率不高,因为在传统湿法炼锌工艺中,电沉积提锌后的残液中锌浓度高于20 g/L(一般为30~60 g/L),所以直接采用电沉积法从低浓度锌液中提锌时必然导致锌提取率不高、电流效率低的问题。王成彦等[15]研究了从含锌 18 g/L的 NH3-(NH4)2SO4体系浸出液中电积提锌,控制电流密度200 A/m2、槽电压(过程中平均槽电压)2.8 V,阴极可得致密锌片,产品达 1#电锌标准,但电积后液中残锌为 15g/L,电流效率仅为 86%,计算其锌提取率仅为 16.7%。根据锌沉淀产物的不同,可选用不同的沉淀剂沉锌,如氨浸工艺中[16-17]加CO32-(或直接蒸氨)使锌以碱式碳酸锌沉淀加以回收,碱浸工艺中[18]加S2-使锌以ZnS形式加以回收,但此类锌沉淀方案难以应用于低浓度含锌浸出液中的锌回收,主要原因是浸出液中锌浓度较低,所需沉淀剂量较大,大量沉淀剂的加入影响原有浸出体系,使浸出剂再生利用困难。
本文作者利用亚氨基二乙酸体系浸出云南兰坪某低品位氧化锌矿(含锌低于 10%),所得浸出液中含锌量低于15 g/L,锌回收困难,且工艺所用试剂亚氨基二乙酸(Iminodiacetic acid, IDA)价格昂贵。因此,浸出液中低浓度锌的回收及浸出剂的再生利用问题将是该体系处理低品位氧化锌矿成败的关键。本文作者以CaO为沉淀剂从低浓度含锌浸出液中直接沉锌,使锌以粗氧化锌形式加以回收;回收锌后的溶液采用CO2调酸沉钙工艺脱除溶液中积累的钙离子,从而使浸出剂得以再生,取得了较好的效果。
1 实验
1.1 原料
实验所用氧化锌矿取自云南兰坪,原料经破碎和球磨后,其中95%的粒度小于150 μm,其主要化学成分与锌物相组成分别列于表1和 2。由表1和 2 可知,试料中锌含量较低,仅为 7.72%,非硫化态锌为6.37%。

表1 低品位氧化锌矿的化学成分Table 1 Chemical composition of low grade zinc oxide ores(mass fraction, %)

表2 低品位氧化锌矿中锌物相组成Table 2 Phase composition of Zn in low grade zinc oxide ores (mass fraction, %)
1.2 工艺流程
图1所示为Ida2--H2O体系处理低品位氧化锌矿的原则流程。该流程主要包括以下工序:低品位氧化锌矿的浸出;浸出液中锌回收(沉锌);沉锌后液中沉钙(浸出剂再生);沉钙后液(再生后的浸出剂)浸矿。工艺显著特点是再生后的浸出剂可直接用于浸矿,过程中无需补充浸出剂。沉钙工序中所得CaCO3煅烧后可循环利用。
1.3 实验原理及方法
1.3.1 浸出实验

图1 Ida2--H2O体系处理低品位氧化锌矿的工艺流程Fig.1 Flowsheet of processing low grade zinc oxide ore in Ida2--H2O system
本文作者曾对亚氨基二乙酸体系浸出低品位氧化锌矿实验条件进行优化,并研究了浸出过程中主金属锌及相关杂质在体系中的溶解行为。确定了浸出条件如下:液固比(L/S)为 5:1、配体亚氨基乙酸根总浓度([Ida2-]T)为1.0 mol/L、反应温度70℃、反应pH值8、反应时间4 h。在最优实验条件下,脉石类杂质Ca、Mg、Si和杂质Fe不会大量溶解,伴生有价金属Pb、Cd、Cu、Ni可部分随主金属Zn进入浸出液,浸出液中锌主要以Zn(Ida)22-配离子形式存在。
本浸出实验仅供浸出液制备及再生后的浸出剂返回浸矿用,实验在1 000 mL烧杯中进行,矿样规模为200 g/次,按上述优化条件浸出,采用恒温水浴加热,磁力搅拌速度固定为300 r/min。固液分离后,滤渣用少量去离子水洗涤,洗涤后的水与滤液混合后计量。
1.3.2 沉锌实验
25 ℃、[Ida2-]T为1 mol/L时,根据浸出液中可能存在的平衡锌相,绘制 Zn2+-Ida2--CO32--H2O体系[Zn2+]T—pH曲线,结果如图2所示。由于Ksp(Zn(OH)2)>Ksp(ZnO),体系中ZnO沉淀先于Zn(OH)2出现,因此,图2中并未考虑Zn(OH)2固相。由[Zn2+]T—pH图可见,pH>11时,体系中锌平衡固相为ZnO,因此,可通过提高浸出液pH值使锌以ZnO形式沉淀;在较低pH值时,体系中亦可形成ZnCO3固相而析出,但实际操作时发现,由于浸出液中存在 HIda--Ida2-、HCO3--CO32-形成缓冲溶液体系,少量酸的加入难以将pH值调至7以下,当用大量盐酸将pH值降至6时,浸出液中大量Ida2-固体与少量ZnCO3一同析出,沉淀难以分离,且 Cl-在体系中的积累影响原有浸出体系。因此,实验中采用高pH条件下的ZnO沉淀工艺。

图2 Zn2+-Ida2--CO32--H2O体系[Zn2+]T—pH曲线Fig.2 Variation of [Zn2+]T with pH in Zn2+-Ida2--CO32--H2O system
浸出液在一定温度的恒温水浴中用 CaO作沉淀剂调碱沉锌,固定磁力搅拌速度为400 r/min,将沉淀剂缓缓加入浸出液中,调节体系 pH至指定值,陈化反应一定时间后过滤,渣用去离子水洗涤,洗水与滤液合并计量。实验中考察了温度、pH值、陈化时间对沉锌效果的影响。该过程中的主要反应如下:
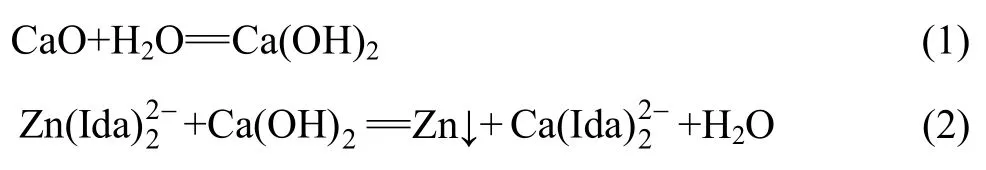
反应(1)中Ca(OH)2在水溶液中溶解度有限,其调节pH能力亦有限,用CaO作沉淀剂时不能呈现ZnO在高pH值体系中返溶的现象(ZnO在强碱性条件下可溶,碱浸工艺以此原理浸矿),因此,沉锌条件实验中用NaOH作沉淀剂考察不同pH值条件下的沉锌情况,并根据其沉锌效果确定最优沉锌pH。NaOH作沉淀剂调节体系 pH值沉锌时,现象比较明显,沉锌过程基本可分为3个阶段,具体操作如下:将分析纯NaOH固体缓缓加入到一定温度下的浸出液中,当体系中出现肉眼可见的沉淀时,记录此时pH值,即为ZnO沉淀的起始pH值;继续加入NaOH,待体系pH值不再变化时,记录此时pH,此为锌沉淀完全时pH值;最后,加入大量 NaOH,体系pH值将继续升高至一定值后基本保持不变,此时体系颜色变为紫褐色,且溶液中沉淀消失,记录此时pH,此为ZnO沉淀返溶时pH值。
1.3.3 沉钙实验
沉钙过程即浸出剂再生过程,一方面,需要脱除沉锌过程中积累的大量钙离子,恢复配体 Ida2-的活性;另一方面,需要将体系pH值调至最优浸出条件,便于再生后的浸出剂返回浸矿。沉锌后液在一定温度的恒温水浴中用CO2调节体系酸度沉钙,固定磁力搅拌速度300 r/min,控制一定的CO2气体流速,调节体系 pH至指定值后,固液分离,渣用去离子水洗涤,洗水与滤液合并计量。考察了温度、气体流速对沉钙效果的影响。过程中主要反应如下:

式(3)表明,在沉钙过程中,体系中Ca(Ida)22-可释放出大量游离Ida2-,待体系pH值降至浸出条件时,浸出剂得以再生。
1.4 分析方法
溶液体系中高浓度的锌用EDTA容量法分析,低浓度的锌与溶液中杂质用ICP-AES分析,固体样中元素含量采用X射线荧光分析(XRF)。
2 结果与讨论
2.1 浸出液制备
按1.3.1节中条件制备实验所需浸出液,处理矿物2 000 g,制得浸出液10.117 L。将浸出液充分混匀静置3 d后,取样分析,结果如表3所列。由表3可知,锌浸出率为76.71%,浸出液中锌含量仅为11.707 g/L。
2.2 沉锌实验
沉锌条件实验规模为200 mL浸出液/次,按1.3.2节中所述进行实验。

表3 浸出液中主要元素含量Table 3 Elemental composition of leaching liquor (mg·L-1)
2.2.1 温度、pH值对沉锌效果的影响
用NaOH作沉淀剂调节浸出液pH值沉锌,考察了不同温度下pH值对沉锌效果的影响,反应陈化30 min后趁热过滤,取滤液分析其中锌含量并计算锌的沉淀率。实验结果如图3所示。图3中各温度下曲线起点、峰值和终点为1.3.2节中所述的3个阶段,曲线上其他 pH值点为实验时考察方便任意截取。由图3可见,提高温度有利于沉锌,且随着温度的升高,沉锌pH值越低。根据吉布斯-亥姆霍兹方程可知,ZnO溶度积随温度升高而增大,温度升高将不利于ZnO沉淀。作者通过pH—电位法测定Zn2+-Ida2--H2O系配合物稳定常数后证实,配体 Ida22-加质子常数及Zn2+-Ida2-配合物稳定常数随温度升高而减小。一方面,由于配合物稳定常数随温度升高而减小,Ida22-与 Zn2+配合能力减弱,Zn2+-Ida22--CO32--H2O体系锌溶解度随温度升高而降低,则从锌浓度一定的浸出液中沉锌时,升温将有利于锌沉淀完全;另一方面,由于配体 Ida22-加质子常数随温度升高而减小,高温体系中 Ida22-与 Zn2+配合作用发生在较低的 pH值条件下,相当于图2中各平衡曲线在高温时整体向左平移,则高温体系沉锌时,ZnO沉淀在相对低的pH值条件下出现。为了尽可能地回收浸出液中的锌,选择沉锌温度为85 ℃,沉锌pH值为10。

图3 温度、pH值对沉锌效果的影响Fig.3 Effects of temperature and pH on precipitation of Zn from leaching liquor
2.2.2 陈化时间对沉锌效果的影响
固定沉锌温度为85 ℃、沉锌pH值为10,分别用固体NaOH和CaO调节浸出液pH值沉锌,考察陈化时间对沉锌效果的影响,结果如图4所示。由图4可见,NaOH沉锌时,陈化时间对其沉锌效果无明显影响,陈化时间从10 min延长至90 min,沉锌率维持在87%左右;用CaO调节浸出液pH值至10,并立即过滤,其沉锌率仅为21.32%,延长陈化时间其沉锌率显著提高,但陈化时间超过60 min后其沉锌率基本保持稳定,均在90%以上。由此可见,陈化反应时间达60 min后,CaO的沉锌效果明显优于NaOH的。取陈化60 min所得渣进行X射线衍射分析(见图5),对照标准图谱可知,锌沉淀产物均为ZnO,且CaO沉锌渣中有CaCO3物相。

图4 陈化时间对沉锌效果的影响Fig.4 Effect of aging time on precipitation of Zn from leaching liquor
由式(2)可知,CaO沉锌时OH-只能由Ca(OH)2提供,CaO与水完全反应需要一定时间,因而,CaO调碱沉锌效果与反应陈化时间有较大关系。实验过程中也探索了采用分析纯固体Ca(OH)2调节体系pH值以缩短陈化时间的方法,实验结果表明,分析纯Ca(OH)2固体的加入甚至不会造成体系 pH值的太大变化,达不到沉锌所需pH值范围,原因可能是分析纯Ca(OH)2固体的活性不如CaO与水反应新生成的Ca(OH)2。另外,由图4结果可知,当陈化时间足够时,CaO沉锌效果优于 NaOH沉锌,原因可能是新生成的高活性Ca(OH)2在溶解和析出过程中吸附了溶液中的部分锌,即CaO沉锌的效果得益于微溶性的活性Ca(OH)2的吸附作用,则所得粗氧化锌中必有Ca(OH)2残余。但XRD结果表明,CaO沉锌渣中钙物相为CaCO3,此结果有两方面原因,一方面是由于浸出液中 CO32-与Ca(OH)2反应生成CaCO3;另一方面是由于样品在烘干时,其中所含Ca(OH)2与空气中CO2反应所致。

图5 氧化锌渣XRD谱Fig.5 XRD patterns of crude ZnO: (a)Precipitated with CaO;(b)Precipitated with NaOH
NaOH沉锌时,Na+会在沉锌后液中积累,采用常规方法难以除钠;而采用CaO沉锌时,沉锌后液中积累的Ca2+可通过形成CaCO3沉淀除去,达到浸出剂再生的目的。综上所述,选择CaO为沉淀剂,并控制反应陈化时间为60 min。
按优化后的沉锌条件重复上述实验。取1 000 mL浸出液,在85 ℃时用CaO调节体系pH值为10,反应陈化 60 min后趁热过滤。渣经水洗烘干后称重为17.6 g,取样分析,结果如表4所列;沉锌后液中加去离子水补足1 000 mL混匀后取样分析,结果如表5所列,沉锌后液留待沉钙实验。
按表4和5分别计算沉锌率为85.51%(按渣计算)和90.07%(按溶液计算)。结合表3~5可知,沉锌后液中各元素含量(除Ca、Si外)均有不同程度的下降,这说明在沉锌过程中有价金属Pb、Cu、Ni、Cd可随锌一同沉淀于粗氧化锌中,其中 Pb在氧化锌渣中的富集最为明显,这对低品位氧化锌矿中有价金属的综合回收有积极意义。粗氧化锌中锌品位达 56.88%、铅4.42%。沉锌后液中大量的Ca由CaO沉锌时引入;Si在原浸出液中含量极低,但沉锌结束后却大量增加,唯一的解释只能是分析纯CaO中所含杂质Si随CaO的加入而形成硅酸盐进入溶液。
2.3 沉钙实验
沉钙条件实验规模为沉锌后液 100 mL/次,按1.3.3节中所述进行实验。
2.3.1 温度对沉钙效果的影响
将CO2气体以流速0.2 L/min通入一定温度的沉锌后液底部,待体系pH值降至指定值后,取出CO2气体导管、关闭气源,趁热过滤。考察了温度对沉钙效果的影响,实验结果如表6所列。由于经CO2沉钙后的溶液要用于再浸出矿物,因此,沉钙终点pH值应与浸出pH值一致(如1.3.1节所述,最优浸出温度70 ℃、pH值8),各温度下沉钙终点pH值由式(4)按浸出温度70 ℃、pH值8进行计算,即各温度下沉钙终点pH值均为固定值,以便沉钙后液升温至70 ℃用于再浸出矿物时,体系pH值仍保持在8。

表4 粗氧化锌中的主要元素含量Table 4 Elemental composition of crude ZnO (mass fraction, %)

表5 沉锌后液中的主要元素含量Table 5 Elemental composition of solution after Zn precipitation (mg·L-1)

表6 沉钙后液中主要元素含量Table 6 Elemental composition of solution after Ca precipitation

式中:Kw为相应温度下水的离子活度积常数。
结合表5和6可见,沉钙后液中Ca和Si含量明显下降,其他元素含量未见明显变化。Ca含量变化随温度升高而降低,原因是CaCO3的溶度积随温度升高而减小,导致其在高温水溶液中溶解度降低而更易析出,这说明提高温度有利于沉钙,70 ℃时,钙沉淀率为93.33%;随体系pH值降低,沉锌过程中引入的硅酸盐将以SiO2沉淀与CaCO3一同析出。
实验操作中发现,低温时沉钙反应较慢。25 ℃时甚至不能出现沉淀,反应完成后再继续搅拌1 h才会逐渐形成少量沉淀(溶液变浑浊);40 ℃、55 ℃沉钙时,烧杯壁上有CaCO3结垢,水洗难以除去,原因是低温不利于CaCO3晶核长大,因而部分CaCO3附着于粗糙的容器壁上形成结垢;70 ℃沉钙时,CaCO3颗粒碰撞几率增大,晶核易于长大,反应迅速,容器壁上无结垢,且溶液中过量的CO2气体可在此温度下驱除,以免影响再生后的浸出剂浸矿效果。
综上所述,选择沉钙温度为70 ℃,沉钙终点pH值为8。
2.3.2 气体流速对沉钙效果的影响
固定沉钙温度70 ℃、沉钙终点pH值8,考察了CO2气体流速对沉钙效果的影响,结果见图6。由图6可见,气体流速对沉钙效果的影响不大,增加CO2流速时,钙沉淀率略微下降,可能因为CO2流速过大时,CO2在溶液中停留时间过短,尚未与溶液中 Ca2+完全接触即溢出排空。此处,选择 CO2气体流速为 0.2 L/min为宜。

图6 气体流速对沉钙效果的影响Fig.6 Effect of gas flow rate on precipitation of Ca
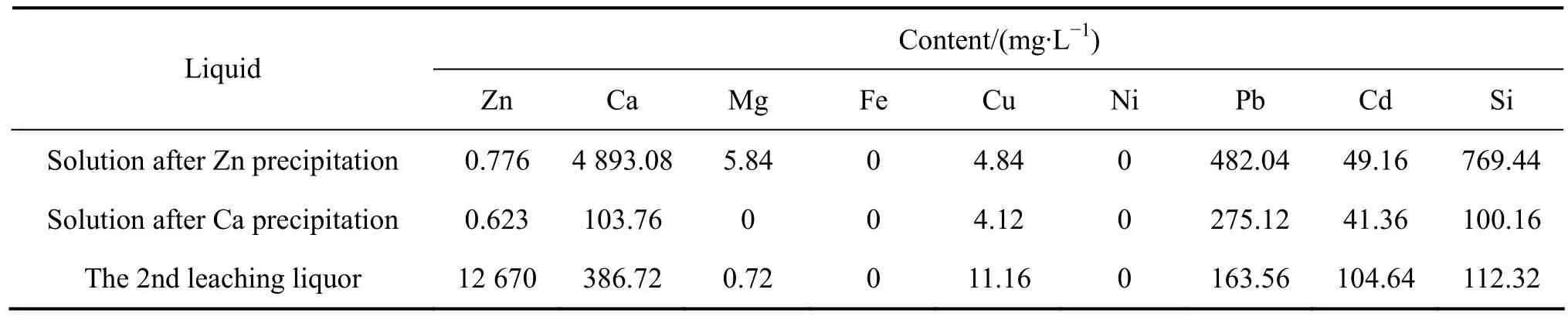
表7 液相中相关元素含量Table 7 Elemental composition of liquid phase

表8 固相中相关元素含量Table 8 Elemental composition of solid phase
2.4 再生浸出剂浸矿
取1 000 mL浸出液按“沉锌—沉钙—再浸出”重复上述实验,考察再生后的浸出剂浸矿效果。固液分离后所得液相(沉锌后液、沉钙后液、二次浸出液)取25 mL用于分析,并取25 mL同类型溶液(2.2、2.3、2.1节中所得沉锌后液、沉钙后液以及浸出液)补足体积,所得结果均换算成1 000 mL体积含量,结果列于表7。所得粗氧化锌渣及碳酸钙渣(浸出渣未作分析)烘干后分析其中元素含量,结果列于表8。
表7中主金属元素Zn含量经沉钙后有所下降,这与条件实验结果不同,其原因可能是由于实验规模不同,导致沉淀的碳酸钙量不同,此处,大量的碳酸钙在沉降过程中可能吸附部分Zn而使溶液中Zn含量降低。表8中数据显示,粗氧化锌中有明显Ca残留,这也是此工艺所无法避免的,建议将粗氧化锌送火法炼锌以回收其中有价金属Zn、Pb等,粗氧化锌中Ca可作碱性造渣用;碳酸钙渣中有少量的Na、S,其中Na可能是从溶液中吸附而来;而S含量明显高于粗氧化锌中的含量,可能是CO2气体中所含杂质的结果,因为工业上CO2由石灰石煅烧所制得,所制得气体中含少量S。所得碳酸钙可直接煅烧制得沉锌用CaO,过程中产生的CO2可用于从沉锌后液中沉钙。
表7、8中数据与条件实验结果基本吻合,按表中数据计算其沉锌率为 93.37%(以液体计),沉钙率为97.88%,锌浸出率为78%,所得粗氧化锌含锌56.91%、铅3.40%,碳酸钙纯度大于97%。
3 结论
1)浸出液中有价金属Cu、Ni、Pb、Cd可在沉锌过程加以回收;温度、沉锌终点 pH值、反应陈化时间对 CaO沉锌效果均有较大影响,在最优沉锌条件下,锌沉淀率为90.07%,所得粗氧化锌含锌56.88%、铅4.42%。
2)温度对CO2沉钙效果有较大影响,在最优沉钙条件下,钙沉淀率为93.4%。
3)再生浸出剂浸矿效果良好,锌浸出率为78%。
[1]JHA M K, KUMAR V, SINGH R J.Review of hydrometallurgical recovery of zinc from industrial wastes[J].Resources, Conservation and Recycling, 2001, 33(1): 1-22.
[2]SOUZA A D, PINA P S, SANTOS F M F, DA SILVA C A,LEÃO V A.Effect of iron in zinc silicate concentrate on leaching with sulphuric acid[J].Hydrometallurgy, 2009, 95(3/4):207-214.
[3]QIN Wen-qing, LI Wei-zhong, LAN Zhuo-yue.Simulated small-scale pilot plant heap leaching of low-grade oxide zinc ore with integrated selective extraction of zinc[J].Minerals Engineering, 2007, 20(7): 694-700.
[4]JU Shao-hua, TANG Mo-tang, YANG Sheng-hai.Dissolution kinetics of smithsonite ore in ammonium chloride solution[J].Hydrometallurgy, 2005, 80(1/2): 67-74.
[5]王瑞祥.MACA 体系中处理低品位氧化锌矿制取电锌的理论与工艺研究[D].长沙: 中南大学, 2009: 87-91.WANG Rui-xiang.Study on theory and technology for treating low-grade zinc oxide to prepare cathode zinc in the MACA system[D].Changsha: Central South University, 2009: 87-91.
[6]YUAN Tie-chui, CAO Qin-yuan, LI Jie.Effects of mechanical activation on physicochemical properties and alkaline leaching of hemimorphite[J].Hydrometallurgy, 2010, 104(2): 136-141.
[7]ZHAO Y C, ROBERT S.Production of Zn powder by alkaline treatment of Smithsonite Zn-Pb ores[J].Hydrometallurgy, 2000,56(2): 237-249.
[8]FENG Lin-yong, YANG Xian-wan, SHEN Qing-feng.Pelletizing an alkaline leaching powdery low grade zinc oxide ores[J].Hydrometallurgy, 2007, 89(3/4): 305-310.
[9]唐谟堂, 张家靓, 王 博, 扬声海, 何 静, 唐朝波, 杨建广.低品位氧化锌矿在MACA体系中的循环浸出[J].中国有色金属学报, 2011, 21(1): 214-219.TANG Mo-tang, ZHANG Jia-liang, WANG Bo, YANG Sheng-hai, HE Jing, TANG Chao-bo, YANG Jian-guang.Cycle leaching of low grade zinc oxide ores in MACA system[J].The Chinese Journal of Nonferrous Metals, 2011, 21(1): 214-219.
[10]AMER S, FIGUEIREDO J M, LUIS A.The recovery of zinc from leach liquors of the CENIM-LNETI process by solvent extraction with di(2-ethylhexyl) phosphoric acid[J].Hydrometallurgy, 1995, 37(3): 323-337.
[11]ALGUACIL F J, ALONSO M.Effect of ammonium sulphate and ammonia on the liquid-liquid extraction of zinc using LIX54[J].Hydrometallurgy, 1999, 53(2): 203-209.
[12]ALGUACIL F, MARTINEZ S.Solvent extraction equilibrium of zinc(Ⅱ)from ammonium chloride medium by CYANEX923 in Solvesso 100[J].Journal of Chemical Engineering of Japan,2001, 34(11): 1439-1442.
[13]AMER S, LUIS A.Extraction of zinc and other minor metals from concentrated ammonium chloride solutions with D2EHPA and Cyanex272[J].Revista de Metalurgia (Madrid), 1995, 31(6):351-372.(in French)
[14]DEEP A, DE CARVALHO J.Review on the recent developments in the solvent extraction of zinc[J].Solvent Extraction and Ion Exchange, 2008, 26(4): 375-404.
[15]王成彦, 江培海.云南中低品位氧化锌矿及元江镍矿的合理开发利用[J].中国工程科学, 2005, 7(增刊): 147-150.WANG Cheng-yan, JIANG Pei-hai.The rational exploitation of middle & low grade zinc oxide ore and Yuanjiang nickel oxide ore in Yunnan[J].Engineering Science, 2005, 7(Supple):147-150.
[16]彭清静, 段友构, 杨朝霞.氨浸-碳化法制备活性氧化锌[J].化工生产与技术, 2001, 8(6): 15-17.PENG Qing-jing, DUAN You-gou, YANG Zhao-xia.Preparation of active zinc oxide by ammonia leaching-carbonizing[J].Chemical Production and Technology,2001, 8(6): 15-17.
[17]蒋崇文, 罗 艺, 钟 宏.低品位氧化锌矿氨-碳酸氢铵浸出制备氧化锌工艺的研究[J].精细化工中间体, 2010, 40(3):53-56.JIANG Chong-wen, LUO Yi, ZHONG Hong.Study on leaching low-grade zinc oxide ore in the system of NH3-NH4HCO3-H2O for preparing zinc oxide[J].Fine Chemical Intermediates, 2010,40(3): 53-56.
[18]龙 双.氧化锌矿物碱法提取新工艺[D].长沙: 中南大学,2010: 31-40.LONG Shuang.Technology of Zn extraction from zinc oxide ores by alkaline leaching[D].Changsha: Central South University, 2010: 31-40.
