粒径对CaF2沉淀-溶解平衡的影响
2011-12-14周康根李程文
姜 科,周康根,李程文
(中南大学 冶金科学与工程学院,长沙 410083)
氟化工、铝电解、玻璃制造等行业排放出的大量含氟废水,对动植物、土壤和人体都会造成严重的危害[1]。目前,含氟废水的主要处理方法有化学沉淀法、絮凝沉淀法和吸附法等[2-3],其中,化学沉淀法因具有工艺简单、操作简便及成本低廉等优点,生产实践中得到了广泛的应用[4-5],但该方法仍存在石灰利用率低、出水氟浓度不稳定以及污泥沉降性差等问题。因此,化学沉淀法往往需要与絮凝沉淀工艺组合使用[6-8]。
与此同时,部分研究者从化学平衡的角度对CaF2沉淀脱氟的机理和条件进行了探讨[9-13],得出溶液中的钙离子浓度、氟离子浓度、pH和离子强度等因素是影响沉淀效果的重要因素,但这些研究忽略了 CaF2污泥自身性质的影响。根据CaF2的溶解度(25 ℃时氟化钙的溶解度18.1 mg/L)计算可得[14],使用化学沉淀法处理含氟废水,理论上出水氟浓度最低为8.8 mg/L,低于《污水综合排放标准》中规定的10mg/L的限值。然而在实际生产过程中,出水氟浓度往往达到 20~30 mg/L,与理论值相去甚远。
本文作者在氟化钙砂状化实验中发现[15],化学沉淀法的处理效果与沉淀物的颗粒大小有关,沉淀颗粒越大,出水越澄清,总氟浓度越低。为了深入探讨这一问题,作者采用CaF2溶解法对Ca2+-F--H+-H2O体系中 CaF2的沉淀-溶解过程进行了研究,考察了 CaF2粒径和pH等因素对CaF2的沉淀溶解平衡的影响,并全面考虑体系中可能存在的各种形态的Ca和F化合物,通过热力学计算对平衡实验结果进行了分析,得到了控制CaF2沉淀过程中总氟浓度的热力学条件。
1 实验
1.1 CaF2溶解实验
称取5 g CaF2加入250 mL塑料杯中,加入200 mL去离子水,加入不同量的 CaCl2或 NaCl,使用 HCl和 NaOH溶液调节 pH,塞紧瓶塞于恒温空气摇床中震荡10 h至平衡,取水样离心后分析上清液总钙浓度c(Ca)[16]、总氟浓度c(F)[17],取 CaF2污泥并进行电镜观察。
实验过程中采用了不同粒径的CaF2颗粒,其SEM像如图1所示。其中,样品b为未加工的市售分析纯CaF2粉体,将其筛分后分别得到细颗粒CaF2(样品 a)和粗颗粒CaF2(样品c),样品d为以样品c颗粒为晶种进行沉淀结晶得到的 CaF2粗颗粒,可见,CaF2颗粒粒径由小至大顺序为样品a、b、c、d。
1.2 热力学分析
在Ca2+-F--H+-H2O体系中,可能存在的Ca、F溶解态化合物形态包括CaF+、HF、F-、H2F+、CaOH+、CaCl+和 Ca2+,这些物质之间的电离平衡关系如表1所示。
假设体系中游离的钙离子浓度、氟离子浓度分别为ρ(Ca2+)、ρ(F-),总钙浓度、总氟浓度分别为ρ(Ca)、ρ(F),由表1中式(1)~(7)的平衡关系可得:


图1 实验中所用不同粒径的CaF2颗粒的SEM像Fig.1 SEM images of CaF2 particles with different sizes in experiment: (a)Sample a; (b)Sample b; (c)Sample c; (d)Sample d
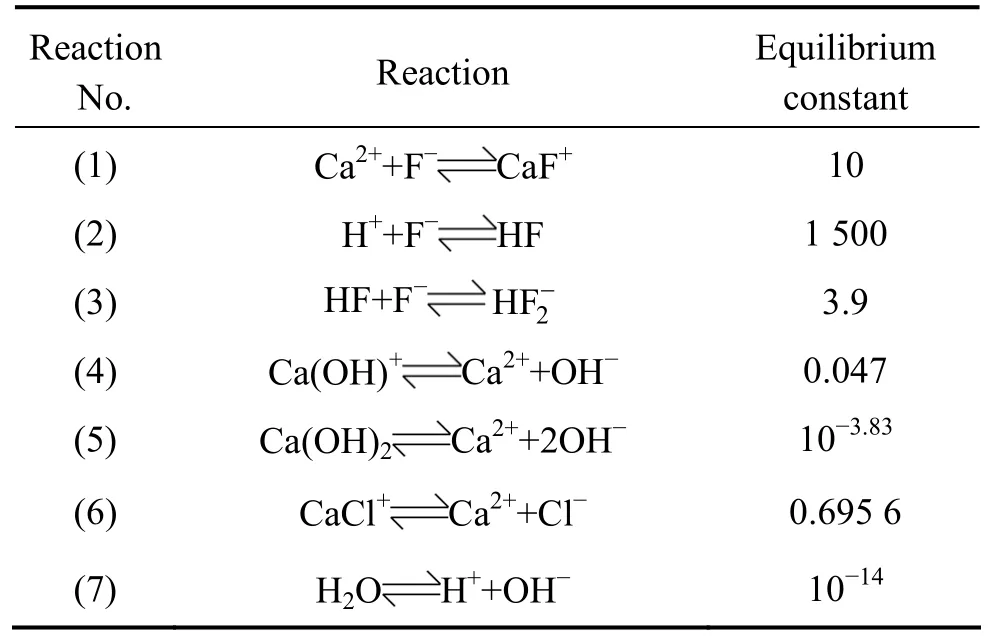
表1 25 ℃时 Ca2+-F--H+-H2O体系中的热力学平衡数据[18-19]Table 1 Thermodynamic data in Ca2+-F--H+-H2O system at 25 ℃[18-19]
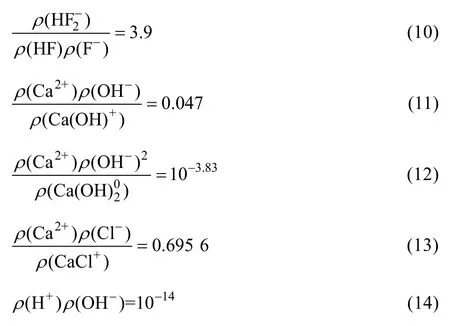
根据元素守恒可得:
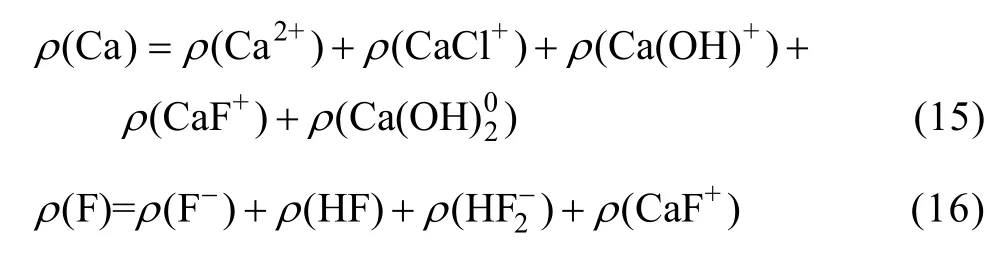
根据电荷守恒可得:
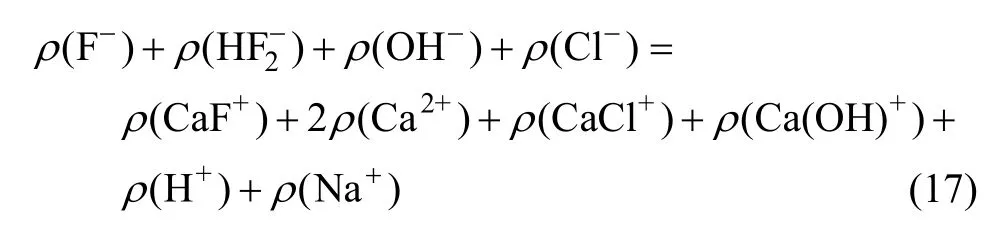
假定溶液中各组分的热力学参数为:电荷数(Zi)、总离子强度(Ⅰ,mol/L)、活度因子(γi),根据式(16)和Davies公式(17)可以确定这些参数之间的关系:
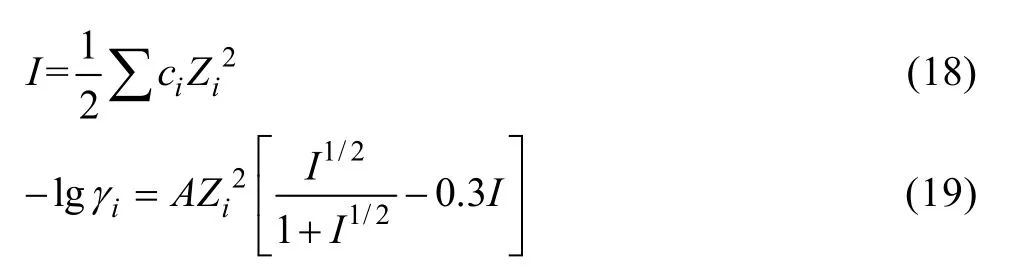
式中:ci为溶液中i组分的浓度;A表示DeBye-Hückel常数, 在25 ℃的条件下,A=0.509。
溶液中i组分物质的浓度分布系数αi定义为i组分浓度ci与总浓度之比,如
含F物质的分布系数为

含Ca物质分布系数为

CaF2的活度积常数KAP定义为
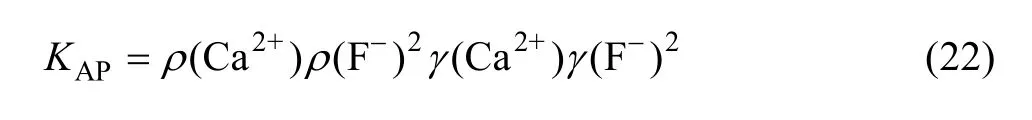
2 结果与讨论
2.1 pH对CaF2溶解-平衡的影响
实验中采用样品b中CaF2颗粒,不投加CaCl2,调节并测定平衡pH分别至3.27、4.09、5.38、6.89、8.09、9.24、9.85、11.38、12.00、12.56。图2 所示为平衡总氟、总钙浓度随pH的变化。从图2可以看出,当pH<10时,平衡总氟浓度基本维持在10~20 mg/L之间,尤其当pH在4.09~6.89之间时,总氟浓度均低于11 mg/L,CaF2沉淀反应进行得较为充分;随着pH的继续增大,平衡总氟浓度迅速增大,而平衡总钙浓度则始终呈下降趋势。
卓别林长着一般人的样貌,像一般人一样有些怪习惯,但他对电影事业的专注与努力却异于常人,非凡的成就往往需要这样的“不一般”,不是吗?
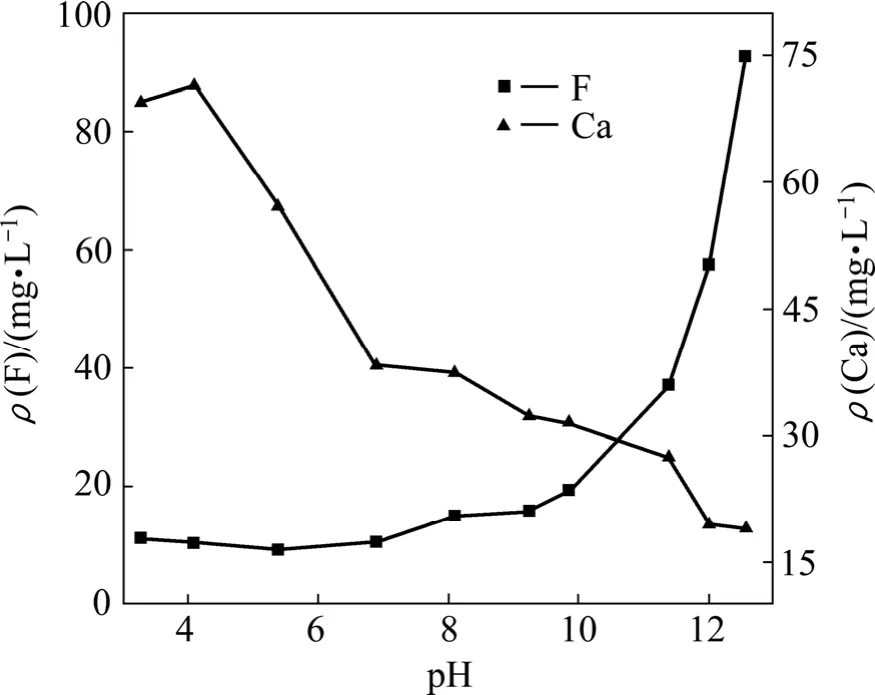
图2 pH值对CaF2沉淀-溶解平衡时溶液中总氟及总钙浓度的影响Fig.2 Effects of pH on total fluorine concentration and total calcium concentration of CaF2 at equilibrium with aqueous phase
根据图2中的ρ(Ca)和ρ(F)的实验数据,结合式(8)~(16)和式(20)~(21)计算得出体系中 F和 Ca形态物质的分布系数随pH的变化关系曲线,如图3和4所示。根据图3、4和反应式:
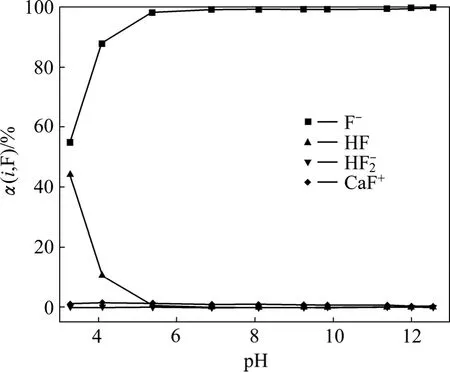
图3 CaF2沉淀-溶解平衡时液相中F的存在形态随pH值的变化Fig.3 Dependence of distribution of F containing ions with pH value in aqueous phase equilibrated with CaF2

当pH在4.0~10.0之间时,氟离子和钙离子分别为最主要的氟形态和钙形态物质,利于相互结合生成CaF2沉淀,平衡总氟浓度较低;当pH>10时,随着Ca(OH)+和Ca(OH)含量的增加,溶液中钙离子在总钙中的比例下降,加上总钙浓度的降低,导致游离的钙离子浓度下降,不利于CaF2沉淀的产生和氟离子的去除。可见,CaF2沉淀过程中的pH直接影响了溶液中的氟、钙化合物的形态,造成了平衡总氟浓度的变化。
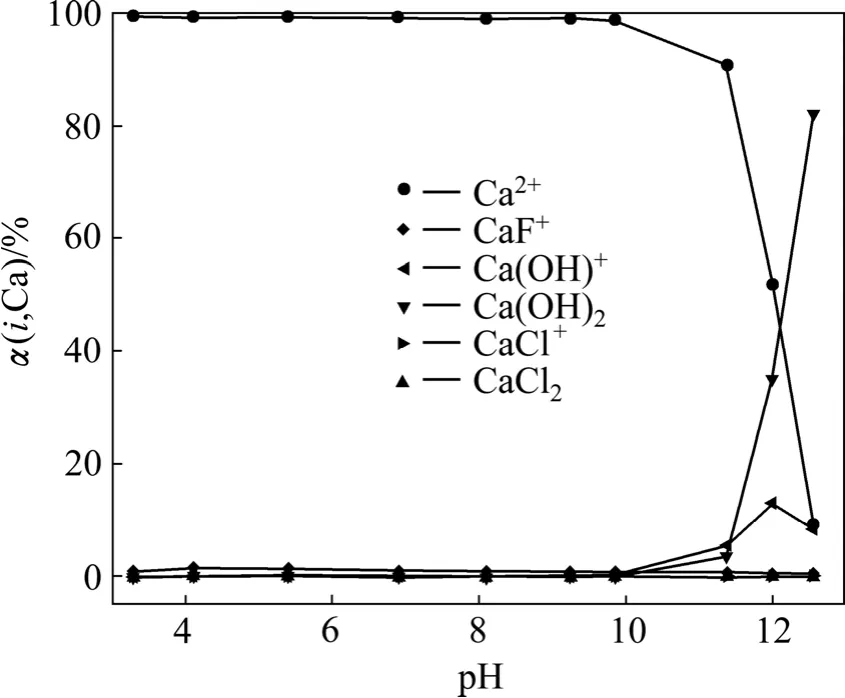
图4 CaF2沉淀-溶解平衡时液相中Ca的存在形态随pH值的变化Fig.4 Dependence of distribution of Ca containing ions with pH value in aqueous phase equilibrated with CaF2
2.2 CaF2颗粒大小对其溶解-平衡的影响
实验中分别采用样品a、b、c、d中CaF2颗粒,平衡 pH=5,CaCl2加入量分别为 0、0.5、1.0、2.5、3.5、5.0和10.0 g/L。对平衡反应结束后所得的CaF2沉淀进行电镜观察,如图5所示。图6和7所示为平衡总氟浓度和总钙浓度随CaCl2加入量的变化关系。
从图5可以看出,与溶解实验前相比,实验后的CaF2颗粒形貌变化不大,CaF2颗粒粒径从小到大的顺序为样品a、b、c、d。从图6可以看出,在CaCl2加入量相同的情况下,随着CaF2颗粒粒径的减小,溶液中的平衡总氟浓度均呈现增大的趋势。

图5 溶解实验后得到的CaF2沉淀颗粒Fig.5 CaF2 particles obtained in dissolution experiment: (a)Sample a; (b)Sample b; (c)Sample c; (d)Sample d
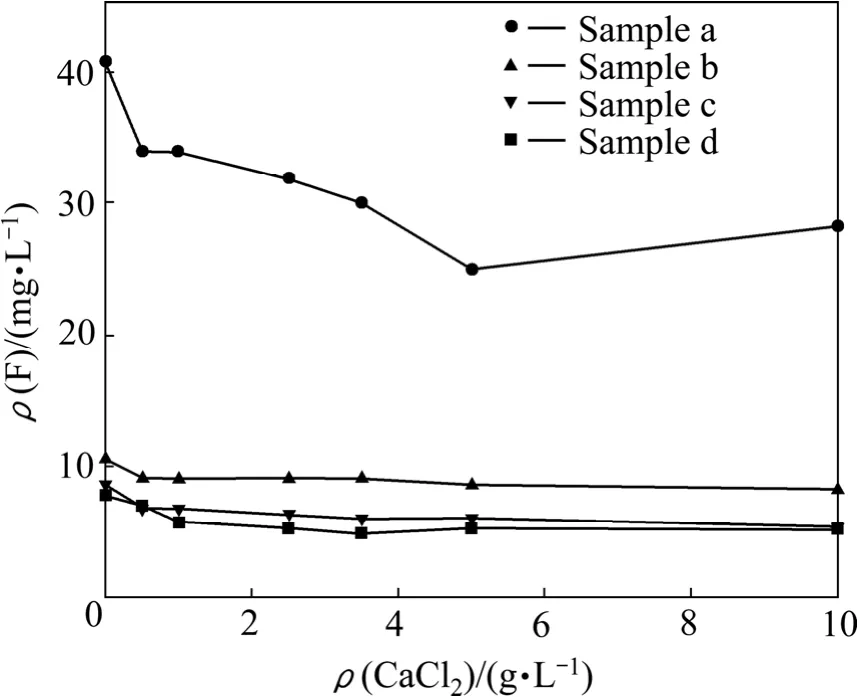
图6 平衡总氟浓度随CaCl2加入量的变化Fig.6 Change of total equilibrium concentration of F with CaCl2 adding amount
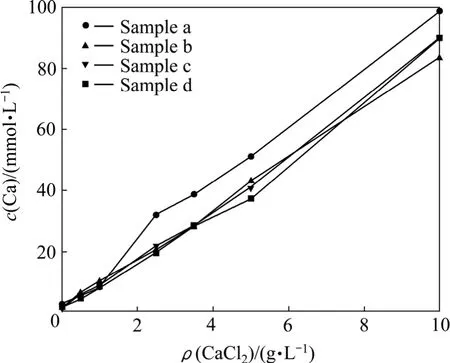
图7 平衡总钙浓度随CaCl2加入量的变化Fig.7 Change of total equilibrium concentration of F with CaCl2 adding amount
为了探究产生这一现象的原因,根据图6和7中的ρ(Ca)和ρ(F)数据,结合式(8)~(19)和式(22)计算得出了CaF2活度积常数KAP随CaCl2加入量的变化关系,如图8所示。从图8可以看出,CaF2颗粒粒径对其活度积常数有重要影响,对于样品a而言,因其基本由细小颗粒组成,溶液中平衡总氟浓度高于25 mg/L,而样品d在溶液中的平衡总氟浓度低于8 mg/L。可见,在同样的热力学平衡条件下,颗粒粒径越小,活度积常数越大,平衡总氟浓度越高。
根据 Ostwald-freundlich公式[20],固体物质的溶解度S与其粒径r之间存在如下关系:
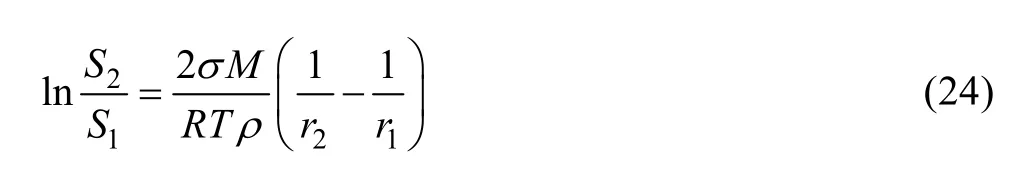
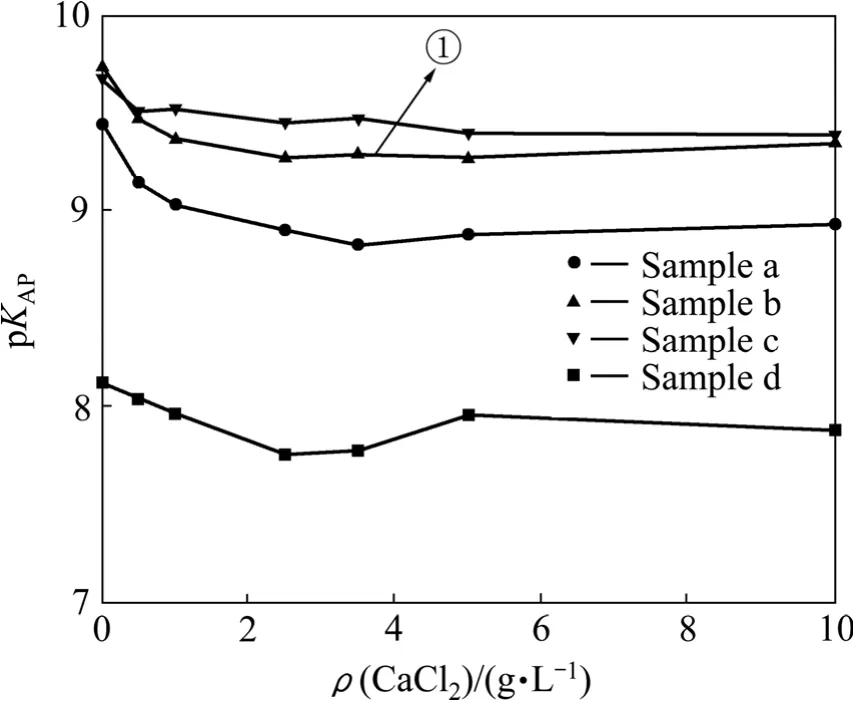
图8 KAP随CaCl2加入量的变化Fig.8 Change of KAP with CaCl2 adding amount
式中:M为物质的相对摩尔质量;ρ为颗粒密度;σ为界面张力;T为温度;R为摩尔气体常数。
根据[14]可知,CaF2的溶解度S与其活度积KAP的关系为
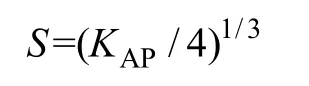
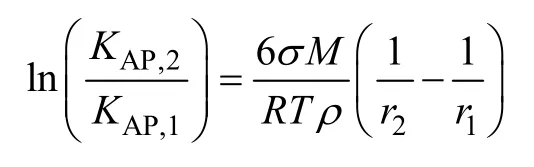
或
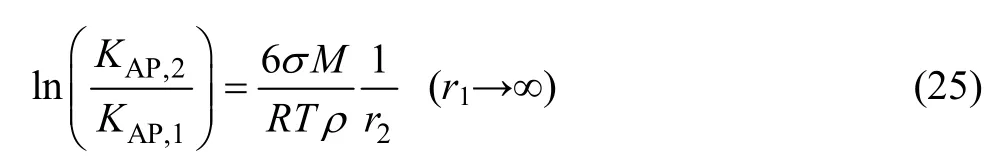
取 CaF2界面张力[21]σ=2.5 J/m2,r1→∞时的活度积常数[18]KAP,1=10-10.31,ρ=3.18×103kg/m3,T=298.15 K,根据式(25)可计算得出理论上CaF2活度积与粒径关系曲线。另外,通过测量图5中样品b、c和d中CaF2颗粒定方向粒径(其中样品a含有很多小颗粒,难以测量),结合图8中的活度积常数,根据(25)式拟合得到实验中CaF2活度积与粒径关系曲线,如表2和图9所示。
从图9可以看出,根据Ostwald-freundlich公式拟合出的曲线与实验测得的样品b、c、d的ln(KAP,2/KAP,1)与r2的关系十分吻合,CaF2的颗粒越小,其活度积常数越大,溶解度越大。从拟合曲线来看,CaF2粒径在1~100 μm之间时,其活度积常数随粒径的变化会发生显著变化,当粒径大于100 μm后,粒径的影响逐渐减弱。从理论曲线来看,当CaF2粒径在0.01~0.5 μm之间时,其理论活度积常数才有显著变化,与实验结果相差较大。这可能是由于CaF2的颗粒形貌的不规则性以及粒径的不均匀性造成的[22-23],颗粒中包含的一些细小粒子和不规则的表面会致使其溶解度变大,因此,Ostwald-freundlich公式不适于定量预测不规则CaF2颗粒的活度积常数,但可作为定性判断的依据。

表2 实验中CaF2活度积常数与粒径的关系Table 2 Relationship between KAP and particle size of CaF2 in experiment
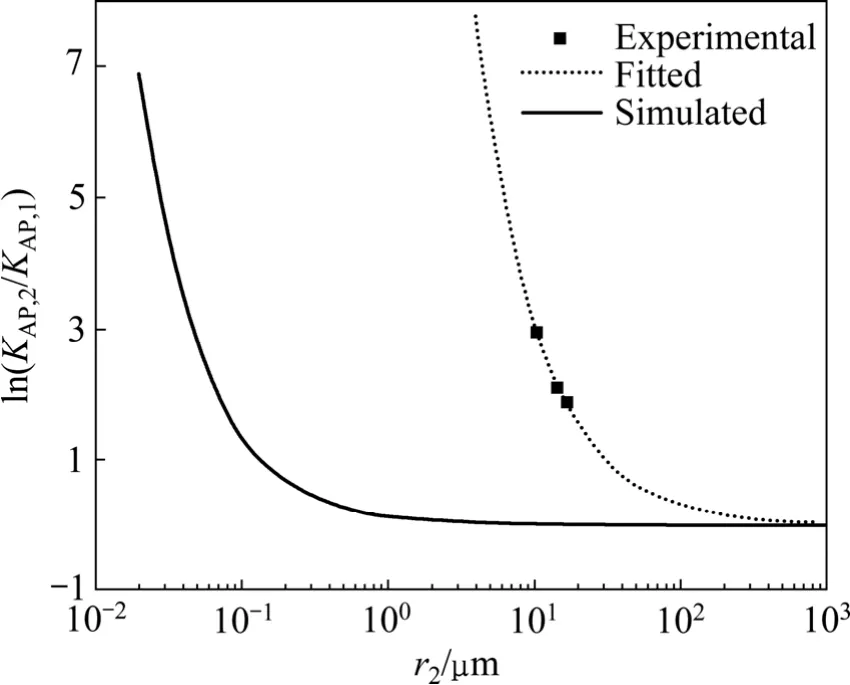
图9 CaF2颗粒活度积常数随颗粒粒径的变化Fig.9 Activity product as function of particle size of CaF2
上述结果说明,不同粒径的颗粒在同样的平衡条件下,具有不同的溶解度和平衡浓度。在以往的化学沉淀法脱氟的过程中,生成的CaF2颗粒粒径越小,沉淀脱氟效果越差,出水总氟浓度越高,这也是实际过程中出水氟浓度难以达标的原因之一。因此,寻求有效增大沉淀粒径的方法,是解决化学沉淀法脱氟效果不佳的重要途径。
从图6还可以看出,对于同种粒径的CaF2,适当增加沉淀剂用量可以降低平衡总氟浓度,但沉淀脱氟存在一定的限度,当CaCl2加入量达到1.5 g/L时,总氟浓度几乎不再变化。
根据图6和7中样品c的平衡实验数据,结合式(8)~(16)和式(20)~(21)计算得出图8中线①所对应的Ca2+、F-在总钙、总氟中所占的浓度分数随CaCl2加入量的变化,如图10和11所示。从图中可以看出,随着CaCl2用量的增加,溶液中的部分Ca2+分别与F-、Cl-和OH-结合,转化为CaCl+、CaF+和Ca(OH)+,大大降低了游离F-和Ca2+在总氟、总钙中所占的比例,使其不能有效结合产生 CaF2沉淀,因此在沉淀过程中,单纯增加沉淀剂的用量只能在一定范围内降低出水总氟浓度。
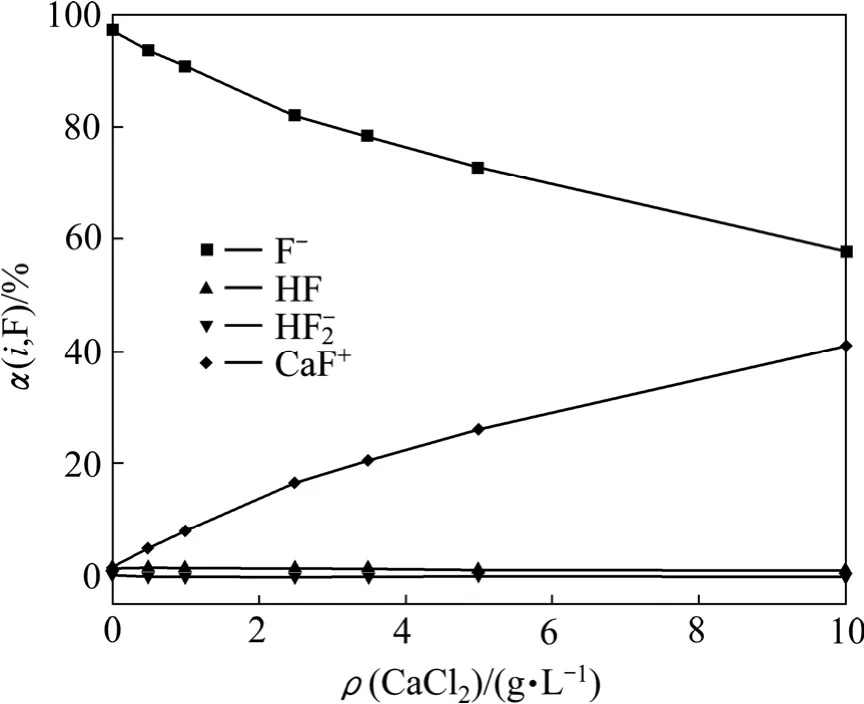
图10 F的存在形态随CaCl2加入量的变化Fig.10 Change of distribution of F-containing ions with CaCl2 adding amount
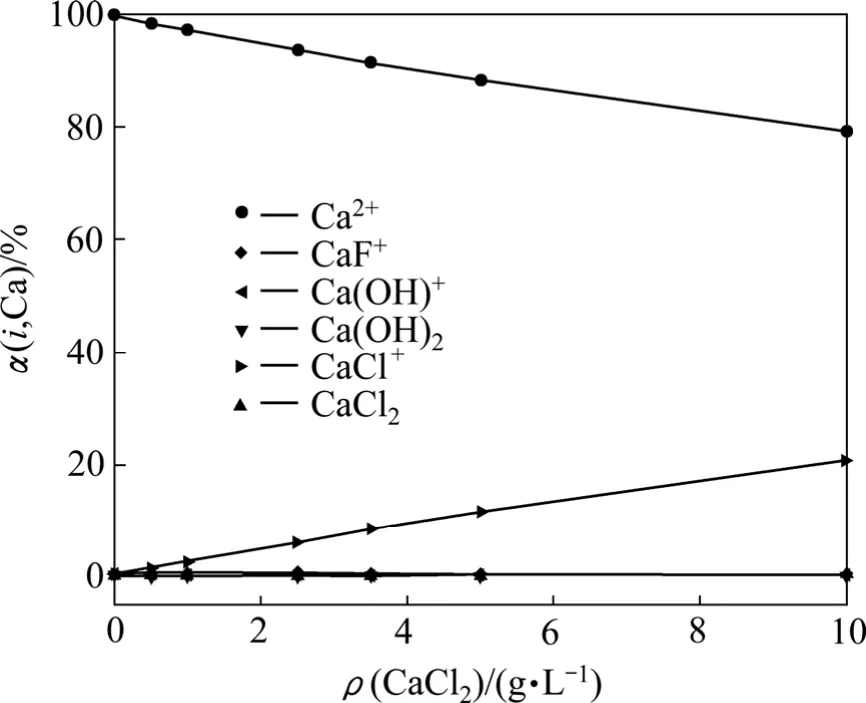
图11 Ca的存在形态随CaCl2加入量的变化Fig.11 Change of distribution of F-containing ions with CaCl2 adding amount
3 结论
1)CaF2沉淀过程中pH的变化可以导致F、Ca的存在形态及平衡总氟浓度的变化。当 pH在 4.0~10.0之间时,平衡总氟浓度较低;pH>9.85时,平衡总氟浓度迅速升高;pH>3.27时,氟离子在总氟中的比例骤降,不利于CaF2沉淀的产生。
2)CaF2粒径对其沉淀溶解平衡有显著影响,颗粒粒径越大,活度积常数越小,溶解度越小,平衡总氟浓度越低。CaF2颗粒粒径较小时,平衡总氟浓度高于25 mg/L;粒径大于16.97 μm时,平衡总氟浓度低于8 mg/L;粒径大于100 μm后,溶解度随粒径的变化很小。化学沉淀脱氟过程中,增大CaF2沉淀的粒径是强化沉淀效果的有效途径。
3)适当增加沉淀剂(钙盐)的用量可以提高氟的去除效率,但在沉淀剂过量较多时会生成 CaCl+、CaF+和Ca(OH)+等配合物,不能进一步降低出水氟浓度。
[1]郑宝山.地方性氟中毒及工业氟污染研究[M].北京: 中国环境科学出版社, 1992.ZHENG Bao-shan.Study of endemic fluorosis and industrial fluorine pollution[J].Beijing: China Environmental Science Press, 1992.
[2]MOHAPATRA M, ANAND S, MISHRA B K, GILES D E,SINGH P.Review of fluoride removal from drinking water[J].Journal of Environmental Management, 2009, 91(1): 67-77.
[3]张超杰, 周 琪.含氟水治理研究进展[J].给水排水, 2002,28(12): 26-29.ZHANG Chao-jie, ZHOU Qi.Advances in F-bearing water treatment[J].Water and Waste Water Engineering, 2002, 28(12):26-29.
[4]张希祥, 王 煤, 段德智.氧化钙粉末处理高浓度含氟废水的实验研究[J].四川大学学报: 工程科学版, 2001, 33(6):111-113.ZHANG Xi-xiang, WANG Mei, DUAN De-zhi.Treatment of wastewater containing high concentration fluorine with lime power[J].Journal of Sichuan University: Engineering Science Edition, 2001, 33(6): 111-113.
[5]戴荣海.集成电路产业含氟废水处理工程[J].环境工程, 2007,25(1): 29-30.DAI Rong-hai.Fluoride wastewater treatment project in integrated circuit industry[J].Environmental Engineering, 2007,25(1): 29-30.
[6]吴 静, 陆正禹.高氟废水的组合处理工艺[J].中国给水排水, 2003, 19(13): 3-4.WU Jing, LU Zheng-yu.Combined treatment process for high fluoride content wastewater[J].China Water and Wastewater,2003, 19(13): 3-4.
[7]方俊华, 刘石虎, 周 健.两级中和沉淀-混凝工艺处理高浓度含氟废水试验研究[J].给水排水, 2006, 32(10): 62-64.FANG Jun-hua, LIU Shi-hu, ZHOU Jian.Experimental research on fluoride wastewater treatment by two-stage neutralization and sedimentation-Flocculation process[J].Water and Wastewater Engineering, 2006, 32(10): 62-64.
[8]刘海波, 左文武, 林文周, 娄金生.化学-混凝沉淀法处理低浓度含氟废水研究[J].中国给水排水, 2008, 24(11): 76-79.LIU Hai-bo, ZUO Wen-wu, LIN Wen-zhou, LOU Jin-sheng.Treatment of low-concentration fluoride wastewater by chemical/coagulation and sedimentation process[J].China Water and Wastewater, 2008, 24(11): 76-79.
[9]郭瑞光, 徐传宁.含氟废水中 CaF2形成的动力学研究[J].环境与开发, 1994, 9(4): 337-340.GUO Rui-guang, XU Chuan-ning.Formation kinetics of CaF2in fluoride wasterwater[J].Environment and Exploitation, 1994,9(4): 337-340.
[10]李雪玲, 刘俊峰, 李培元.石灰沉淀法除氟的应用[J].水处理技术, 2000, 26(6): 359-364.LI Xue-ling, LIU Jun-feng, LI Pei-yuan.Principle and application of fluoride removal by lime sedimentation method[J].Technology of Water Treatment, 2000, 26(6): 359-364.
[11]PARTHASARATHY N, BUFFLE J, HAERDI W.Combined use of calcium salts and polymeric aluminium hydroxide for defluoridation of waste Waters[J].Water Research, 1986, 20(4):443-448.
[12]PAN H B, DARVELL B W.Solubility of calcium fluoride and fluorapatite by solid titration[J].Archives of Oral Biology, 2007,52(9): 861-868.
[13]GARAND A, MUCCI A.The solubility of fluorite as a function of ionic strength and solution composition at 25 ℃ and 1 atm total pressure[J].Marine Chemistry, 2004, 91(1/4): 27-35.
[14]SNOEYINK V L, JENKINS D.Water chemistry[M].New York:John Wiley and Sons, 1980.
[15]姜 科.晶种法处理高浓度含氟废水研究[D].长沙: 中南大学, 2010: 39-45.JIANG Ke.Treatment of concentrated fluoride-containing wastewater by seeding method[D].Changsha: Central South University, 2010: 39-45.
[16]GB 7484—87.离子选择电极法[S].北京: 中华人民共和国环保部, 1987.GB 7484—87.Ion selective electrode method[S].Beijing:Ministry of Environmental Protection of the People’s Republic of China, 1987.
[17]国家环境保护总局.水和废水监测分析方法[M].四版.北京:中国环境科学出版社, 2002.State of Environmental Protection Administration of China.Standard methods for water and wastewater monitoring and analysis[M].4th ed.Beijing: China Environmental Science Press,2002.
[18]TAI C Y, CHEN P C, TSAO T M.Growth kinetics of CaF2in a pH-stat fluidized-bed crystallizer[J].Journal of Crystal Growth,2006, 290(2): 576-584.
[19]PERRIN D D.Dissociation constants of inorganic acids and bases in aqueous solution[J].Pure and Applied Chemistry, 1969,20: 132-236.
[20]KOLTHOFF I M.“Theory of coprecipitation.” The formation and properties of crystalline precipitates[J].The Journal of Physical Chemistry, 1932, 36(3): 860-881.
[21]SÖHNEL O, MULLIN J W.Precipitation of calcium carbonate[J].Journal of Crystal Growth, 1982, 60(2): 239-250.
[22]WU W J, NANCOLLAS G H.A new understanding of the relationship between solubility and particle size[J].Journal of Solution Chemistry, 1998, 27(6): 521-530.
[23]MIHRANYANA A, STRØMME M.Solubility of fractal nanoparticles[J].Surface Science, 2007, 601(2): 315-319.
