钛酸钡纳米颗粒聚集球的形成机理
2011-12-11展红全江向平李小红罗志云李月明
展红全 江向平 李小红 罗志云 陈 超 李月明
(景德镇陶瓷学院材料科学与工程学院,江西省先进陶瓷材料重点实验室,江西景德镇333403)
钛酸钡纳米颗粒聚集球的形成机理
展红全 江向平*李小红 罗志云 陈 超 李月明
(景德镇陶瓷学院材料科学与工程学院,江西省先进陶瓷材料重点实验室,江西景德镇333403)
采用水热法合成了具有新颖结构的钛酸钡纳米颗粒聚集球.X射线衍射(XRD)结果显示该聚集球为立方相,随着时间的延长其结晶性增强.利用扫描电子显微镜(SEM)、透射电子显微镜(TEM)、高分辨透射电子显微镜(HRTEM)和电子衍射(ED)谱研究了该纳米颗粒聚集球的生长特点.结果表明该聚集球是由5-8 nm的纳米颗粒定向连接生长而成,整个聚集球对外显示类单晶的现象.聚集球的大小约为60 nm,随着时间的延长有长大的趋势.X射线能谱(EDX)分析结果和Johnson-Mehl-Avrami(JMA)方程动力学模拟结果表明,在颗粒球形成初始阶段主要是Ba2+离子的扩散成核作用占主导地位.这种“扩散成核-定向生长”的形成过程揭示了钛酸钡纳米颗粒聚集球的生长机理.
钛酸钡;JMA方程;水热法;扩散机理;定向生长
1 引言
钛酸钡(BTO,BaTiO3)是一种性能优异的铁电、介电材料,它被广泛应用于制作多层陶瓷电容器(MLCC)、热敏电阻、动态随机存取存储器(DRAM)和其它光电器件.1,2随着电子元件向小型化、微型化发展,BTO纳米材料的合成及其性能的研究显得更加重要.BTO纳米材料的性能不仅与其组成、相态有关,还与其颗粒的形貌、结构、大小有密切的关系.3-5目前,具有不同形貌的BTO纳米材料,如纳米晶、6,7纳米线、8,9纳米管、10,11纳米空心球、12纳米核壳结构、13BTO复合材料14,15等已经被合成出来,这些形貌各异的纳米材料具有独特的光、电、磁等性质及潜在的应用前景.
为了获得更好的BTO产品和性能,近些年来,人们不断地对BTO的反应机理进行深入的研究.尽管关于BTO的水热反应机理和动力学被大量地研究,16-21但至今还没有一个统一的理论来解释它的形成机理,比较典型的两个机理是Eckert等20提出的原位转化机理和溶解沉淀机理.原位转化机理是钡离子不断在难溶的二氧化钛颗粒表面反应生成BTO;而溶解沉淀机理则是钡离子和可溶性钛的前驱体反应生成BTO,Ti前驱体的溶解性质决定了其反应机理.对水热反应机理进行讨论的另一个方面是成核后晶粒的生长过程:意大利学者Testino等22,23提出了一次成核和二次成核的理论来解释成核后晶粒的生长,但是并没有给出直接的证据;我国学者施尔畏等提出了聚集生长理论,24,25他认为在水热体系中晶粒的生长是聚集生长的结果,这种聚集生长可以分为两类:第一类类似于传统的奥斯特瓦尔德熟化理论;第二类类似于定向生长的理论.26,27这些理论在解释BTO晶体的水热生长过程中都起到了积极的作用.
本文基于简单的水热方法,合成出了钛酸钡纳米颗粒聚集球的新颖结构材料,文献28报道这种材料具有可调的介电性能.通过对其形成机理的深入探讨,并运用动力学模型进行模拟,揭示了BTO纳米颗粒聚集球的形成过程.
2 实验部分
所有原料均购自上海国药集团公司,分析纯.实验方法如下:配置浓度合适的氢氧化钡溶液;将适量的钛酸四丁酯在磁力搅拌下逐滴加入到一定量的无水乙醇中,得到均匀溶胶;再往上述溶胶中逐滴加入氢氧化钡水溶液,使得溶剂乙醇、钛和钡的浓度分别达到8.5、0.05、0.06 mol·L-1;最后往混合物中逐滴加入NaOH溶液使其浓度为0.5 mol·L-1,搅拌均匀后将反应混合物倒入带聚四氟乙烯内衬的水热反应釜,填充度约为60%,封釜,置于一定温度(140、180、220°C)烘箱中进行水热反应.加热一段时间后从烘箱中取出水热釜,急冷至室温.样品离心分离得到白色产物,并用去离子水、0.1 mol·L-1稀醋酸和乙醇交替洗涤数次,以除去残留在颗粒表面的有机杂质,最后,在60°C干燥箱中干燥,得到固体粉末.
样品XRD测试使用RIGAKUD/MAX 2200 VPC粉末X射线衍射仪,配备石墨单色器,Cu Kα射线(λ=0.1541 nm),操作电压和电流分别是40 kV和30 mA,扫描速率为10(°)·min-1,扫描范围为20°-80°.SEM照片使用FEI Quanta 400热场发射扫描电镜,加速电压为15 kV.TEM观察使用JEM-2010透射电镜,加速电压为200 kV.EDS分析使用附在FEI Quanta 400热场发射扫描电镜扫描仪(操作电压15 kV)上的Link ISIS-300X牛津电子能谱分析系统.
3 结果与讨论
3.1 XRD结果
在180°C下于不同反应时间合成典型BTO样品的XRD图谱见图1.从图中可以看出,在反应的初期产物为无定形,随着时间的延长,衍射峰的强度逐渐增加,说明产物钛酸钡开始结晶;在4 min时没有衍射峰显示出来,产品为无定形;当反应进行到15 min后,有明显的衍射峰出现;随着时间的延长,衍射峰的强度逐渐增加,说明BTO的结晶性越来越好;120 min后继续延长时间,衍射峰的强度基本不变,BTO晶化基本完成.经Jade软件分析,其样品所有衍射峰都与立方相BTO的标准衍射卡片(JCPDS No.31-0174)相符.

图1 180°C反应不同时间所得BTO样品的XRD谱图Fig.1 Powder XRD patterns of the BTO samples synthesized at 180°C with different reaction time
3.2 电镜分析结果
图2是在180°C下,不同反应时间BTO纳米晶体的生长过程中典型产品的SEM和TEM图.图2a是水热反应4 min的BTO样品,XRD显示该产品呈无定形,从图中可以看出产品是由许多纳米颗粒和胶状物组成的团聚体.该样品经过30 min的水热晶化如图2b所示,XRD显示有明显的BTO晶体生成, SEM和TEM显示样品是由许多BTO纳米颗粒组成的聚集球,聚集球大多处于60 nm左右.图2b3是其单个聚集球的TEM图,从中可以清楚地看出聚集球是由许多纳米颗粒组成,其ED(图2b4)显示整个聚集球呈类单晶结构,说明这些纳米颗粒在晶体取向上是一致的.图2b5的HRTEM分析显示纳米颗粒大多处于5-8 nm之间,各个晶粒在晶体学取向保持一致,虽然颗粒之间存在一些缺陷和少量的无定形物,晶格条纹不是太连续,但整个颗粒球的快速傅里叶变换(FFT)对外显示类单晶的现象.这个纳米颗粒聚集球不是随意的无规则的聚集体,它类似于Mesocrystal晶体.29,30这时晶体的生长符合定向生长的现象26,27及施尔畏提出的第二类聚集生长理论.25继续延长水热晶化时间如图2c的SEM和TEM显示,聚集球继续长大,表面附聚有许多纳米颗粒,内部由于颗粒之间的相互融合更加致密.

图2 180°C反应不同时间所得BTO样品的SEM(a1,b1,c1)、TEM(a2,b2,c2)、单个聚集球的TEM(b3)、HRTEM(b5)、ED(b4)图Fig.2 SEM(a1,b1,c1),TEM(a2,b2,c2),TEM of single aggregated particle(b3),HRTEM(b5)images and ED pattern(b4)of the BTO samples synthesized at 180°C with different reaction time t/min:(a)4,(b)30,(c)720
据有关文献31,32报道,距离很近的纳米颗粒之间会采取相同的晶体学取向,可能是由于大颗粒晶体的某个方向的极化而形成的电场对小颗粒的取向存在一种诱导作用.33当BTO纳米晶核刚形成时,这种相互作用就不能够忽略,他们之间的相互作用会导致晶粒之间在取向上采取相同的方向,从而实现自我定向生长的模式,这种自我的定向生长也使得体系能稳定存在.实验观察到的这种BTO纳米晶粒定向生长的现象可能就是由于这种作用而团聚在一起,从而对外显示单晶的特征.
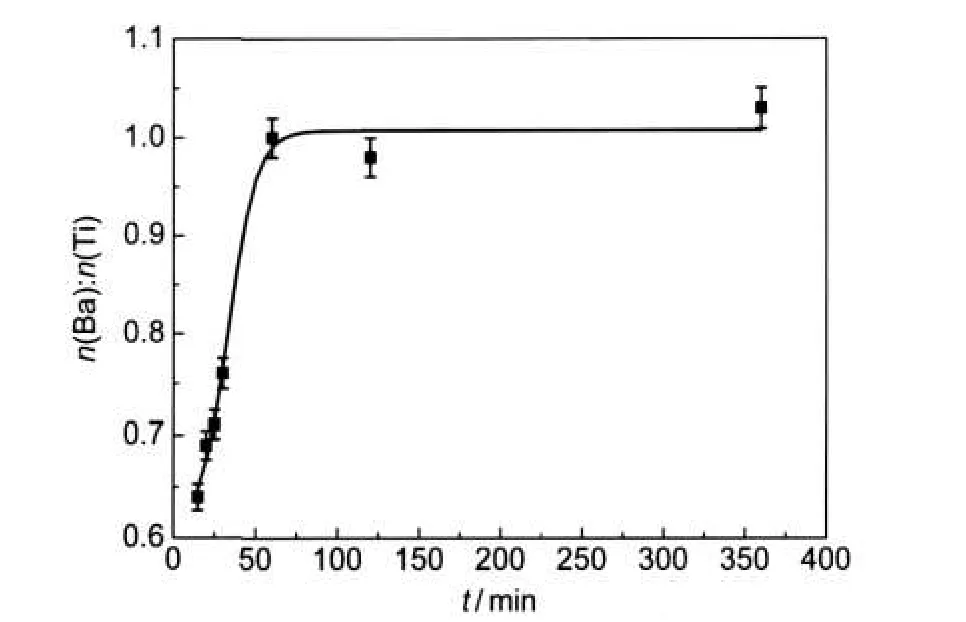
图3 据EDS结果得出的n(Ba):n(Ti)随时间的变化图Fig.3 n(Ba):n(Ti)vs time plots from the results of EDS analysis
3.3 EDS结果
另一个很有趣的现象是随着反应的进行,样品的n(Ba):n(Ti)由0.65逐渐上升到1.0后稳定,这说明产物中Ba2+离子的浓度在不断地增加.由文献22知道,BTO的形成过程分以下两步:(1)钛酸四丁酯迅速分解形成Ti溶胶;(2)Ti溶胶和Ba2+离子缓慢反应生成BTO.在强碱性溶液中,钛酸四丁酯分解生成Ti溶胶,Ti溶胶在强碱的作用下形成网状缠绕的聚合Ti―O链,这些聚合链带有负电荷;带正电荷的Ba2+离子可以被吸附在这些网络结构的聚合物表面或者内部的空隙,在被吸附的位置发生反应生成BTO纳米晶核,位置不同的晶核长大晶化,发生自我的晶向调节定向生长在一起,形成类似单晶结构的纳米颗粒聚集球.由于初始反应物的n(Ba):n(Ti)比为1.2,和图中刚反应形成的BTO纳米颗粒聚集球的n(Ba):n(Ti)比例还是不同,这主要是在生长过程中,Ba2+离子不断地从溶液中扩散注入Ti溶胶反应,形成多个晶核,随着Ba2+离子的扩散,晶粒逐渐晶化长大,最后才形成BTO的正常比例.
3.3 动力学结果
为了进一步阐释BTO晶体的生长机理,分别在220、180、140°C三个温度研究其动力学晶化过程.图4是BTO纳米颗粒在不同温度下的晶化率α随时间的变化过程.晶化率是根据BTO的XRD峰的积分面积计算得出,积分面积采用Jade软件得出,其计算公式34,35如下:

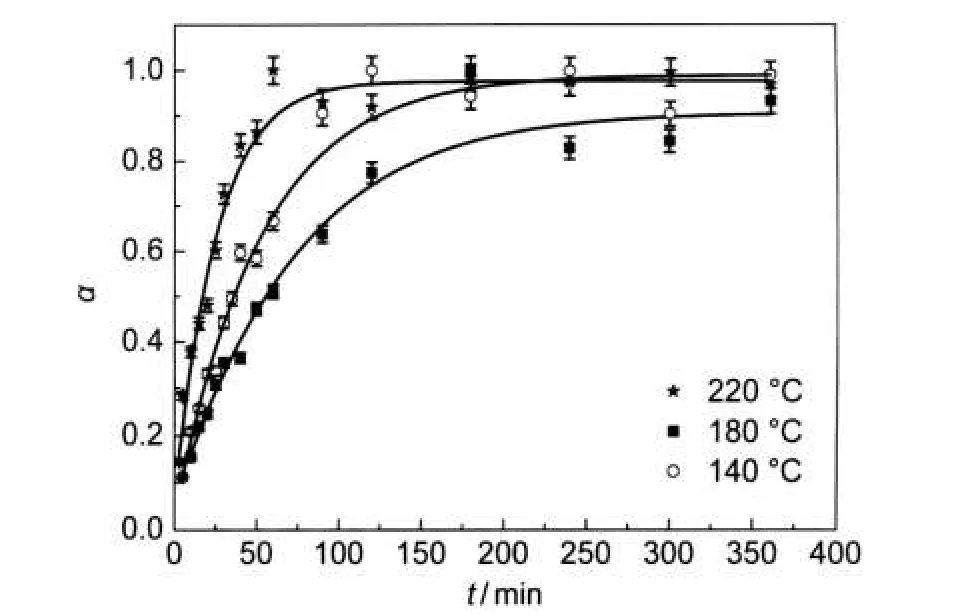
图4 BTO纳米颗粒球分别在三个不同温度下的晶化曲线Fig.4 Crystallization curves for BTO nanoparticles aggregation at different temperaturesα:fractional crystallinity
式中αt是时间为t时的BTO纳米颗粒的晶化率,It是时间为t时的BTO纳米颗粒的积分峰面积,Imax是BTO纳米颗粒的最大峰积分面积,本实验采用(110)峰进行计算.从图4中可以看出,在反应初始,颗粒晶化很快;随着反应的进行,晶化逐渐减慢,最后逐渐稳定在1.0左右;温度越高晶化越快,这主要是由于高温能加快离子的扩散,提高反应速率.
根据图4的数据,使用Johnson-Mehl-Avrami方程20,21,34对其晶化动力学进行分析,这个方程经常用来模拟不同条件下的水热晶化动力学,其形式如下:

其线性形式为
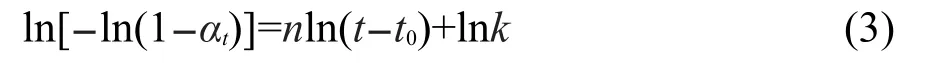
其中,k是反应速率常数,t0是晶化诱导时间,n是Avrami系数.n的意义是用来区分不同的反应机理: n≈0.5意味着扩散过程是控制步骤,即反应物向成核点的迁移速率起决定作用;n≈1意味着产物和反应物之间的相界起控制作用;n>1意味着成核是控制步骤,反应主要以溶解沉淀的机理来进行.21
图5是根据图4的数据,利用公式(3),按照Sharp-Hancock方法20,21,34处理所获得ln[-ln(1-αt)]对ln(t-t0)在0.1≤α≤0.9区间的三个温度的实验数据和拟合直线.对不同温度下的数据进行拟合,所得拟合参数见表1.从图5和表1中可以看出,拟合线和实验点吻合得很好,随着温度的升高,其k值变大,说明高温有利于反应的进行;三个温度下的n值分别为0.63、0.63、0.53,基本接近于0.5,说明反应是受扩散机理控制,和前面的EDS实验结果一致.
根据Arrhenius方程,其形式为:

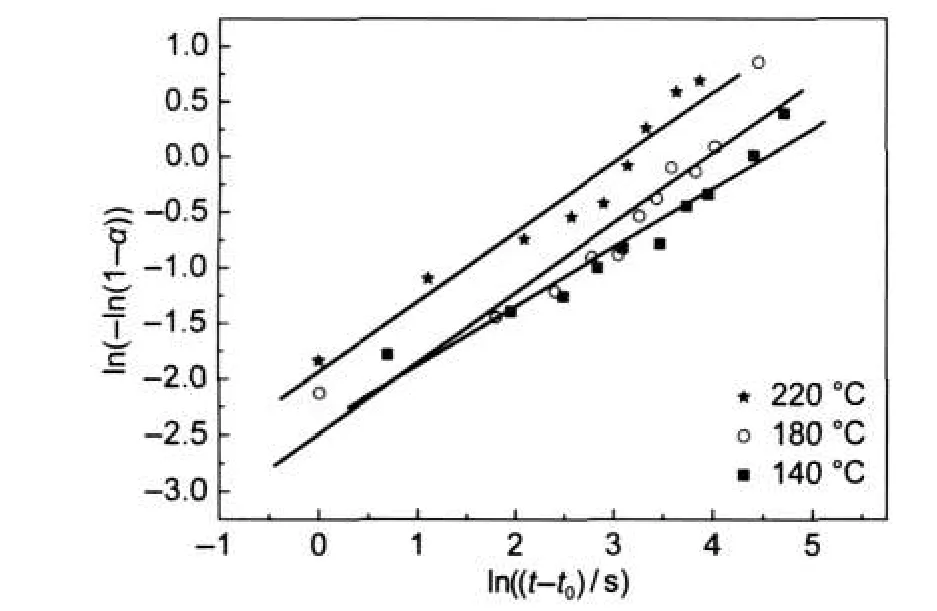
图5 BTO纳米颗粒聚集球在三个温度下的Sharp-Hancock线Fig.5 Sharp-Hancock plots for the crystallization of BTO nanoparticles aggregation at different temperaturesThe lines are derived by linear regression.
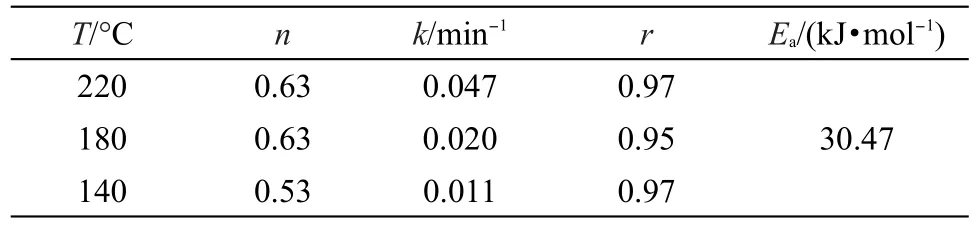
表1 根据Sharp-Hancock法得出的动力学拟合参数Table 1 Kinetic parameters determined by analysis of the crystallization curves using Sharp-Hancock method
式中,Ea是活化能,A0是指前因子,R是气体常数,T是温度.根据方程(4)和表1的数据,可以得到lnk∝1/T的Arrhenius直线,如图6所示,根据直线的斜率进一步获得BTO纳米颗粒球的活化能Ea为30.47 kJ·mol-1.以前在水热条件下报道的BTO的活化能有Eckert20的21 kJ·mol-1,Walton21的55 kJ·mol-1, Hertl的105.5 kJ·mol-1,20,21而我们的值为30.47 kJ· mol-1,这可能是由于使用不同的前驱体Ti源,而且反应条件不同,我们实验采用乙醇作为辅助的溶剂,从而造成以上的偏差.
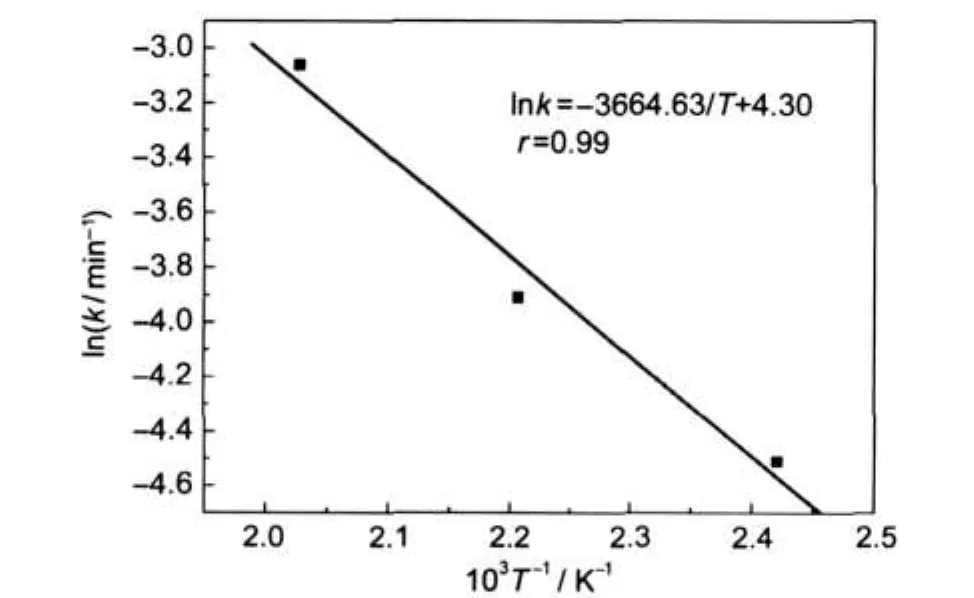
图6 BTO纳米颗粒聚集球晶化的Arrhenius拟合直线Fig.6 AnArrhenius plots for BTO nanoparticles aggregation crystallizationk:the reaction rate constant
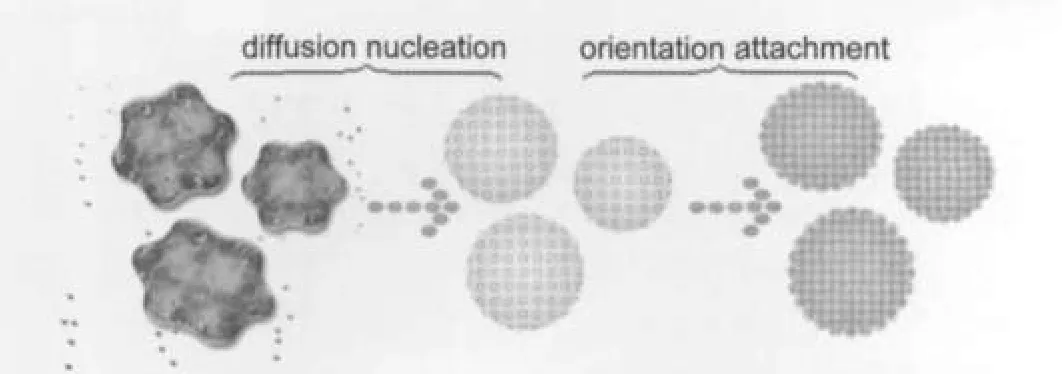
图7 BTO纳米颗粒聚集球形成示意图Fig.7 Schematic illustrating the formation process of the BTO nanoparticles aggregation
根据以上的实验结果和理论分析可以得出BTO纳米颗粒聚集球的形成机理如图7所示.
4 结论
钛酸四丁酯在矿化剂NaOH的作用下迅速分解形成Ti溶胶,Ba2+离子缓慢扩散和Ti溶胶反应生成BTO;随着晶化时间的延长,BTO纳米晶核长大彼此发生定向的连接生长最终形成BTO纳米颗粒聚集球.这种“扩散成核-定向生长”的过程解释了其生长机理,也进一步完善了BTO纳米晶体的水热生长理论.
(1) Pithan,C.;Hennings,D.;Waser,R.Int.J.Appl.Ceram. Technol.2005,2,1.
(2) Lott,J.;Xia,C.;Kosnosky,L.;Weder,C.;Shan,J.Adv.Mater. 2008,20,3649.
(3)Guo,H.F.;Zhang,X.T.;Liu,B.;Li,Y.C.;Huang,Y.B.;Du,Z. L.Acta Phys.-Chim.Sin.2004,20,164. [郭惠芬,张兴堂,刘 兵,李蕴才,黄亚彬,杜祖亮.物理化学学报,2004,20, 164.]
(4) Ding,S.W.;Zhai,Y.Q.;Li,Y.;Wang,Z.Q.;Li,J.L.Sci.China Ser.B-Chem.2000,43,283.
(5)Ruan,S.P.;Dong,W.;Wu,F.Q.;Wang,Y.W.;Yu,T.;Peng,Z. H.;Xuan,L.Acta Phys.-Chim.Sin.2003,19,17.[阮圣平,董 玮,吴凤清,王永为,于 涛,彭增辉,宣 丽.物理化学学报,2003,19,17.]
(6) Cui,B.;Wang,X.;Li,Y.D.Chem.J.Chin.Univ.2007,28,1. [崔 斌,王 训,李亚栋.高等学校化学学报,2007,28,1.]
(7)OʹBrien,S.;Brus,L.;Murray,C.B.J.Am.Chem.Soc.2001, 123,12085.
(8) Zhu,Q.A.;Song,F.P.;Chen,W.P.;Wang,S.F.;Sun,X.F.; Zhang,Q.Chem.J.Chin.Univ.2006,27,1612.[朱启安,宋方平,陈万平,王树峰,孙旭峰,张 琪.高等学校化学学报, 2006,27,1612.]
(9)Urban,J.J.;Yun,W.S.;Gu,Q.;Park,H.J.Am.Chem.Soc. 2002,124,1186.
(10) Mao,Y.;Banerjee,S.;Wong,S.S.J.Am.Chem.Soc.2003,125, 15718.
(11) Hernandez,B.A.;Chang,K.S.;Fisher,E.R.;Dorhout,P.K. Chem.Mater.2002,14,480.
(12) Nakano,H.;Nakamura,H.J.Am.Ceram.Soc.2006,89,1455.
(13) Buscaglia,M.T.;Viviani,M.;Zhao,Z.;Buscaglia,V.;Nanni,P. Chem.Mater.2006,18,4002.
(14) Hua,Z.H.;Li,D.;Fu,H.Acta Phys.-Chim.Sin.2009,25, 145.[华正和,李 东,付 浩.物理化学学报,2009,25, 145.]
(15) Wei,J.H.;Shi,J.;Guan,J.G.;Yuan,R.Z.Acta Phys.-Chim. Sin.2003,19,657.[魏建红,石 兢,官建国,袁润章.物理化学学报,2003,19,657.]
(16)Wang,T.X.;Yang,C.;Huang,P.;Zhao,G.P.;Li,Y.R.Chin.J. Inorg.Chem.2009,25,1414.[王婷霞,杨 春,黄 平,赵国平,李言荣.无机化学学报,2009,25,1414.]
(17) Xia,C.T.;Shi,E.W.;Zhong,W.Z.;Guo,J.K.Chin.Sci.Bull. 1995,40,2002.
(18) Zhong,W.Z.;Liu,G.Z.;Shi,E.W.;Hua,S.K.;Tang,D.Y.; Zhao,Q.L.Sci.China Ser.B-Chem.1994,37,1288.
(19)Li,Q.L.;Chen,S.T.;Yao,P.;Wei,G.;Qu,Y.H.Acta Phys.-Chim.Sin.2000,16,170.[李青莲,陈寿田,姚 朴,魏 国,曲永和.物理化学学报,2000,16,170.]
(20) Eckert,J.O.;Hung-Houston,C.C.;Gerstan,B.L.;Lenka,M. M.;Riman,E.R.J.Am.Ceram.Soc 1996,79,2929.
(21) Walton,R.I.;Millange,F.;Smith,R.I.;Hansen,T.C.;OʹHare, D.J.Am.Chem.Soc.2001,123,12547.
(22)Testino,A.;Buscaglia,V.;Buscaglia,M.T.;Viviani,M.;Nanni, P.Chem.Mater.2005,17,5346.
(23) Testino,A.;Buscaglia,M.T.;Buscaglia,V.;Viviani,M.; Bottino,C.;Nanni,P.Chem.Mater.2004,16,1536.
(24)Shi,E.W.;Xia,C.T.;Wang,B.G.;Zhong,W.Z.J.Inorg. Mater.1996,11,193.[施尔畏,夏长泰,王步国,仲维卓.无机材料学报,1996,11,193.]
(25) Shi,E.W.;Chen,Z.Z.;Yuan,R.L.;Zheng,Y.Q.Hydrothermal Crystallography.Scicne Press:Beijing,2004;pp 222-249. [施尔畏,陈之战,元如林,郑燕青.水热结晶学.北京:科学出版社,2004:222-249.]
(26) Penn,R.L.;Banfield,J.F.Geochim.Cosmochim.Acta 1999, 63,1549.
(27) Penn,R.L.;Banfield,J.F.Science 1998,281,969.
(28) Hou,R.Z.;Ferreira,P.;Vilarinho,P.M.Chem.Mater.2009,21, 3536.
(29)Wang,T.X.;Colfen,H.;Antonietti,M.J.Am.Chem.Soc.2005, 127,3246.
(30) Cölfen,H.;Antonietti,M.Angew.Chem.Int.Edit.2005,44, 5576.
(31) Wang,T.;Antonietti,M.;Cölfen,H.Chem.Eur.J.2006,12, 5722.
(32)Liu,Z.;Wen,X.D.;Wu,X.L.;Gao,Y.J.;Chen,H.T.;Zhu,J.; Chu,P.K.J.Am.Chem.Soc.2009,131,9405.
(33) Nassif,N.;Pinna,N.;Gehrke,N.;Antonietti,M.;Jager,C.; Cölfen,H.Proc.Natl.Acad.Sci.U.S.A.2005,102,12653.
(34) Croker,D.;Loan,M.;Hodnett,B.K.Cryst.Growth Des.2009, 9,2207.
(35)Zhou,Y.;Antonova,E.;Bensch,W.;Patzke,G.R.Nanoscale 2010,2,2412.
July 20,2011;Revised:September 21,2011;Published on Web:October 10,2011.
Formation Mechanism of Barium Titanate Nanoparticle Aggregations
ZHAN Hong-Quan JIANG Xiang-Ping*LI Xiao-Hong LUO Zhi-Yun CHEN Chao LI Yue-Ming
(Jiangxi Key Laboratory of Advanced Ceramic Materials,Department of Material Science and Engineering, Jingdezhen Ceramic Institute,Jingdezhen 333403,Jiangxi Province,P.R.China)
A novel nanoparticle aggregation structure of barium titanate was obtained by the hydrothermal method.Powder X-ray diffraction(XRD)revealed that the aggregates crystallized in the cubic phase.The crystallization of the products became more significant with reaction progress.The growth characteristics of the aggregates was further confirmed by scanning electron microscopy(SEM), transmission electron microscopy(TEM),high resolution transmission electron microscopy(HRTEM),and electron diffraction(ED)spectroscopy.The aggregation was composed of many 5-8 nm nanoparticles by orientation attachment and we found that the ED patterns indicated a single-crystal property for the aggregates.The size of the aggregates was about 60 nm and they grew as the reaction continued.From the results of energy dispersive X-ray(EDX)spectroscopy analysis and kinetics modeling using the Johnson-Mehl-Avrami(JMA)equation,the diffusion nucleation of Ba2+ion was found to be dominant during the early stages of aggregation formation.The growth process of“diffusion nucleation-orientation attachment”revealed the formation mechanism of barium titanate nanoparticle aggregations.
Barium titanate; JMAequation;Hydrothermal method;Diffusion mechanism; Orientation attachment
10.3866/PKU.WHXB20112927
∗Corresponding author.Email:jiangxp64@163.com,zhq_0425@163.com;Tel:+86-798-8499237.
The project was supported by the National Natural Science Foundation of China(91022027,51062005,50862005).
国家自然科学基金(91022027,51062005,50862005)资助项目
O643.12
