中华锯齿米虾卵黄蛋白的纯化鉴定
2011-12-09穆淑梅杨炎孙世杰康现江
穆淑梅,杨炎,2,孙世杰,康现江
(1.河北大学 生命科学学院,河北 保定 071002;2.华北制药金坦生物技术股份有限公司 生物产品中心,河北 石家庄 050035)
中华锯齿米虾卵黄蛋白的纯化鉴定
穆淑梅1,杨炎1,2,孙世杰1,康现江1
(1.河北大学 生命科学学院,河北 保定 071002;2.华北制药金坦生物技术股份有限公司 生物产品中心,河北 石家庄 050035)
为了研究中华锯齿米虾卵黄蛋白的性质,利用聚丙烯酰胺凝胶电泳,采用不同的染色方法对其进行分析鉴定,并采用电泳洗脱法从中华锯齿米虾成熟卵巢中将其分离纯化.研究结果表明,中华锯齿米虾成熟卵巢中的卵黄蛋白为糖脂复合蛋白,该蛋白分子质量为434ku.利用SDS-聚丙烯酰胺凝胶电泳技术分析该卵黄蛋白由3个主要亚基组成,分子质量分别为108,89,78ku.
中华锯齿米虾;卵黄蛋白;电泳洗脱;纯化;鉴定
卵生动物中,卵黄生成是卵母细胞发育过程中的一个重要步骤,也是一个营养储备的过程,将蛋白质、脂肪、糖等营养物质储存到卵子中以备胚胎发育之需[1-2].而卵子中卵黄的主要成分是卵黄蛋白(vitellin,Vn),因此,该蛋白的合成也就成为考察雌性动物生殖能力的一个很好的指标.雌性动物中,卵黄蛋白原(vitellogenin,Vg)是卵黄蛋白的前体,产生之后经由血淋巴运送到卵母细胞,经过一系列修饰及分解作用转化成卵黄蛋白,与卵黄蛋白有着免疫同一性[3].
卵黄蛋白(原)通常仅存在于雌性动物中,但是现在也有其在雄性动物中出现的报道,这通常与动物的内分泌紊乱或环境激素引发的不良效应有关[2,4].因此,卵黄蛋白(原)的存在也常用于研究激素参与的生殖调控[1]以及评估环境激素引发的不良生理效应[2,4-5]等方面.那么,在研究卵黄蛋白的合成以及激素(外源、内源)的调控(影响)作用之前,有必要对卵黄蛋白进行分离纯化和性质研究,为后续的抗体制备以及在此基础之上所做的上述研究提供基础资料.
目前有关甲壳动物卵黄蛋白性质的研究国内外已有很多的报道,已经分离出日本对虾(Penaeus japonicus)[6]、斑节对虾(P.monodon)[7]、短沟对虾(P.semisulcatus)[8]、南美白对虾(P.vannamei)[8]、凡纳滨 对 虾 (Litopenaeusmerguiensis)[9]、克 氏 原 螯 虾 (Procambiusclarkii)[10]、红 螯 光 壳 螯 虾 (Cherax quadricarinatus)[11]、日本沼虾(Macrobrachiumnipponense)[12]、罗氏沼虾(M.rosenbergii)[13]等种类的卵黄蛋白.卵黄蛋白的提纯方法主要有高效液相色谱仪法、密度梯度离心法、蔗糖-EDTA-硫酸铵沉淀法、凝胶过滤-阴离子交换层析法、电泳洗脱法等.
本实验以中华锯齿米虾为实验材料,采用电泳洗脱法从其成熟卵巢中分离纯化卵黄蛋白,利用梯度聚丙烯酰胺凝胶电泳和SDS-PAGE分析卵黄蛋白的性质,为卵黄蛋白的合成等研究提供基础.
1 材料与方法
1.1 材料
实验所用中华锯齿米虾购自河北安新,产于白洋淀天然水体.选取卵巢发育成熟的中华锯齿米虾,冰浴条件下将其解剖,迅速取出卵巢备用.
1.2 试剂
天然高分子质量标准蛋白:Bovine serum albumin(67ku),Lactate dehydrogenase(140ku),Catalase(232ku),Ferritin(440ku),Thyroglobulin(669ku),Pharmaica.
SDS-高分子质量标准蛋白:Glutamate dehydrogenase(53ku),Transferrin (76ku),β-Galactosidase(116ku),α-2-Macroglobulin(170ku),Myosin(220ku),Pharmaica.
1.3 仪器
JA2003电子天平,上海精科;Phs-3C酸度计,上海伟业仪器厂;Sigma 2-16K高速冷冻离心机;DYY-Ⅲ6B恒流稳压电泳仪、DYC-Z24D电泳槽、DYC-Z40A回收电泳槽,均为北京六一仪器厂产品;Uniscan B880扫描仪,清华紫光股份有限公司.
1.4 方法
1.4.1 卵巢粗提液的制备
取中华锯齿米虾成熟卵巢,电子天平上称取0.5g,加入5mL预冷的蛋白提取液(0.5mol/L Tris-HCl,2mmol/L EDTA,0.1mol/L NaCl,0.1mmol/L PMSF,pH 7.4)匀浆.将匀浆液离心15min(4℃,10 000r/min),弃除上层油脂和下层沉淀,余者即为卵巢粗提液.
1.4.2 卵黄蛋白的鉴定
非变性条件下聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)分析其卵巢粗提液,所用分离胶质量分数为6%,pH 8.9.电泳结束,将胶板纵向分为3部分,分别进行糖蛋白染色(过碘酸-Schiff's试剂),脂蛋白染色(苏丹黑B)以及考马斯亮蓝染色,分析蛋白性质[12].
1.4.3 电泳洗脱纯化卵黄蛋白
成熟卵巢粗提液进行PAGE电泳(分离胶质量分数6%,pH 8.9)后,采用电泳洗脱法对其卵黄蛋白进行纯化[12].
1.4.4 电泳分析卵黄蛋白分子质量
采用梯度聚丙烯酰胺凝胶电泳(分离胶质量分数4%~15%,pH 8.9)分析上述纯化卵黄蛋白的分子质量,加入天然高分子质量标准蛋白.
1.4.5 电泳分析卵黄蛋白亚基性质
SDS-PAGE(分离胶质量分数7%,pH 8.9)分析该卵黄蛋白亚基数目及分子质量.用还原样品缓冲液(含体积分数5% 的β-巯基乙醇和质量分数2% 的SDS)处理样品,加样前沸煮10min,同时加入SDS-高分子质量标准蛋白.
2 结果
2.1 卵黄蛋白的鉴定与纯化
PAGE分析中华锯齿米虾成熟卵巢粗提液,结果显示考马斯亮蓝、糖蛋白、脂蛋白3种染色方法同时呈现阳性的蛋白带仅1条,而且迁移位置也一致(图1).其他学者的研究结果证实,甲壳动物的卵黄蛋白为具有高分子质量的糖脂复合蛋白,所以可以确定本实验中的这条3种染色均为阳性的蛋白带即为中华锯齿米虾成熟卵巢中的卵黄蛋白.而在这条卵黄蛋白条带下方还有一条考马斯亮蓝深染的蛋白条带(图1a),但脂蛋白和糖蛋白染色均呈阴性(图1b,c),说明此蛋白非糖脂蛋白,同时证明染色鉴定卵黄蛋白的结果是可信的.此外,由于卵黄蛋白上结合有类胡萝卜素,所以在电泳过程中和电泳结束后,可在凝胶上看到一条较浅的橙黄色条带.这一结果与柳峰松等[14]的研究结果一致.

图1 中华锯齿米虾卵巢粗提液聚丙烯酰胺凝胶电泳后卵黄蛋白的鉴定Fig.1 Identifying Vn from the matured ovaries of Neocaridinadenticulatasinensis via native PAGE
将电泳洗脱纯化所得样品进行PAGE验证,考马斯亮蓝以及脂蛋白、糖蛋白特异染色结果均呈阳性(图2),说明纯化所得样品即为卵黄蛋白.
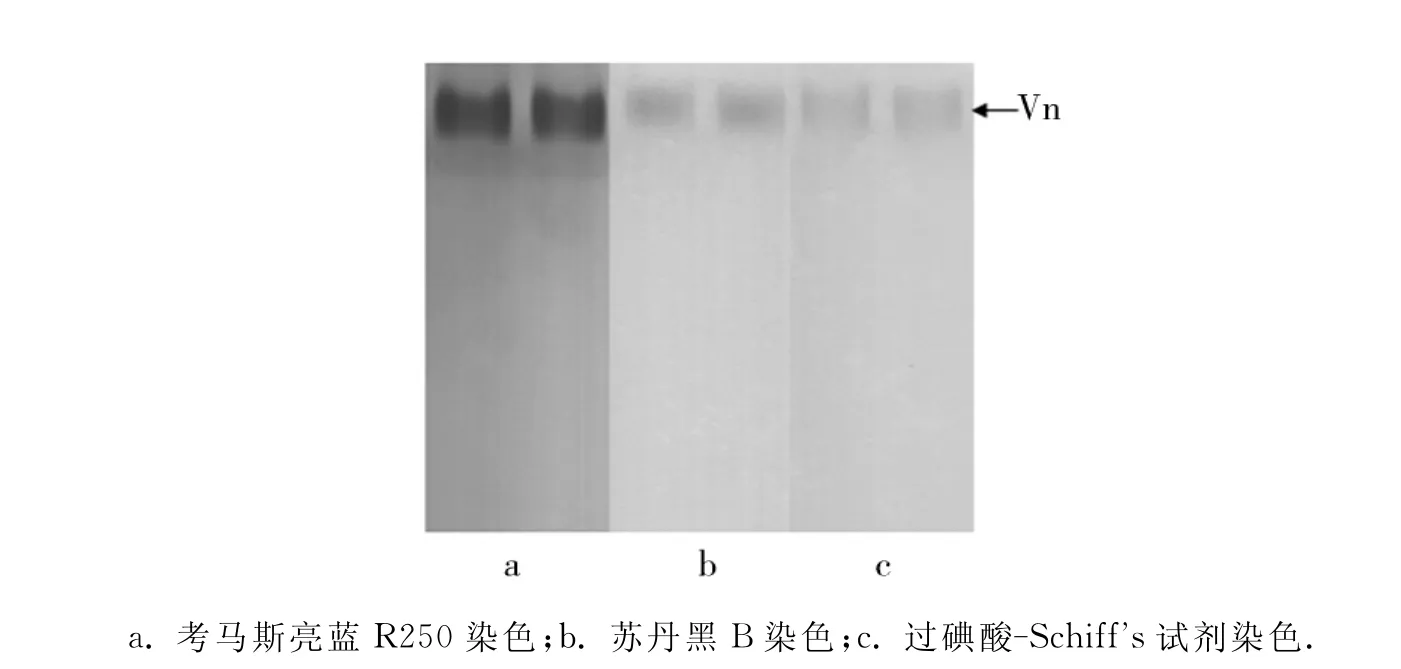
图2 纯化卵黄蛋白聚丙烯酰胺凝胶电泳后的不同染色结果Fig.2 Native PAGE for the purified Vn with different staining means
2.2 卵黄蛋白及其亚基性质分析
梯度聚丙烯酰胺凝胶电泳分析已纯化的卵黄蛋白,根据标准蛋白曲线确定其分子质量为434ku(图3).经SDS-PAGE分析,确定该蛋白由3个主要亚基组成,分子质量分别为108,89,78ku(图4).

图3 梯度聚丙烯酰胺凝胶电泳分析卵黄蛋白的分子质量Fig.3 Gradient PAGE for the molecular mass of Vn
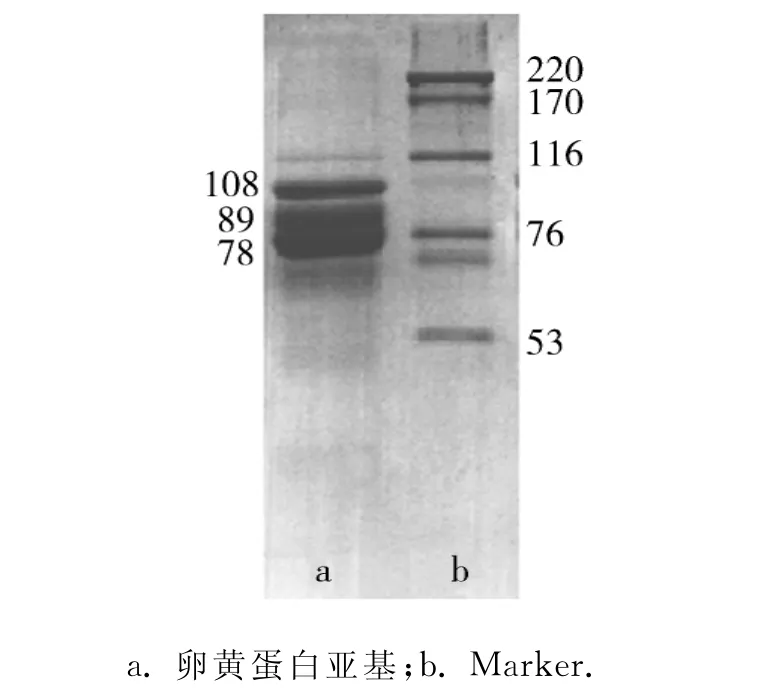
图4 SDS-聚丙烯凝胶电泳分析卵黄蛋白亚基及其分子质量Fig.4 SDS-PAGE for the subunits and the molecular mass
3 讨论
目前对已经分离出的甲壳动物卵黄蛋白的研究一致认为,卵黄蛋白是一种高分子质量的糖脂蛋白,因此,本实验根据其这一特性,PAGE电泳后,通过糖蛋白、脂蛋白特异染色,对比考马斯亮蓝染色结果,分析确定了中华锯齿米虾成熟卵巢粗提液中的卵黄蛋白,随后采用电泳洗脱法对该蛋白进行了分离纯化.电泳洗脱法对于样品中含量丰富的蛋白(如甲壳动物成熟卵巢中的卵黄蛋白)的回收纯化是一种简便而快捷的方法,且提纯的蛋白纯度较高,比较适用于蛋白质的氨基酸组成分析、分子质量及亚基组成等性质分析的研究.
实验中采用聚丙烯酰胺梯度凝胶电泳以及SDS-PAGE的方法,分别分析了中华锯齿米虾成熟卵巢中卵黄蛋白的总分子质量及其亚基组成和各亚基分子质量.中华锯齿米虾成熟卵巢中存在1种卵黄蛋白,其分子质量为434ku,该蛋白由3个主要的亚基组成,分子质量分别为108,89,78ku.由结果可以看出,3个亚基分子质量之和与卵黄蛋白分子质量稍有差距,但是,这在关于甲壳动物卵黄蛋白的性质研究中是非常普遍的现象[6-13],如谢松等[10]同样采用电泳回收的方法对克氏原螯虾的卵黄蛋白进行了纯化,聚丙烯酰胺梯度凝胶电泳分析其总分子质量为481ku,SDS-PAGE结果显示该蛋白具有6个亚基,分子质量分别为198,176,132,111,92,82ku.究其原因,可能与分析蛋白分子质量的方法有关.在已有的研究中,通常均采用SDSPAGE来分析各物种卵黄蛋白的亚基组成及分子质量[6-13].SDS-PAGE分析蛋白分子质量的原理在于SDS所带的大量负电荷,消除或掩盖了与其结合的不同种类蛋白质间原有电荷的差异,从而利用分子质量差异将各种蛋白质分开.但是SDS-PAGE亦有不足之处,如对于带有较大辅基的蛋白(糖蛋白、脂蛋白等),由于它们的侧链会直接影响蛋白质与SDS结合后的形状,故不能确保电泳迁移率与蛋白分子质量的对数间的线性关系[15].但由于SDS-PAGE检测简便快捷,所以仍是目前研究分析卵黄蛋白亚基分子质量的首选.
研究甲壳动物卵黄蛋白,最终目的是要了解其合成积累机理,对卵黄蛋白的纯化鉴定则是这一工作的前提.通过分离纯化卵黄蛋白来制备其特异性抗体,由于卵黄蛋白与其前体卵黄蛋白原具有免疫同一性,该抗体可用以检测卵黄蛋白原的发生以及卵黄蛋白的积累部位,探讨其合成机理,了解相关激素的内分泌调控机制,为在养殖过程中实现亲本促熟提供科学依据.
[1]TSUKIMURA B.Crustacean vitellogenesis:its role in oocyte development[J].American Zoologist,2001,41:465-476.
[2]SHECHTER A,AFLALO E D,DAVIS C,et al.Expression of the reproductive female-specific vitellogenin gene in endocrinologically induced male and intersexCheraxquadricarinatuscrayfish[J].Biology of Reproduction,2005,73:72-79.
[3]AVARRE J C,MICHELIS R,TIETZ A,et al.Relationship between vitellogenin and vitellin in a marine shrimp(Penaeussemisulcatus)and molecular characterization of vitellogenin complementary DNAs[J].Biology of Reproduction,2003,69(1):355-364.
[4]COCCIA E,LISA E D,CRISTO C D,et al.Effects of estradiol and progesterone on the reproduction of the freshwater crayfishCheraxalbidus[J].Biological Bulletin,2010,218:36-47.
[5]SPANÒL,TYLER C R,VAN AERLE R,et al.Effects of atrazine on sex steroid dynamics,plasma vitellogenin concentration and gonad development in adult goldfish(Carassiusauratus)[J].Aquatic toxicology,2004,66:369-379.
[6]KAWAZOE I C,JASMANI S A,SHIH T U,et al.Purification and characterization of vitellin from the ovary of kuruma prawn,Penaeusjaponicus[J].Fisheries Science,2000,66:390-396.
[7]QUINTIO E T,HARA A,YAMAUCHI K,et al.Isolation and characterization of vitellin from the ovary ofPenaeus monodon[J].Invertebrate Reproduction & Development,1990,17(3):221-227.
[8]TOM M,FINGERMAN M,HAYES T K,et al.A comparative study of the ovarian proteins from two penaeus shrimp,Penaeussemisulcatusde Hann andPenaeusvannamei(Boone)[J].Comparative Biochemistry and Physiology Part B,1992,102(3):483-490.
[9]AUTTARAT J,PHIRIYANGKUL P,UTARABHAND P.Characterization of vitellin from the ovaries of the banana shrimpLitopenaeusmerguiensis[J].Comparative Biochemistry and Physiology Part B,2006,143:27-36.
[10]谢 松,安建宏,梁晓辉,等.克氏原螯虾(Procambiusclarkii)卵黄蛋白的部分生化性质[J].河北大学学报:自然科学版,2006,26(2):199-202.
[11]李荷迪,周忠良,赵云龙.红螯光壳螯虾卵黄磷蛋白的分离纯化和鉴定[J].动物学杂志,2004,39(3):17-21.
[12]穆淑梅,康现江,李彦芹,等.日本沼虾卵黄磷蛋白生化性质分析[J].河北农业大学学报,2006,29(5):72-75.
[13]CHEN Y N,KUO C M.Purification and characterization of vitellin from the freshwater giant prawn,Macrobranchium rosenbergii[J].Zoological Studies,1998,37(2):126-136.
[14]柳峰松,武金霞,谢松,等.成熟中国对虾Penaeuschinensis卵巢中卵黄蛋白的纯化[J].河北大学学报:自然科学版,2001,21(4):406-410.
[15]李建武,余瑞元,袁明秀,等.生物化学实验原理和方法[M].北京:北京大学出版社,2001.
Purification and Identification of Vitellin inNeocaridinadenticulatasinensis
MU Shu-mei1,YANG Yan1,2,SUN Shi-jie1,KANG Xian-jiang1
(1.College of Life Sciences,Hebei University,Baoding 071002,China;2.Center of Biological Products,North China Pharmaceutical Group Corporation(NCPC)GeneTech Biotechnology Development Co.Ltd.,Shijiazhuang 050035,China)
In order to investigate the properties of vitellin(Vn),Vn from the matured ovaries ofNeocaridinadenticulatasinensiswas purified by electroelution and characterized by native polyacrylamide gel electrophoresis(PAGE),gradient PAGE and SDS-PAGE.The results indicated that Vn was a lipoglycoprotein with a molecular mass of 434ku and contained three major subunits(108,89,78ku).
Neocaridinadenticulatasinensis;vitellin;electroelution;purification;identification
Q 959.223
A
1000-1565(2011)06-0638-05
2011-04-10
河北省自然科学基金资助项目(C2011201028);保定市科学研究与发展计划项目(10ZN008)
穆淑梅(1972-),女,河北曲阳人,河北大学讲师,主要从事动物生殖毒理学研究.
康现江(1964-),男,河北邯郸人,河北大学教授,博士生导师,主要从事动物生殖生物学方面的研究.
E-mail:xjkang@hbu.edu.cn
赵藏赏)
