湿法烟气脱硫石膏制备硫酸铵
2011-12-08谭文轶郭菲菲闫怀晴
谭文轶,郭菲菲,曹 鹏,赵 兰,闫怀晴
(南京工程学院 环境工程系,江苏 南京 211167)
湿法烟气脱硫石膏制备硫酸铵
谭文轶,郭菲菲,曹 鹏,赵 兰,闫怀晴
(南京工程学院 环境工程系,江苏 南京 211167)
采用湿法烟气脱硫石膏为原料,与(NH4)2CO3反应,制备(NH4)2SO4。通过X射线衍射仪表征可知:脱硫石膏的主要成分为CaSO4,反应后CaSO4中的Ca2+大部分以CaCO3形式存在于固体沉淀物中,CaCO3粉末平均粒径为80 nm;而原先CaSO4中的不溶性SO2-4则与NH+4结合生成(NH4)2SO4,后者以可溶性SO2-4的形式进入液相。脱硫石膏制备(NH4)2SO4的最佳反应条件:反应时间为1.5 h,反应温度为40℃,搅拌转速为300 r/min,n(CO2-3)∶n(SO2-4)为1.2,在此最佳条件下CaSO4转化率为87.4%。
湿法烟气脱硫;石膏;硫酸铵;综合利用
在现有的烟气脱硫方法中,石灰石-石膏法最为成熟,工业应用也最为广泛。但石灰石-石膏法的广泛应用产生了大量的脱硫石膏[1]。目前,由于烟气脱硫实际运行效果常常不甚理想,同时对脱硫石膏中水分、氯离子含量等要求逐渐严格,限制了脱硫石膏作为水泥、石膏板原材料及农业等方面的利用[2-5]。大量的脱硫石膏如果不进行有效利用,将成为继粉煤灰后火电厂的又一大固体废物。目前已有以磷石膏为原料制取 K2SO4的报道[6-7]。
本工作研究了以脱硫石膏为原料制取K2SO4的第一步反应——制备(NH4)2SO4的工艺影响因素。
1 实验部分
1.1 原料、试剂和仪器
脱硫石膏为某电厂石灰石-石膏法烟气脱硫的副产物,主要成分为CaSO4·2H2O,其化学成分见表1。
实验所用药品均为分析纯。
Bruker D8 ADVANCE型X射线衍射(XRD)仪:扫描速率 5(°)/min,CuKa,λ =0.154 05 nm;测试电压40 kV,测试电流20 mA,德国Bruker公司。SHZ-D(Ⅲ)型循环水多用真空泵:巩义英峪仪器厂。

表1 脱硫石膏的化学成分
1.2 脱硫石膏的预处理及(NH4)2SO4的制备
将脱硫石膏过200目筛网,烘干。称取19.2 g(NH4)2CO3溶解在500 mL的蒸馏水中,配制成(NH4)2CO3溶液。将一定量的脱硫石膏加入(NH4)2CO3溶液中制成混合物,将混合物转移至反应瓶中,在一定搅拌转速下升温至预设反应温度,溶液成悬浊态。
反应完成后,将反应物冷却至室温,抽滤,将滤饼烘干,记为滤饼1。为了证明CaSO4中的SO2-4进入了液相,取部分滤液,加入BaCl2,将所得沉淀过滤,将滤饼烘干,记为滤饼2。
1.3 分析方法
采用文献[8-9]的方法分析脱硫石膏的成分。考虑到反应物和产物为CaSO4和CaCO3的混合物,根据 GB19281—2003《超微细碳酸钙》[10]测定反应前后固体物质中CaCO3的质量,来间接表示脱硫石膏中CaSO4的转化率。
2 结果与讨论
2.1 反应物和产物的XRD分析
脱硫石膏、滤饼1和滤饼2的XRD谱图分别见图1~图3。与标准谱图对比,由图1可见,脱硫石膏与天然石膏的特征衍射峰位置相差不大。由图2可见,滤饼1与CaCO3标准试样的特征衍射峰位置相同,说明滤饼1中的主要成分是CaCO3,通过Sherrer公式计算所生成的CaCO3平均粒径为80 nm。由图3可见,滤饼2与BaSO4标准试样的特征衍射峰位置非常吻合。XRD结果说明,CaSO4中的 Ca2+大部分转化为 CaCO3形式存在,而原先CaSO4中的不溶性SO24-则以可溶性SO24-的形式进入液相,与 NH4+结合生成(NH4)2SO4。
2.2 反应时间对CaSO4转化率的影响
在反应温度为60℃、搅拌转速为300 r/min、n(CO2-3)∶n(SO2-4)为1.2的条件下,反应时间对CaSO4转化率的影响见图4。由图4可见:随反应时间的增加,脱硫石膏中CaSO4转化率逐渐提高;反应1.5 h后,转化率增加幅度不大。这说明反应1.5 h后,反应基本完成,故本实验适宜的反应时间为1.5 h。
2.3 反应温度对CaSO4转化率的影响
在反应时间为1.5 h、搅拌转速为300 r/min、n(CO23-)∶n(SO24-)为1.2的条件下,反应温度对CaSO4转化率的影响见图5。由图5可见:随反应温度升高,反应物分子的热运动加快,CaSO4转化率提高;反应温度高于40℃后,(NH4)2CO3受热易分解,且该反应是放热反应,随温度升高反应速率反而降低,CaSO4转化率也随之降低。因为CaSO4的溶解度在常压下随温度升高先升后降,故反应温度对反应的影响较为复杂,本实验最佳反应温度为40℃。
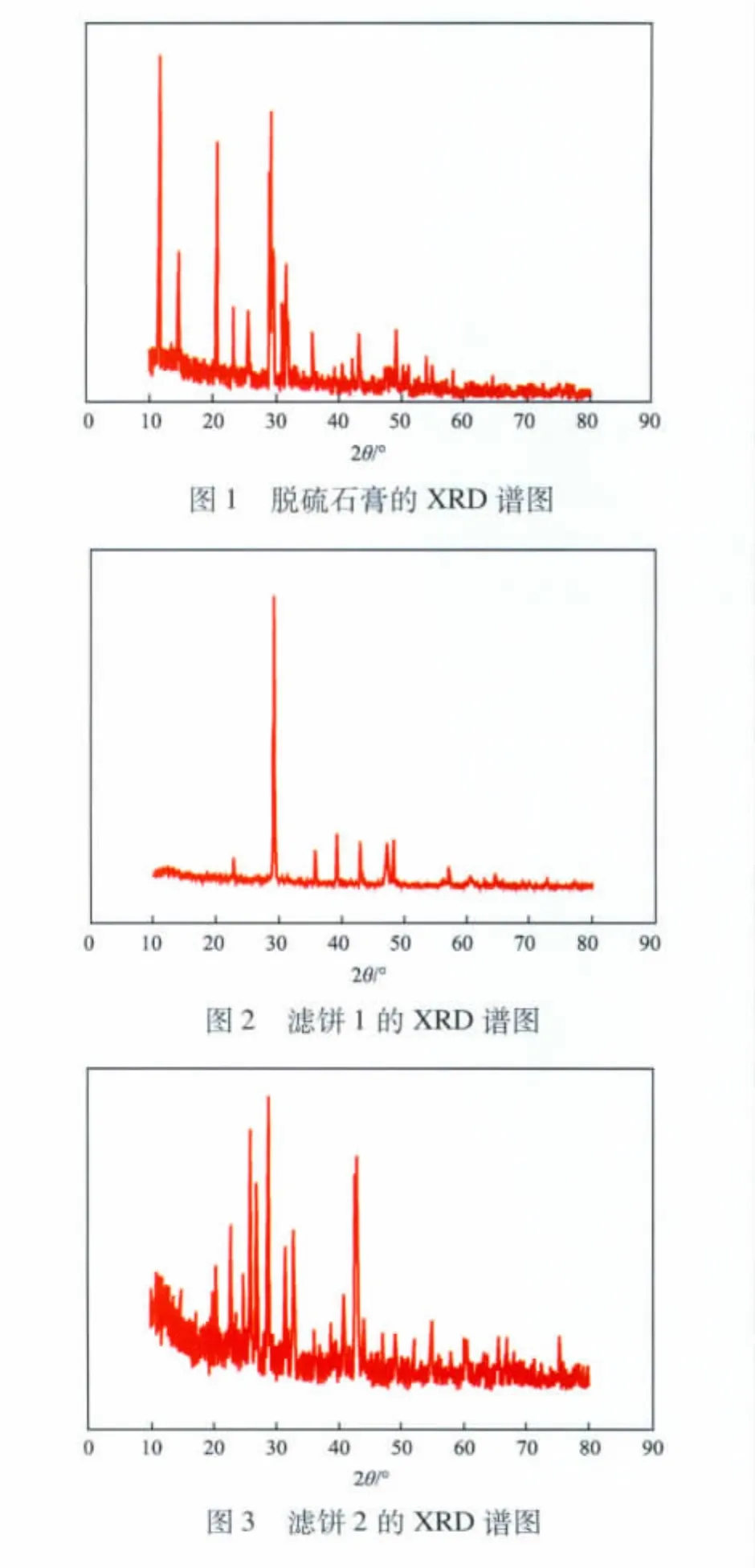
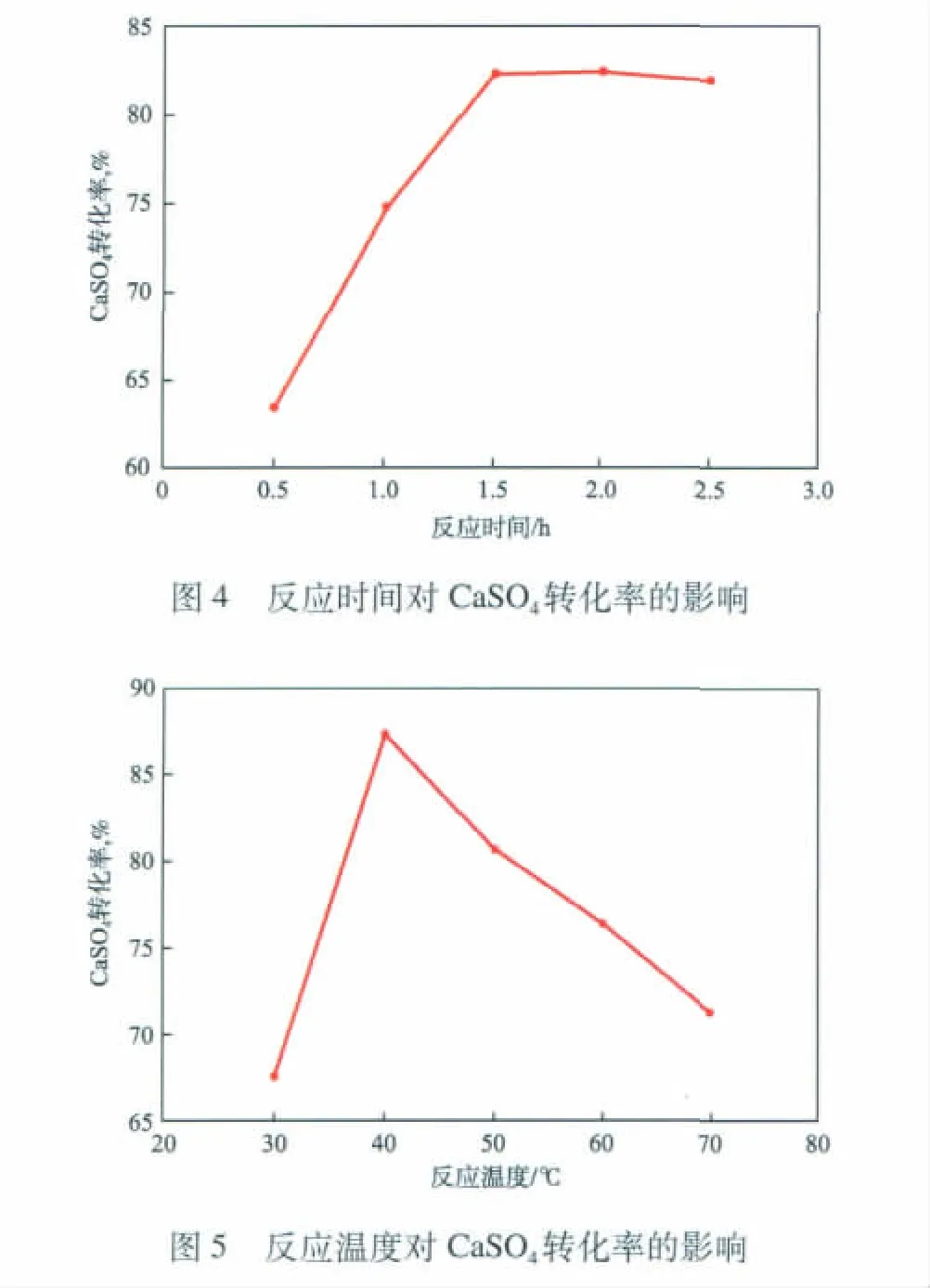
2.4 n(CO23-)∶n(SO24-)对CaSO4转化率的影响
在反应温度为40℃、反应时间为1.5 h、搅拌转速为300 r/min的条件下,n(CO23-)∶n(SO24-)对CaSO4转化率的影响见图6。
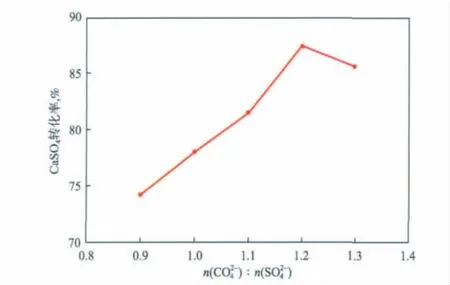
图6n(CO2-3)∶n(SO2-4)对CaSO4转化率的影响
由图6可见:随n(CO23-)∶n(SO24-)增大,CaSO4转化率线性增大;当n(CO23-)∶n(SO24-)为1.2时,CaSO4转化率最高,达87.4%。根据理论计算,最佳 n(CO23-)∶n(SO24-)应为 1.0,而实验的最佳n(CO23-)∶n(SO24-)为 1.2。这是因为,CaSO4的溶度积为4.93 ×10-5,CaCO3的溶度积[11]为 3.36 ×10-9,CaCO3比 CaSO4更难溶解[12-13],同时,在相同浓度条件下,由CaSO4溶解贡献出来的SO24-将会远多于CaCO3溶解贡献的CO23-。但是由于(NH4)2CO3属于弱酸弱碱盐,其水解后不仅含有CO23-还会产生HCO3-,即CO23-会有所减少。因此,加入的(NH4)2CO3的物质的量需要略多一些。
2.5 搅拌转速对CaSO4转化率的影响
在反应温度为 40℃、反应时间为 1.5 h、n(CO2-3)∶n(SO2-4)为1.2的条件下,搅拌转速对CaSO4转化率的影响见图7。由图7可见:随搅拌转速增加,CaSO4转化率增大;搅拌转速大于 300 r/min后,CaSO4转化率增加不明显。这是因为:反应装置中湍动程度随搅拌转速的增加而愈发剧烈,反应物得以均匀分布,同时,较快的搅拌转速能够促进CaSO4的溶解;当搅拌转速达到300 r/min时,CaSO4转化率基本保持不变,此时CaSO4溶解达到一定的平衡,参与反应的Ca2+和SO2-4在溶液中的分布也逐渐保持恒定。
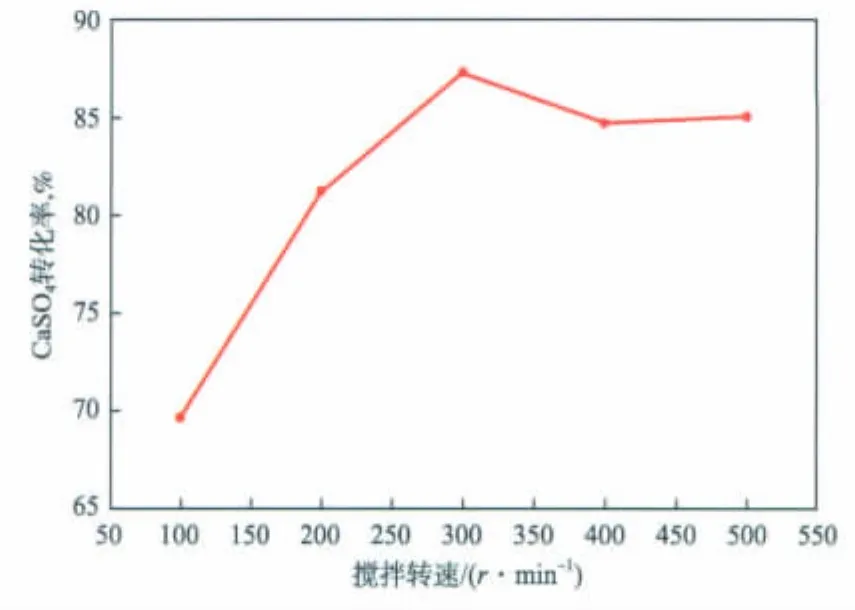
图7 搅拌转速对CaSO4转化率的影响
3 结论
a)采用脱硫石膏为原料,与(NH4)2CO3反应,制备(NH4)2SO4。通过XRD表征可知:脱硫石膏的主要成分为CaSO4,反应后CaSO4中的Ca2+大部分以CaCO3形式存在于固体沉淀物中,CaCO3粉末平均粒径为80 nm;而原先CaSO4中的不溶性SO24-则以可溶性SO24-的形式进入液相,与NH4+结合生成(NH4)2SO4。
b)脱硫石膏制备(NH4)2SO4的最佳反应条件:反应时间为1.5 h,反应温度为40℃,搅拌转速为300 r/min,n(CO23-)∶n(SO24-)为 1.2,在此最佳条件下CaSO4转化率为87.4%。
[1] 金晶,罗庆明,胡华龙.燃煤电厂脱硫石膏产生量分析研究[J].环境与可持续发展,2008,(5):21-23.
[2] 田贺忠,郝吉明,赵喆,等.燃煤电厂烟气脱硫石膏综合利用途径及潜力分析[J].中国电力,2006,(2):3-6.
[3] 耿春女,钱华,李小平,等.脱硫石膏农业利用研究进展与展望[J].环境污染治理技术与设备,2006,7(12):15-19.
[4] Tzouvalas G,Rantis G,Tsimas S.Alternative calciumsulfate-bearing materials as cement retarders:PartⅡ.FGD gypsum[J].Cement Concrete Res,2004,34:2119-2125.
[5] 叶蓓红,谈晓青.我国脱硫石膏与脱硫建筑石膏质量问题及成因分析[J].粉煤灰,2009,(6):38-40.
[6] 张万福.利用磷石膏制硫酸铵的工程化分析[J].化学工程,2009,(11):2 -6.
[7] 黄颂安,许振良,汪瑾.石膏和碳铵母液制取硫酸铵的工艺研究[J].化肥工业,1990,17(5):3-5.
[8] 周志祥,段建中,薛建明.火电厂湿法烟气脱硫技术手册[M].北京:中国电力出版社,2006:301-320.
[9] Laperche V,Bigham J M.Quantitative,chemical and mineralogical characterization of flue gas desulfurization by-production[J].J Environ Quality,2002,31:979 -988.
[10] 国家质量监督检验检疫总局.GB19281—2003超微细碳酸钙[S].北京:中国标准出版社,2003.
[11] 杨宏孝.无机化学[M].第3版.北京:高等教育出版社,2002:157-177.
[12] Chong T H,Sheikholeslami R.Thermodynamics and kinetics for mixed calcium carbonate and calcium sulfate precipitation[J].Chem Eng Sci,2001,56:5391-5400.
[13] Michael S,Roya S.Coprecipitation of CaCO3and CaSO4[J].Can J Chem Eng,2000,(2):21 - 31.
Preparation of Ammonium Sulfate from Wet Flue Gas Desulfurization Gypsum
Tan Wenyi,Guo Feifei,Cao Peng,Zhao Lan,Yan Huaiqing
(Department of Environmental Engineering,Nanjing Institute of Technology,Nanjing Jiangsu 211167,China)
(NH4)2SO4was prepared by the reaction of wet flue gas desulfurization gypsum with(NH4)2CO3.The XRD characterization results indicate that:After reaction,the most of Ca2+in CaSO4,which is the chief constituent of the gypsum,are presented in the solid precipitate in the form of CaCO3with 80 nm of average diameter;However,the insoluble SO2-4in CaSO4reacts with NH+4and turn into(NH4)2SO4,so it can enter into the liquid-phase in the form of soluble SO2-4.Under the optimum reaction conditions of reaction time 1.5 h,reaction temperature 40 ℃,stirring speed 300 r/min and n(CO2-3)∶n(SO2-4)=1.2,the CaSO4conversion rate is 87.4%.
wet flue gas desulfurization;gypsum;ammonium sulfate;comprehensive utilization
X705
A
1006-1878(2011)03-0252-04
2010-12-09;
2011-01-17。
谭文轶(1980—),男,江西省九江市人,博士,副教授,主要从事大气污染控制方面的研究。电话025-86118973,电邮 twy@njit.edu.cn。
江苏省教育厅“青蓝工程”资助项目(2008-30);2010年江苏省高等学校大学生实践创新项目(166201100023)。
(编辑 祖国红)
