工业废气中NOx处理工艺研究
2011-12-08徐媛媛刘华彦李玉芳陈银飞
徐媛媛 刘华彦 李玉芳 陈银飞
(浙江工业大学化学工程与材料学院,绿色化学合成国家重点实验室培育基地,杭州310014)
安全与环保
工业废气中NOx处理工艺研究
徐媛媛 刘华彦 李玉芳 陈银飞
(浙江工业大学化学工程与材料学院,绿色化学合成国家重点实验室培育基地,杭州310014)
针对工业NOx废气氧化度低、氧气及水汽含量高的特点,提出以高硅Na-ZSM-5分子筛为催化剂的催化氧化-碱液吸收-还原性碱液吸收的组合工艺脱除NOx的方法,考察了空时对NO氧化的影响,NOx氧化度、碱液含量、空时对碱液吸收以及还原液种类、空时对还原性碱液吸收的影响。结果表明,空时为0.5 s时,干气下NOx氧化度达到65%,湿气下仍能达到56%;NaOH的质量分数为1%、NOx氧化度为60%时脱除效果最好,且NOx脱除率随着空时的增加而增加;还原液种类中以硫代硫酸钠对NOx脱除效果最好,随着空时的增加,NOx脱除率基本不变。
NOx;NO催化氧化;Na-ZSM-5分子筛;碱液吸收
NOx废气的治理方法主要分为干法和湿法,干法包括催化还原法、催化分解法、吸附法等,湿法包括碱吸收、还原吸收、氧化吸收及络合吸收等[1-4]。与干法相比,湿法具有工艺设备简单、操作费用低廉、吸收剂种类多、适应性强等优点[5]。其中,络合吸收法至今仍未实现工业化,主要原因就在于脱氮液易失活,而且络合反应的速率也有待于进一步提高[6-10]。为实现NOx的治理与回收利用,碱吸收、还原吸收、氧化吸收法应结合使用。从吸收液的成本考虑,可采用碱液吸收,其产生副产物NaNO2和NaNO3可以回收利用[11]。从NOx脱除率考虑,应有还原性或氧化性溶液加以辅助。
工业含NOx废气中,NO的摩尔分数为NOx总量的90%以上,水汽及氧气的摩尔分数可高达~20%[12]。NO难溶于碱液,导致NOx脱除率较低。因此,必须先将NO部分氧化成NO2。目前常用的催化剂有活性炭和活性碳纤维,但在相对湿度为60%以上时,氧化活性低。
李玉芳等研究表明,高硅Na-ZSM-5分子筛具有疏水性和低温活性[13]。因此本研究提出采用高硅Na-ZSM-5分子筛为催化剂、以废气中O2为氧化剂,催化氧化NO为易溶的NO2,再以碱液吸收-还原碱液吸收脱除NOx的新工艺。考察了进口NOx氧化度(OD)、碱液含量、停留时间对碱液吸收以及还原液种类、停留时间对还原性碱液吸收的影响。
1 实验部分
1.1 催化剂处理
选用 Na-ZSM-5(n(SiO2)/n(Al2O3)=300)分子筛。将分子筛原粉在110℃干燥2 h,再在500℃下焙烧3 h,经压片、碾碎、过筛,得到粒径为0.6~0.9 mm颗粒状分子筛催化剂。
1.2 试剂
氢氧化钠、尿素、硫代硫酸钠,分析纯;亚硫酸铵溶液,化学纯。
1.3 实验流程
NO的催化氧化在固定床反应器中进行,碱液吸收、还原性碱液吸收在鼓泡塔反应器中进行。模拟烟气由 NO、NO2、O2和 N2组成,N2作为平衡气,氧气来源于空气。N2和模拟废气流量根据所需NO进口含量及反应时间控制,模拟烟气混合均匀后进入固定床反应器,在催化剂作用下发生NO的氧化,达到一定氧化度的废气自鼓泡吸收塔底部进入并与碱液作用,经吸收后的气体自另一个鼓泡吸收塔底部进入并与还原性碱液作用后从塔顶排出。原料气及尾气中NO、NO2和N2的含量采用Testo-350XL型烟气分析仪测定,直至NO出口含量稳定。
NO氧化度计算如下:
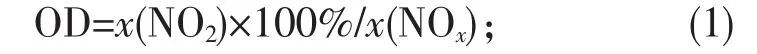
NO、NO2、NOx脱除率的计算如下:
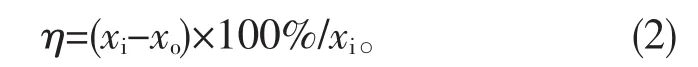
式中,x(NO2)和 x(NOx)分别为 NO2和 NOx的摩尔分数,xi和 xo分别为进出口的 NO、NO2、NOx摩尔分数。
2 结果与讨论
2.1 空时对NO催化氧化的影响
考察30℃下、NO的摩尔分数为0.055%时,干、湿气(相对湿度RH为50%)下空时对NO催化氧化的影响,结果见图1。
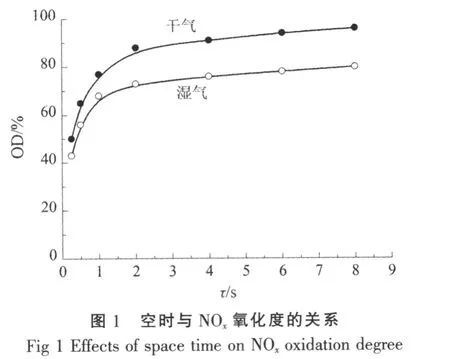
从图1可以看出,在干、湿气下氧化度随空时的变化趋势都是一致的,开始时随着空时增加,氧化度迅速增加,最后增加趋势平缓。但是,在干、湿气下氧化度对空时变化的敏感度是不同的,随着空时的增加,干、湿气下NOx氧化度的差值随空时增加而逐渐增大。
对干气,空时在0~2 s内氧化度增加显著,2 s后氧化度增加趋势平缓,空时为8 s时NOx氧化度可达到96%。对湿气,空时达到1 s后NOx氧化度的增加趋于平稳,8 s时氧化度为75%,并且随着空时的增加,湿气下氧化度增加量没有干气下的明显,说明水汽抑制了该反应:1)有水汽存在时,虽然空时大对NO吸附及氧化有利,但相应地对水汽的吸附也有利。空时越大,H2O分子和NO竞争吸附越激烈,导致氧化度提高作用越不明显。2)有水汽存在时,生成的NO2部分可能会发生如下反应:
3NO2+H2O→ 2HNO3+NO。 (3)
对于反应(3)的判断来源于空时长且相对湿度大时,出口NOx总含量稍微低于进口,即NO2部分与H2O反应生成HNO3,这样不仅造成NOx氧化度的降低,同时也使出口NOx的总量减少。图1所示,空时为0.5 s时,干气下NOx氧化度达到65%,湿气下仍能达到56%。由此也可以看出,利用高硅Na-ZSM-5分子筛作为催化氧化剂调节氧化度的方法可满足后期碱液吸收的需要。
2.2 碱液吸收机理
常用的质量浓度为10~100 g/L的各种碱液吸收NOx反应活性相对值比较如下:KOH(1.0)>NaOH(0.84)>Ca(OH)2(0.80)>Na2CO3(0.78)>K2CO3(0.63)>NaHCO3(0.51)>KHCO3(0.44)>CaCO3(0.39)。
KOH吸收液虽然反应活性相对值最高,因其价高货源少,所以使用的较少,实际广泛应用的吸收剂主要是Na2CO3和NaOH。
NaOH吸收NOx的总反应式为:
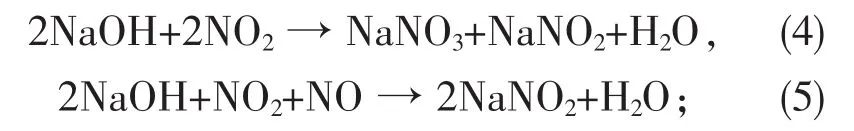
Na2CO3吸收NOx的总反应式为:

采用Na2CO3吸收NOx的效果不如NaOH,原因是Na2CO3的质量分数降至1.5%~5.0%时,吸收效果急剧下降,而NaOH无此效应;另外,Na2CO3吸收时产生的CO2将降低NOx特别是N2O3在溶液中的溶解度。因此,碱液中实际应用最多的是NaOH。影响碱液吸收NOx脱除率的主要因素是碱液含量和NOx氧化度。
2.2.1 NOx氧化度对NOx脱除率的影响
利用高硅Na-ZSM-5分子筛作为催化氧化剂调节氧化度的方法可满足后期碱液吸收的需要。为了进一步提高碱液对NOx的脱除率,考察了30℃下、NO的摩尔分数为0.055%时、NaOH的质量分数为1%、RH为50%湿气、空时为0.15 min下,进口NOx氧化度对碱液脱除NO、NO2和NOx的影响,结果见图2。

从图2中可以看出,随着NOx氧化度的增加,碱溶液对NO的脱除率不断上升,当氧化度大于60%时,NO的脱除率基本保持在63%左右;对NO2的脱除率在氧化度大于40%后逐渐下降,当氧化度为50%~80%之间时,碱液对NOx的脱除率最高,可达60%以上。
对于出现这个结果的原因,Thomas等认为当氧化度低时,NO的低溶解性使得脱除率较低,氧化度较高时,NO2和N2O4的水解为控制步骤,而氧化度处于中间状态时,气相中N2O3含量较高,N2O3与水反应生成亚硝酸,亚硝酸对NOx脱除起着重要的作用,碱液与亚硝酸的中和反应会使脱除率极大提高[14]。童志权等认为NO2溶解度低于N2O3溶解度,因此NO与NO2反应生成N2O3会提高NOx的脱除率[15]。
由此也可看出,控制氧化过程中NOx的氧化度是提高碱液对NOx脱除率的关键。因此实验中控制NOx氧化度为60%,考察碱液含量对NOx脱除率影响。2.2.2 碱液含量对NOx脱除率的影响
控制NO进口的摩尔分数为0.055%、OD为60%、温度30℃、湿气RH为50%、空时为0.15 min,考察了碱液含量对NOx脱除率的影响,结果见图3。
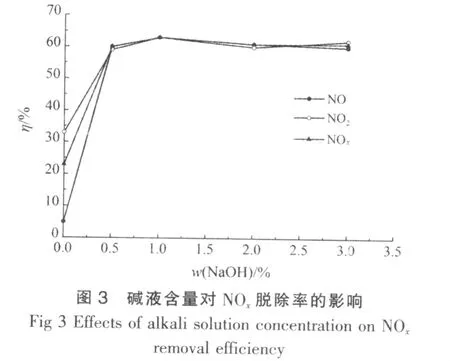
由图3可知,随着碱液含量的增加,开始脱除率急剧增加,当NaOH的质量分数大于1%时,脱除率变化不大,仍在60%~63%。这是因为NaOH的质量分数低于1%时,OH-的数量相比于溶液中反应生成HNO2和HNO3数量较少,溶液中仍存在大量HNO2和HNO3。随着OH-数量的增加,消耗的HNO2和HNO3数量也增加,因此NOx脱除率增加。当NaOH的质量分数达到1%时,OH-含量已经足够用来中和反应生成的HNO2和HNO3。因此当NaOH的质量分数大于1%时,脱除率变化不大。因此在后续实验中选取NaOH的质量分数为1%的NaOH溶液作进一步研究。
由此也可以看出,实际应用中碱液可多次循环利用,当NaNO2和NaNO3累积到一定浓度时作为副产物析出,以提高经济效益。
2.2.3 空时对NOx脱除率的影响
控制NO进口摩尔分数为0.055%、OD为60%、温度30℃、NaOH的质量分数为1%、RH为50%,考察空时对NOx脱除率的影响,结果见表1。
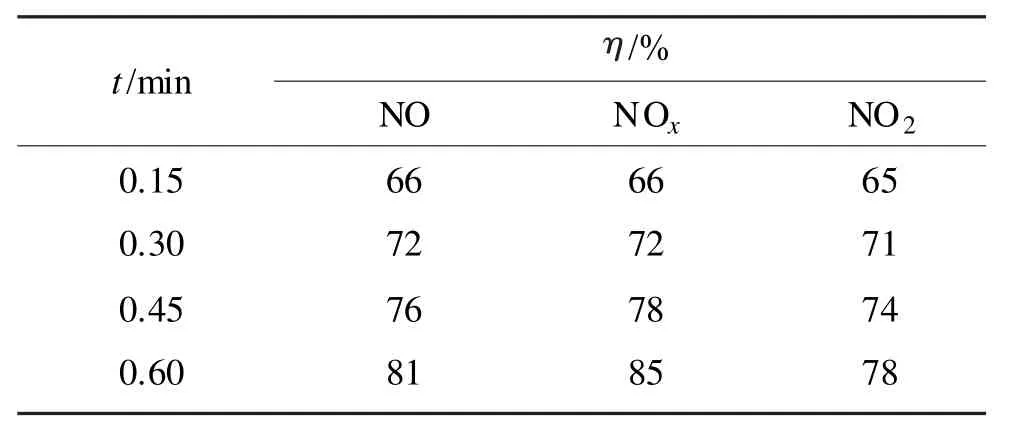
表1 碱液中空时对NOx脱除率的影响Tab 1 Effects of space time on NOxremoval efficiency
表 1 显示,随着空时的增加,NO、NO2、NOx脱除率都显著提高。虽然NO难溶于碱液,但此时氧化度为 60%,通常认为,x(NO2)/x(NO)为 1~1.3(即氧化度为50%~56%)时,吸收速率最大,此时吸收效率最高,这是因为NO与NO2反应生成了溶解度较大的N2O3,因此NO脱除率得到提高[15]。空时增加,NO、NO2与碱液的接触时间增加,反应(4)和(5)的反应时间增长,因此NO、NO2、NOx脱除率都显著提高。
2.3 还原碱液的吸收
2.3.1 不同吸收液对NOx脱除率的影响
实验通过向碱液中加入还原剂,比较了3种常见还原剂的碱性溶液对NOx的脱除率,具体结果见表2。

表2 不同吸收液对NOx脱除率的影响Tab 2 Effects of the additives in NaOH solution on NOx removal efficiency
由表2可以看出,不同吸收液对NOx的脱除优劣顺序为 Na2S2O3>(NH4)2SO3>NaOH≈CO(NH2)2。还原性碱液中,尿素几乎没有起到作用;硫代硫酸钠对NO2脱除效果较好,可以达到99%,而对NO脱除效果不好;亚硫酸铵虽然对NO和NO2都有较好的脱除作用,但是反应开始时对NO脱除效果不好,小于10%,反应一段时间后才显现出对NO的作用。
对CO(NH2)2-碱液而言,可能它的还原性较弱,不足以与NO2优先作用,在溶液中对NO脱除主要还是以N2O3进行,但在反应时间相同的情况下,NO的低水溶性使得CO(NH2)2-碱液并没有显示出其优越性。Na2S2O3还原剂的加入抑制了NO的脱除可能是因为NO2极易与还原剂作用生成氮气而被脱除,使得以3价氮(N2O3)形式被脱除的NO2较少,同样以N2O3形式被脱除的NO量也降低,而NO本身的低水溶性使得它在还原性碱液中的脱除率较低。(NH4)2SO3的加入需经过一段时间才显现出对NO、NO2和NOx的脱除效果,可能是因为溶液中对NO脱除主要还是以N2O3进行,但由于NO的水溶性很差,造成反应速率很慢。因此选取质量分数分别为1%的NaOH和1%的Na2S2O3还原性碱液进一步考察空时对NOx脱除率的影响。
2.3.2 空时对NOx脱除率的影响
控制NO进口摩尔分数为0.055%、OD为60%、温度30℃、NaOH和Na2S2O3的质量分数分别为1%和1%、RH为50%,考察空时对NOx脱除率的影响,结果见表3。

表3 还原性碱液中空时对NOx脱除率的影响Tab 3 Effects of space time on NOxremoval efficiency.in reductive alkali solution
由表3可以看出,相对NO2的脱除率而言,随着空时增加,还原性碱液对NO的脱除影响明显。1%NaOH+1%Na2S2O3还原性碱液对NO的脱除率经过一段时间后略微增加,这可能是因为NO的水溶性很差,造成反应速率很慢。但继续增加空时,NO脱除率变化不大,可能是NO的溶解度已达到饱和。增加空时对NO2脱除率无作用,这是因为还原性溶液主要对NO2起作用,且脱除效果非常好,已达98%,再增加空时则无必要,NO因其难溶性抑制了其反应。
3 结论
针对工业NOx废气氧化度低、氧气及水汽含量高的特点,提出以高硅Na-ZSM-5分子筛为催化剂的催化氧化-碱液吸收-还原性碱液吸收的多级组合工艺脱除NOx的方法。并对该工艺的主要影响因素进行了较系统的研究。结果表明:
1)NOx氧化度为60%时,NaOH溶液对NOx的脱除率可达到63%,NOx脱除率受碱液含量影响不大,随着空时的增加而增加。NaOH和Na2S2O3的质量分数分别为1%和1%还原性碱液对NOx脱除率为75%,NaOH和(NH4)2SO3的质量分数分别为1%和1%的还原性碱液对NOx脱除率为70%。
2)无论是利用碱液还是还原性碱液吸收工业废气中的NOx,都需要提高氧化度,因而NO催化氧化是关键。高硅Na-ZSM-5分子筛对湿气下NO氧化具有较好的催化活性,空时为0.5 s时,干气下NOx氧化度达到65%,湿气下仍能达到56%,且随空时增加而增加。当空时高于0.5 s时完全可满足后续碱液吸收对氧化度的要求。
3)NOx多级组合处理工艺为NOx废气→NO氧化→碱液吸收→还原性碱液吸收。碱液吸收部分可回收NaNO2和NaNO3,还原性碱液吸收进一步提高NOx脱除率。通过优化操作条件,该组合工艺可实现NOx的有效脱除与达标排放。
[1]Pradhan M P,Joshi J B.Absorption of NOxgases in plate column:Selective manufacture of sodium nitrite[J].Chem Eng Sci,2000,55(7):1269-1282.
[2]张丽,张敬志.硝酸尾气中氮氧化物含量的分析研究[J].河北化工,2007,30(5):64-65.
[3]王瑾,周玉林.硝酸尾气中NOx测定方法的探讨[J].中氮肥,2006(4):61-63.
[4]Streets D G,Waldhoff S T.Present and future emissions of air pollutants in China:SO2,NOxand CO[J].Atmos Environ,2000,34(3):363-374.
[5]Sada E,Kumazawa H,Takada Y.Chemical reaction accompanying absorption of nitric oxide into aqueous mixed solutions of iron(II)-EDTA and sodium sulfite[J].Ind Eng Chem Fundam,1984,23(1):60-64.
[6]Sada E,Kumazawa H,Hikosaka H.A Kinetic study of absorption of nitrogen oxide(NO)into aqueous solutions of sodium sulfite with added iron(II)-EDTA chelate[J].Ind Eng Chem Fundam,1986,25(3):386-390.
[7]Littlejohn D,Chang S G.Reaction of ferrous chelate nitrosyl complexes with sulfite and bisul-fite ions[J].Ind Eng Chem Fundam,1990,29(1):10-14.
[8]Gambardella F,Ganzeveld I J,Winkelman J G M,et al.Kinetics of the reaction of FeII(EDTA)with oxygen in aque ous solutions[J].Ind Eng Chem Res,2005,44(22):8190-8198.
[9]Van der Maas P,Van de Sandt T,Klapwijk B,et al.Biological reduction of nitric oxide in aqueous Fe(II)EDTA solutions[J].Biotechnol Prog,2003,19(4):1323-1328.
[10]马乐凡,童志权,张俊丰.液相络合-铁粉还原-酸吸收回收法脱除烟气中NOx的机理研究[J].环境科学学报,2005,25(5):637-642.
[11]Patwardhan J A,Pradhan M P,Joshi J B.Simulation of NOxgas absorption under adiabatic condition and comparison with plant data[J].Chem Eng Sci,2002,57(22/23):4831-4844.
[12]刘华彦,张泽凯,徐媛媛,等.高硅Na-ZSM-5分子筛表面NO的常温吸附-氧化机理[J].催化学报,2010,31(10):1233-1241.
[13]李玉芳,刘华彦,黄海凤,等.疏水型H-ZSM-5分子筛上NO氧化反应的研究[J].中国环境科学,2009,29(5):469-473.
[14]Thomas D,Vanderschuren J.Nitrogen Oxides Scrubbing with Alkaline Solutions[J].Chem Eng Technol,2000,23(5):449-455.
[15]童志权.工业废气净化与利用[M].北京:化学工业出版社,2001:301-302.
Abstract:In the paper,OMIU Sulfate content was analyzed by HPLC.The result shows that as the sample dosage of OMIU sulfate and chloroacetic acid is 20~160 μg and 3.75~30 μg respectively,the sample dosage and peak area equation show good linearity,recoveries reaches to 100.1%,deviation of relative standard 0.38%.The method is suitable for OMIU sulfate analysis for its simpleness,speediness and sensitiveness.
Abstract:OMIU Sulfate;chloroacetic acid;HPLC
Improvement on the Technology of Azodicarbonamide Clean Production
Zheng Tuying1、2,Chen Lijin2
(1.Chemical Engineering and Materials Science College of Zhejiang University of Technology,Hangzhou 310014;(2.Electrochemical Plant of Zhejiang Juhua Co.,Ltd,Quzhou,Zhejiang 324004)
The article introduces the production process of azodicarbonamide,describes major source of pollution in azodicarbonamide production,and analysis the sewage data on aggregate.Methods,such as increasing automatic control level of hydrazine hydrate synthesis,removing the sodium carbonate from crude hydrazine by calcium chloride method,using new centrifuges to achieve separation of washing liquid from crude liquor,and so on,were proposed to reduce pollutant emissions from the source of pollution production.The improved technology can increase the concentration of hydrazine hydrate by 5g/L,reduce the concentration of crude liquor containing sulfuric acid sodium and the difficulty level of wastewater treatment.The wastewater from azodicarbonamide oxidating can be recycled completely.
Abstract:azodicarbonamide production;pollutant sources;technical improvements
The Study of Security Management of Hazardous Chemicals Pilot Scale Experiment
Li Huiyue1,Tao Zhaoxia2
(1.Innuovo Electrolysis Chemical Co.,Ltd.,Hengdian Group,Dongyang Zhejiang 322118;2.Zhejiang Tager Safe Technology Co.,Ltd,Hangzhou 310017)
Abstract:This paper analyses the characteristics of hazardous chemicals and the provision from the government of security management of pilot scale experiment.It raises a conclusion that companies can control security risks and prevent accidents by risk estimate,project testing,contingency plans by the experts and implementation of management check.
Abstract:hazardous chemicals;pilot scale experiment;security management
Analyze OMIU Sulfate Content by HPLC
Wang Jue1,2,Mao Xiaozhao3,Mo Weimin2
(1.Zhejiang Chemical Technical School,Quzhou,Zhejiang 324000;2.Zhejiang University of Technology,Hangzhou 310014;3.Juhua Group Technology,Quzhou,Zhejiang 324004)
X781.3
ADOI10.3969/j.issn.1006-6829.2011.03.015
2011-03-23;
2011-04-13
