骨形成蛋白Ⅱ型突变受体基因转染对口腔鳞癌细胞增殖和凋亡的影响
2011-12-06傅升吕红兵刘源何黎升樊丽娜金岩
傅升 吕红兵 刘源 何黎升 樊丽娜 金岩
骨形成蛋白(bone morphogenetic proteins,BMPs)家族成员都是通过结合两种丝或苏氨酸激酶受体(即 BMPsⅠ型、Ⅱ型受体)发挥作用的,Ⅰ型、Ⅱ型受体与配体结合形成异聚体,从而将BMPs信号传递给下游作用物[1-3]。目前已发现BMPs对靶细胞的生长、分化以及凋亡具有调控作用,此外还发现BMPs不仅与部分骨源性肿瘤的发生发展有密切关系,而且与部分涎腺肿瘤、胃癌以及前列腺癌等生物行为有关[4-6],但对BMPs与鳞癌的发生、发展及转移的关系尚不清楚。
为分析和认识BMPs与鳞癌的发生、发展及转移的可能关系,本研究将首次观察BMPs在口腔鳞癌(舌癌细胞系Tca8113细胞)中的表达以及BMPⅡ突变受体基因转染对口腔鳞癌生长的影响,这将有助于深入认识口腔上皮恶变的机理,为今后应用生物技术对口腔鳞癌进行有效治疗提供实验依据。
材料和方法
一、材料
Tca8113细胞由第四军医大学口腔医学院生物实验室提供。FuGENE6 Transfection Reagent Kit、 DIG-DNA labelling and detection kit、BrdU 检测试剂盒为 Boehringer Mannbeim公司产品。Pc-4质粒为含有BMPsⅡ型突变受体cDNA(cDNA由日本KaWaSaKi医学院分子生物所的Nohno教授提供)的真核表达载体。流式细胞仪:Coulter Epics Elite ESP。MTT为美国Sigma公司产品。Cyclin D1、p27单抗及CDK4、p57多抗购自美国Santa Cruz公司,LSAB增强性广谱型免疫组化试剂盒购自丹麦 Dako公司。
二、方法
1.Tca8113细胞培养:用含10﹪胎牛血清的RPMI1640培养液,在37℃、5﹪CO2、饱和湿度下培养,3 d换液1次,传代3~4次使细胞达到良好的生长状态。
2.BMPsⅡ型突变受体基因的转染和鉴定:按试剂盒说明书进行操作和转染后的鉴定。
3.原位杂交:按试剂盒说明书进行标准化的检测。阴性对照用PBS代替探针,用Tca8113细胞培养方法进行培养。
4.MTT 检测:在96孔板上以4×103的密度接种前述两组细胞。培养3 d后,每孔加入MTT(5 mg/ml )20μl,继续培养 4 h,吸弃上清,加入 150μl DMSO 振荡 15min,用酶联免疫检测仪测定490 nm的吸光度(A)值。
5.BrdU 检测:实验前1d接种前述两组细胞到放有玻片的培养板中,每种细胞接种10个玻片。到实验时细胞密度50﹪~80﹪。吸弃培养液,加入含0.01﹪BrdU的培养液,继续培养1h,取出细胞爬片用抗-BrdU单抗检测,计数阳性细胞。
6.流式细胞仪( flow cytometry,FCM)检测:取细胞5×105,离心半径10 cm,800 r/min,离心5min,弃上清,用PBS洗2次,70﹪乙醇固定,4℃过夜。上机前离心去除乙醇,PBS洗2次,加入溴化丙锭染液1ml,4℃闭光染色30min,上机检测分析。
7.凋亡细胞的TUNEL法染色:细胞爬片经Triton-100处理后,PBS振洗5min,共3次,平衡Buffer 1min,TdT酶37℃孵育1h后,中止Buffer 1min,BufferⅠ、BufferⅡ依次充分洗涤。2﹪正常羊血清封闭30min后,滴加抗标记碱性磷酸酶地高辛抗体(1:150),37℃孵育2h后,BufferⅠ、BufferⅢ充分洗涤,NBT/BCIP暗处显色2h,TE中止反应,甲基绿复染,常规脱水透明封片。凋亡的阳性信号为位于细胞核中的蓝黑着色。每个标本均取不相重复的高倍视野,共计数500个细胞核,由此获得凋亡指数(apoptosis index,AI)=凋亡细胞/所有记数细胞。
8.免疫组化检测Tca8113、tBRII-Tca8113细胞中CyclinD1、CDK-4、p27和p57的表达和定量分析:按标准化的免疫组化方法进行染色,阴性对照用PBS代替一抗,其他同前。Cyclin D1与 CDK4 在细胞中的阳性信号均为覆盖胞核、胞质的棕黄色颗粒,p27和p57的阳性信号为胞浆着色。用免疫组化定量系统,对正常组和实验组进行测量,每次测量前,都以统一的空白片作标准,调整系统光度值,设定标准灰度,在同一灰度条件下,避开无细胞的区域,每张切片选择5个不同的视野,用鼠标按细胞的形态画出细胞轮廓,自动测量,选平均灰度为测量指标,放大倍数为400倍。系统设定白色最大灰度为256,黑色最小灰度为0。因此,灰度值越小,代表其阳性反映程度越高。
三、统计学分析
采用SPSS17.0软件进行统计学分析,加药前后A值差异用配对t检验,tBRII-Tca8113和Tca8113两组BrdU和灰度差异用比较采用独立t检验,以P < 0.05为差异有统计学意义。
结 果
一、细胞克隆
转染细胞经G-418筛选,2周后得到抗G-418的阳性细胞克隆,而未转染细胞在含G-418的培养液中逐渐全部死亡,初步证明BMPsⅡ型突变受体基因的转染成功(图1)。
二、neo 基因的原位杂交
在转染细胞的胞桨中有蓝色颗粒样阳性杂交信号(图2),进一步证明BMPsⅡ型突变受体基因的转染Tca8113细胞成功,并有BMPsⅡ型突变受体mRNA的表达,未转染细胞未见阳性信号。
三、MTT 检测
转染 BMPsⅡ型突变受体后,tBRII-Tca8113 细胞增殖活力变慢,与Tca8113细胞相比较差异具有统计学意义(见表1,图3)。
四、BrdU 检测
结果显示,转染 BMPsⅡ型突变受体后,与 Tca8113细胞(12.0±3.4)相比 ,tBRIITca8113细胞(23.0±1.9)DNA合成变慢,细胞增殖力下降,两者比较差异具有统计学意义(t=8.3013,P=0.000,表 2,图 3)。
五、细胞周期分析
tBRII-Tca8113 细胞与Tca8113细胞相比,反应细胞增殖活力的增殖指数PrI为9.1和14.7(见表3,图3),结果与MTT检测一致。
图1 转染后细胞克隆(倒置显微镜)(×100)
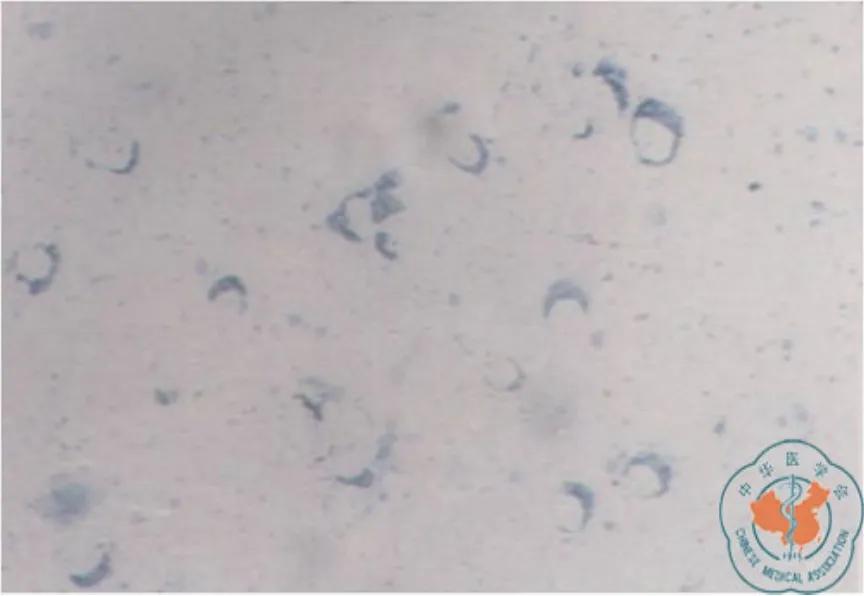
图2 neo基因的原位杂交,提示在转染的细胞中有蓝色颗粒阳性杂交信号(×100)
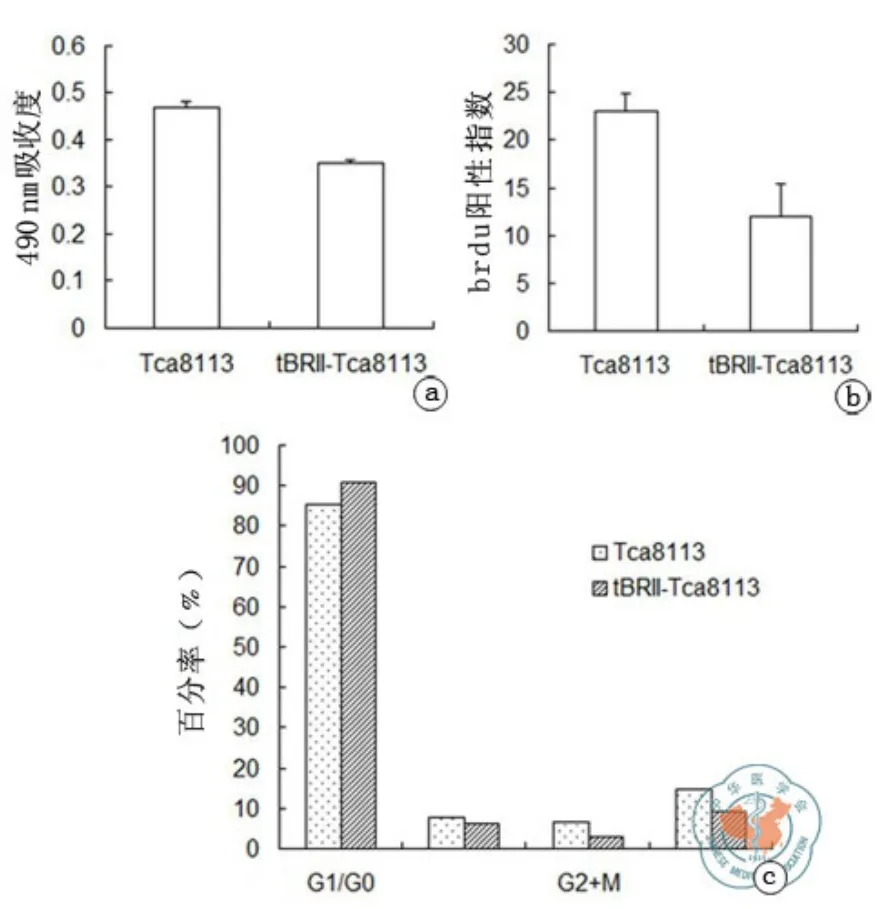
图3 MTT,BrdU,FCM分析结果
六、凋亡分析结果
转染后tBRII-Tca8113细胞中的凋亡数目明显增加,两者之间的凋亡指数(3.7±1.2,8.7±1.6)比较差异具有统计学意义(t=7.906,P=0.000,见图 4)。
七、Cyclin D1、CDK4 、p27 和p57 表达的定量结果
Cyclin D1、CDK4 、p27和p57 的免疫组化染色结果(图5~8)。用图像分析系统对Cyclin D1、CDK4、p27和p57的表达进行平均灰度的测量,两者之间各种细胞周期蛋白的表达差异具有统计学意义(见表4,图9)。

表3 tBRII-Tca8113细胞与Tca8113细胞 FCM 分析结果
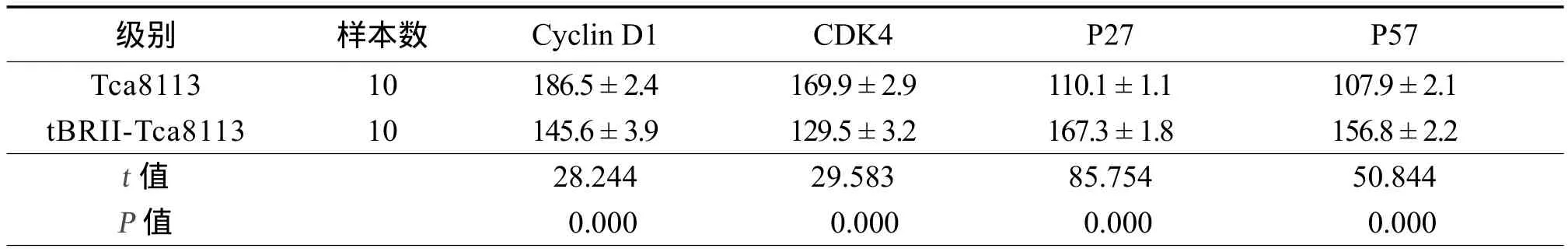
表4 CyclinD1、CDK4、p27、P57 的灰度测量值比较
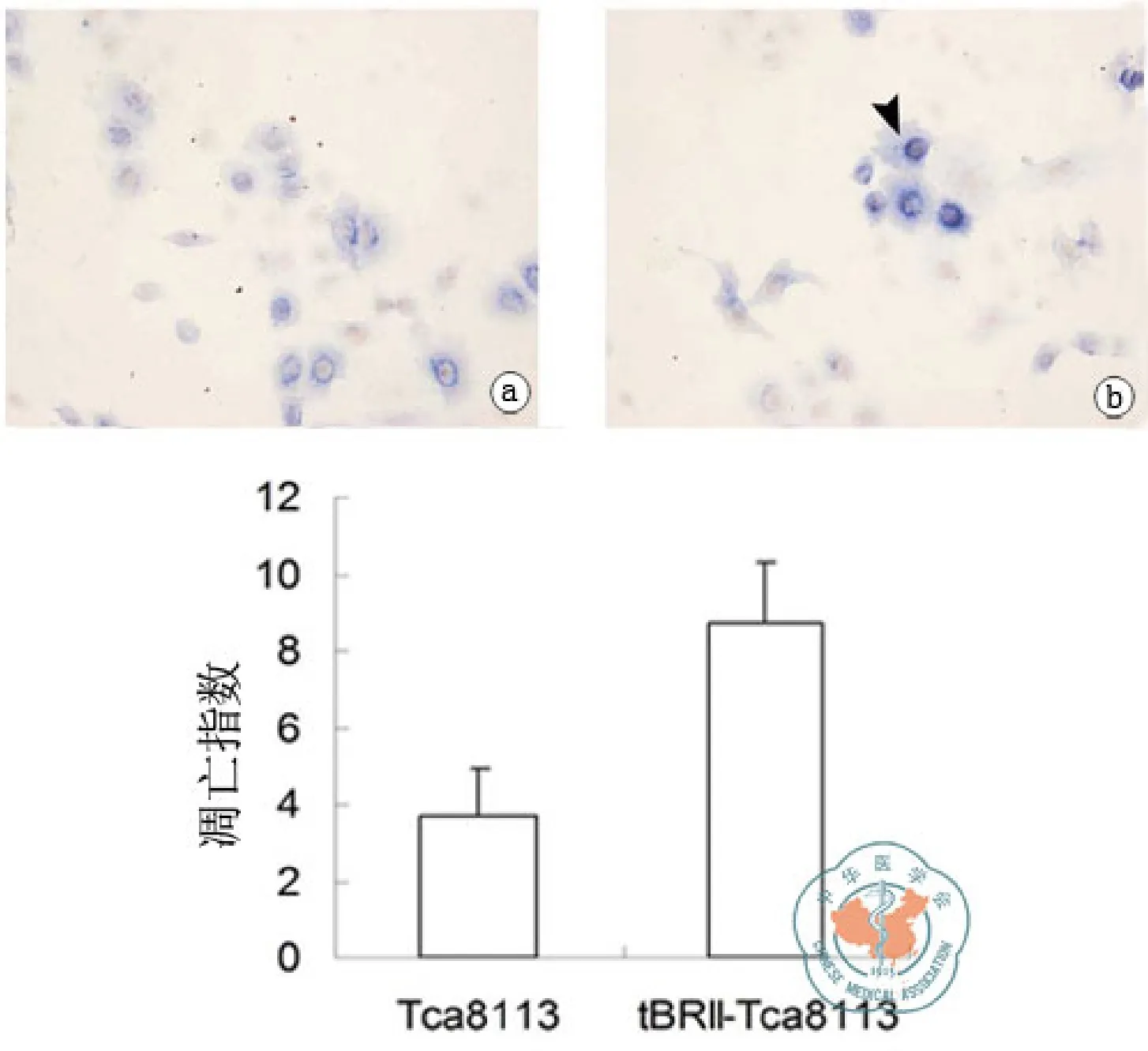
图4 转染前后凋亡染色结果和凋亡的指数直方图
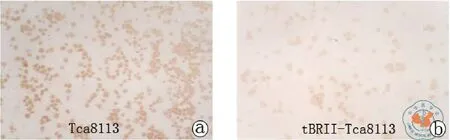
图5 CyclinD1免疫组化染色结果(免疫组化染色×100)
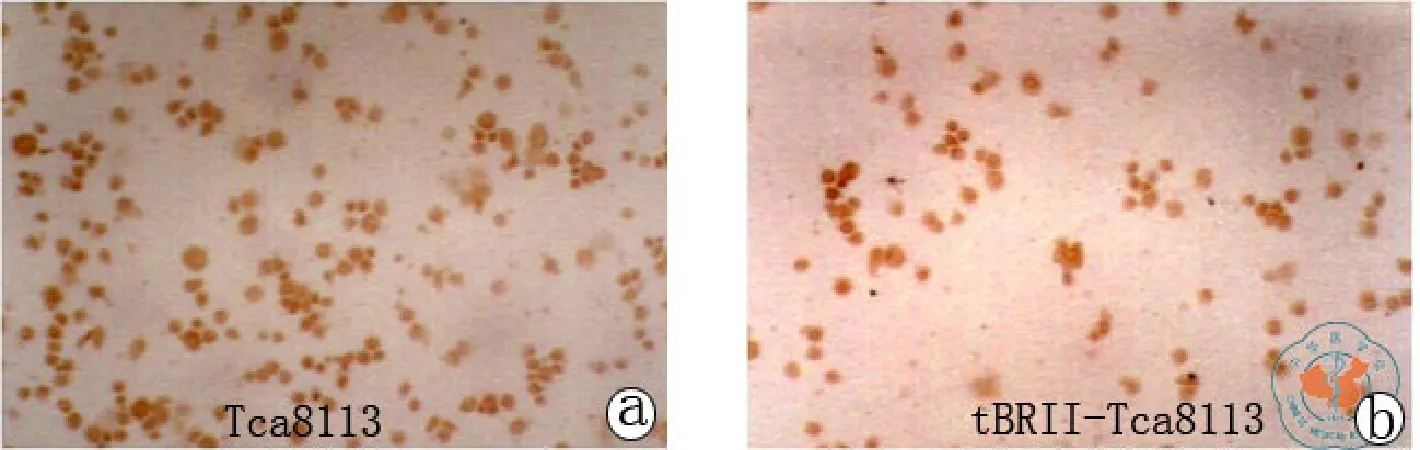
图6 Tca8113细胞与 tBRII-Tca8113细胞Cyclin D1表达比较(免疫组化染色×100)
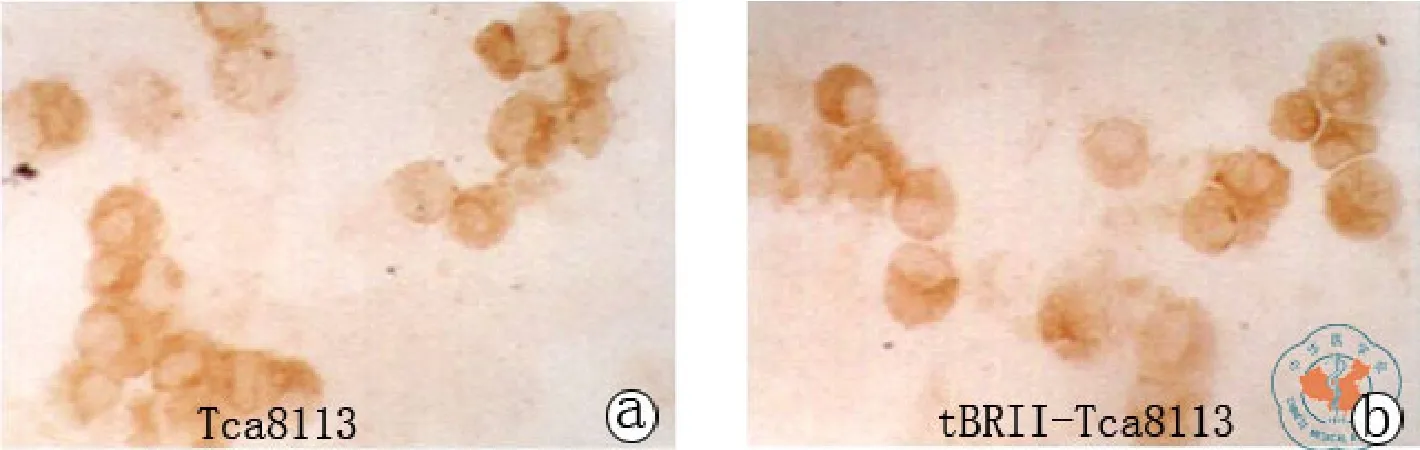
图7 p27免疫组化染色结果(免疫组化染色×400)

图8 p57免疫组化染色结果(免疫组化染色×400)
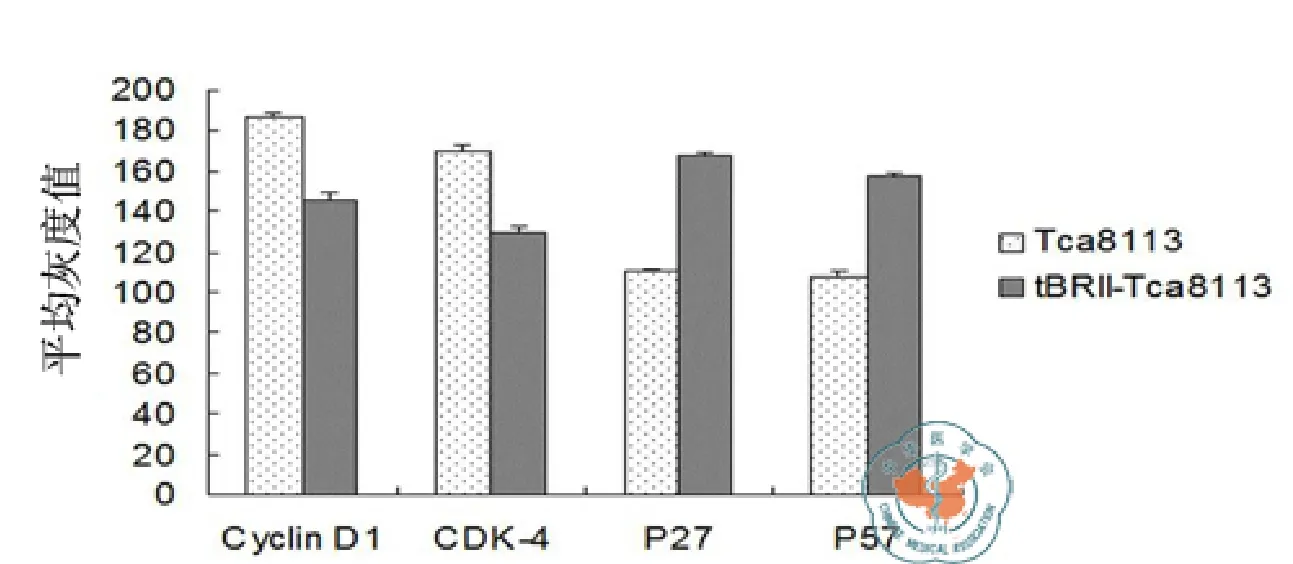
图9 Cyclin D1、CDK4、p27和p57在Tca8113和tBRII-Tca8113细胞中的平均灰度测量值
讨 论
Heikinheimo等[3]研究正常涎腺组织中 BMP-6 的表达发现,在成人颌下腺的腺泡细胞中有BMP-6 的低表达,而其他类型的细胞则无表达;BMP-6 在腮腺和颌下腺的浆液性腺泡细胞中有特异性免疫定位点。Yang等[7]于1993较早观察并证实了 BMPs在涎腺多形性腺瘤中的表达,并认为其表达可能与多形性腺瘤中的软骨样组织的形成有关。Harris等[8]发现 BMP-6不仅在正常的前列腺中表达,而且在前列腺癌中出现高表达,认为可能与前列腺组织具有异位成骨的能力有关。上述肿瘤性上皮细胞出现的 BMPs 表达,作者都认为可能与这些肿瘤组织中的骨、软骨样组织形成有关。除此之外,BMPs是否参与了对上皮组织恶变的调控,这种调控是由于BMPs基因突变所至,还是由于其他因素导致 BMPs 信号表达水平的改变,目前尚未得出明确结论。本研究以 BMPsⅡ型突变受体基因为目的基因,以 Tca8113 细胞(人舌鳞癌细胞)为载体细胞,建立稳定表达 BMPsⅡ型突变受体的 Tca8113 细胞,以便进一步从信号转导水平探讨 BMPs 信号表达水平的改变和 BMPs 基因突变在口腔上皮组织恶变和口腔鳞癌发生发展过程中的作用。
本研究中转染 BMPsⅡ突变受体的 Tca8113 细胞,通过 G-418 筛选,初步确认了表达突变受体的细胞克隆;再用 neo 基因检测,进一步证实了转染的成功。这表明转染 BMPsⅡ突变受体的 Tca8113 细胞已被建立,也进一步表明 Tca8113 细胞是 BMPs 的靶细胞,BMPs 及其受体可能在口腔上皮组织的恶变过程中有重要作用。我们将转染成功的 Tca8113 细胞命名为 tBRII-Tca8113 细胞。
转染前后稳定表达 BMPsⅡ型突变受体的 tBRII-Tca8113 细胞和Tca8113 细胞相比,形态未见明显变化,但是通过 MTT、流式细胞仪及反应细胞 DNA 增殖水平的 BrdU 检测,我们发现转染后,细胞的增殖活力明显下降。转染 BMPsⅡ型突变受体后,细胞内的 BMPs 信号分子的表达被阻断,同时细胞的增殖出现下降,两者间有何相关性,以往的相关研究显示,BMPs 信号表达水平在口腔鳞癌组织中较口腔正常上皮组织有明显增强,结合本实验的结果推断 BMPs 信号表达水平的改变在上皮细胞的恶变过程中起着相当的促进作用,而不仅仅是由于其他因素导致 BMPs 信号表达水平的改变。
细胞周期是细胞生命活动的基本过程,细胞在周期时相的变迁中进入增殖、分化、衰老和死亡等生理状态。对细胞周期调控的研究使人们认识到,细胞周期失控是癌变的重要原因[9]。细胞周期的调控机制十分复杂,主要受到3类因子的调控,即细胞周期蛋白(cyclins)、细胞周期蛋白依赖性激酶(cyclin dependent kinases,CDKs)和细胞周期蛋白依赖性激酶的抑制蛋白(cyclin dependent kinase inhibitors,CKIs)组成,其中细胞周期蛋白是调节亚基,CDKs是催化亚基,在调控细胞周期的进程中,常暂时结合形成复合物而发挥作用,CKIs是近年来刚分离得到的一类很重要的细胞周期的负性调控蛋白,这些蛋白在体外通过与CDKs、cyclins或cyclin-cdks复合物结合达到抑制CDK催化外源性底物的活性。目前已知的细胞周期蛋白和CDKs包括 cyclinsA,B1-2,C,D1-3,E,F,G,H和CDKs1-7[10-11]。而CKIs可分为两个族 :第一族包括p15、p16、p18 、p19,这些蛋白内包含独特的四次锚蛋白结构(这个名称有无错误需咨询);第二族包括p21、p27、p57,它们在氨基N端有显著的序列同源性,均有一个广谱的cyclin-cdks复合物作用位点[11-12]。正常情况下,Cyclin D1在G1期是恒定的,其过量表达可导致G1期缩短,细胞分裂速度加快。对肝细胞癌、胃肠癌、子宫内膜癌、肺癌、骨肿瘤的研究表明,Cyclin D1在这些肿瘤中均有过量的表达[10]。
Cyclin D1和CDK4在肿瘤细胞的细胞周期循环发生障碍,Cyclin D1表达产物的堆积将使肿瘤细胞的G1期缩短,引起细胞的过度增殖。本研究显示,转染了突变受体的口腔舌癌细胞tBRII-Tca8113中Cyclin D1和CDK4的表达均显著低于正常的 Tca8113 细胞,此外,细胞周期复性调控蛋白p27和p57的表达高于正常的Tca8113细胞。该结果与前述研究4项吻合,表明转染了 BMPsⅡ型突变受体后,BMPs信号转导水平的改变与细胞周期相关因子的表达有较强的相关性。即转染了 BMPsⅡ型突变受体后,肿瘤细胞的增殖显著减弱,表明BMPs信号的表达在口腔舌癌细胞的恶性变化中起着重要作用。此外,在tBRII-Tca8113细胞中凋亡的表达与Tca8113细胞相比增强,BMPs信号的改变影响了癌细胞中凋亡机制的表达,细胞的恶性程度发生了改变。
BMPs信号的表达在口腔舌癌的恶性变化中起着重要作用,本研究结果有可能对口腔舌癌的基因治疗提供新的思路。
1 Mishina Y,Suzuki A,Golbent DJ,et al.Genomic Organization and chromosomal location of the mouse type I BMP-2/4 receptor[J].Biochem Biophys Res Commun,1995,206(1): 310-317.
2 Grijelmo C,Rodrigue C,Svrcek M,et al.Proinvasive activity of BMP-7 through SMAD4/src-independent and ERK/Rac/JNK-dependent signaling pathways in colon cancer cells[J].Cell Signal,2007,19(8):1722-1732.
3 Kim IY,Lee DH,Lee DK,et al.Restoration of bone morphogenetic protein receptor type II expression leads to a decreased rate of tumor growth in bladder transitional cell carcinoma cell line TSU-Pr1[J].Cancer Res,2004,64(20):7355-7360.
4 Jin Y,Yang LJ.The relationship between bone morphogenetic protein and neoplastic bone diseases[J].Clin Orthop Relat Res,1990,259(257):233-238.
5 Heikinheimo AK,Laine MA,Ritvos OV,et al.Bone morphogenetic protein 6 is acinar cell differentiation in normal and neoplastic human salivary gland[J].Cancer Res,1999,59(22):5815-5821.
6 Harris SE,Harris MA,Mahy P,et al.Expression of bone morphogenetic protein messenger RNAs normal rat and human prostate and cancer cells[J].Prostate,1994,24(4):204-211.
7 Yang LJ,Jin Y,Nakamine H,et al.An immunohistochemical study of bone morphogenetic protein in pleomorphic adenoma of the salivary gland[J].Virchows Arch A Pathol Anat Histopathol,1993,422(6): 439-443.
8 Harris SE,Harris MA ,Mahy P,et al.Expression of bone morphogenetic protein messenger RNAs normal rat and human prostate and cancer cells[J].Prostate,1994,24(4): 204-211.
9 Malumbres M,Barbacid M.Cell cycle,CDKs and cancer: a changing paradigm.Nature,2009,9(3):153-166.
10 Landis MW,Pawlyk BS,Li T,et al.Cyclin D1-dependent kinase activity in murine development and mammary tumorigenesis.Cancer Cell,2006,9(1):13-22.
11 Besson A,Hwang HC,Cicero S,et al.Discovery of an oncogenic activity in p27Kip1 that causes stem cell expansion and a multiple tumor phenotype[J].Genes Dev,2007,21(14):1731-1746.
12 Walkley CR,Fero ML,Chien WM,et al.Negative cell-cycle regulators cooperatively control self-renewal and differentiation of haematopoietic stem cells[J].Nat Cell Biol,2005,7(2):172-178.
