不同方法分离的成人睾丸支持细胞与胰岛共移植的效果对比
2011-12-06李杨薛武军田晓辉宋焕瑾宋勇丁小明冯新顺丁晨光
李杨 薛武军 田晓辉 宋焕瑾 宋勇 丁小明 冯新顺 丁晨光
睾丸支持细胞(sertoli cell)是曲细精管内惟一的体细胞,具有为生精细胞提供支架、营养、激素转化、屏障隔离和吞噬的作用,对睾丸功能及精子发生至关重要[1]。近年随着基础研究的逐渐深入,越来越多的资料表明,Sertoli 细胞是睾丸产生免疫豁免的功能细胞[2],Saporta等[3]将猪和大鼠的 Sertoli 细胞分别移植入大鼠大脑后发现 Sertoli 细胞至少可以存活2个月而不需要环孢素A。从而认为 Sertoli 细胞可以在睾丸以外的移植部位产生足够的免疫抑制效应而不需额外的免疫抑制治疗。此外,Sertoli 细胞免疫原性较低,还能分泌多种免疫保护因子和营养因子,促进周围细胞的生长[4-6],降低移植术后的免疫排斥反应[7]。Sertoli 细胞的功能研究已拓展到器官移植的领域,近年来,有学者将支持细胞与胰岛体外共培养或者共同移植,能够改善胰岛功能,降低免疫排斥反应,延长移植物存活[8-9]。随着胰岛移植技术的开展,对 Sertoli 细胞的需求越来越高,而目前对 Sertoli 细胞的分离尚无统一的方法。国内外对 Sertoli 细胞的研究大多采用未成熟的啮齿动物作原代培养,而且方法复杂、繁琐,对成人 Setoli 细胞的报道很少,近年来仅有滕琰等[10]报道成人睾丸 Sertoli 细胞的分离。本研究拟用不同的方法对成人睾丸 Sertoli 细胞进行分离和纯化,并观察其与胰岛共移植的效果,以寻求一种简便、快捷和高效的 Sertoli 细胞分离的方法。
材料和方法
一、材料
睾丸和胰腺组织取自志愿捐赠的成年男性尸体,共 10例,年龄25~35岁,无相关疾病的病史。0~4℃用无菌离体器官保存液(HCA)保存运输,热缺血时间<15min,冷缺血时间 3~8h。BALB/C小鼠由西安交通大学医学院动物实验中心提供。胰蛋白酶、胶原酶V、透明质酸酶及 DNA 酶Ⅰ均为Sigma公司产品。DMEM /F12和RPMI-1640液体培养基均为美国Gibco公司产品,特级胎牛血清为美国Hyclone公司产品。小鼠抗人波形蛋白(Vimentin)单克隆抗体为美国Santa cruz公司产品。SABC 检测试剂盒为武汉博士德公司产品。FITC标记的鼠抗人FasL单克隆抗体为ABCOM公司产品。
二、睾丸支持细胞的分离纯化
用 4 ℃ 的 Hank 液冲洗睾丸,去除被膜及血管,再以眼科镊挑出生精小管,尽量剥除生精小管周围的间质组织并剪碎,将睾丸组织随机分为3组,每组睾丸组织质量相同。A组:2.5 g/L 胰蛋白酶、5 g/L 胶原酶V、1 g/L 透明质酸酶和0.4 g/L DNA酶于37℃恒温水浴箱消化30min,含10﹪胎牛血清的DMEM/F12培养基终止消化,用 4 ℃ 的 Hank 液洗涤3 遍,离心去上清液。B组:2.5 g/L 胰蛋白酶和0.4 g/L DNA酶I于37℃恒温水浴箱消化30min,冷Hank液洗涤3遍,离心去上清液,5 g/L 胶原酶Ⅴ于37℃恒温水浴箱中消化20min、冷 Hank液洗涤 3 遍,离心去上清液, 1.5 g/L 胶原酶 V、1 g/L 透明质酸酶 37 ℃ 消化 20min,含 100ml/L 胎牛血清的 DMEM/F12 培养基终止消化,100目的筛网过滤后,无血清DMEM/F12培养基洗涤3次后,离心去上清液。C组:2.5 g/L胰蛋白酶、0.4 g/L DNA酶I于37℃水浴消化15min,含100ml/L胎牛血清的DMEM/F12培养基终止胰酶反应,离心去上清液,1 g/L透明质酸酶37℃水浴消化30min,无血清培养基洗涤 2次,离心去上清液,5 g/L 胶原酶Ⅴ于37℃水浴消化 20min,含100ml/L胎牛血清的 DMEM/F12培养基终止消化,100目的筛网过滤,无血清DMEM/F12 培养基洗涤3次后,离心去上清液。上述3组分离方法所得的沉淀物均重悬于含 200ml/L 胎牛血清的 DMEM/F12 培养基中,于39℃、50ml/L CO2培养箱中孵 48h。更换培养液,于相同条件下继续孵育 8h 后,更换无血清的培养液。20mmol/L Tris-HCl 缓冲液( pH 7.0 )对细胞进行 5min 的低渗处理,最后于37℃、50ml/L CO2培养箱中培养,隔天换液。
三、睾丸支持细胞的鉴定
1.倒置相差显微镜下观察其形态学特征:将培养的 Sertoli 细胞定期在倒置相差显微镜下观察其形态、大小等特征,估算其在培养细胞中所占的比例。
2.电子显微镜下观察其超微结构:Sertoli 细胞纯化后体外培养 48h,0.25﹪胰酶消化后收集培养的 Sertoli 细胞,2.5﹪戊二醛固定液预固定、锇酸后固定、脱水、包埋、半薄切片定位和超薄切片等步骤后,在透射电子显微镜下观察其超微结构,进行鉴定。
3.免疫组化染色:80﹪冰丙酮固定 Sertoli 细胞爬片,用SABC免疫细胞化学染色法检测支持细胞上波形蛋白的表达。
四、睾丸支持细胞的活性检测
分别于培养后 3、7、14、21 和28 d,取细胞密度为 5×105个 /ml 的细胞悬液 0.5ml,加入MTT应用液0.5ml,于37℃水浴中孵育4 h,离心去上清液,加入异丙醇剧烈震荡,使管底部的紫色沉淀完全溶解后,离心半径7.5 cm,2000 r/min离心5min,收集上清液,于波长570 nm以DMEM /F12培养液调零比色,测定吸光度(A)值。
五、睾丸支持细胞纯度的测定
将培养 3 d 后的 Sertoli 细胞,用2.5 g/L胰蛋白酶消化细胞,离心收集细胞,调整细胞密度为1×106/ml,加入FasL-FITC流式抗体作用15min,流式细胞仪检测FasL(+)细胞数。
六、胰岛的分离纯化
采用半自动灌注过滤法用1.5 g/L的胶原酶Ⅴ消化胰腺,采用cobe2991细胞分离仪,通过连续密度梯度离心的方法进行胰岛的纯化。分离和纯化的胰岛悬浮于含100ml/L胎牛血清的RPMI1640培养基,于37℃、50ml/L CO2培养箱中培养,隔天换液。
七、糖尿病鼠模型胰岛与睾丸支持细胞共移植
BALB/C小鼠禁食 20 h,不禁水,新鲜配制的链脲霉素自尾静脉注入,给药剂量为250 mg/kg。注入前及注入后每天尾静脉取血,测定血糖浓度。当血糖浓度连续≥20.0mmol/L超过 5 d,即可作为成功的糖尿病模型。糖尿病模型鼠随机分为4组,每组6只,将胰岛和Setoli 细胞按下面的实验设计方法移植到糖尿病鼠的肾包膜下。A组:胰岛和方法A分离的 Sertoli 细胞联合移植到肾包膜下。B组:胰岛和方法B分离的 Sertoli 细胞联合移植到肾包膜下。C组:胰岛和方法C分离的 Sertoli 细胞联合移植到肾包膜下。D组:单独移植胰岛到肾包膜下。移植术前先用2.5 g/L胰酶消化后收集培养的 Sertoli 细胞,调整细胞浓度至5×106个/ml,同时选取1000 IEQ胰岛用于移植。糖尿病模型鼠按40 mg/kg的剂量进行戊巴比妥钠腹腔内注射麻醉。麻醉满意后,采用无菌操作程序打开腹腔找到左右肾脏,浸有生理盐水的敷料垫起肾下极,无菌注射器针尖将肾上极的包膜挑起,先注入少量空气使肾包膜鼓起1个小包,再将移植的细胞置入注射器内推入肾包膜内。烧灼封闭肾包膜的刺口,关腹。移植次日起尾静脉采血测定血糖浓度。以血糖浓度≤11.1mmol/L,持续2 d以上作为移植物功能存活的标准;以血糖浓度≥20.0mmol/L并超过3 d,作为移植物被排斥、功能丧失的指标。记录血糖第1次升高的时间作为移植物存活时间。
八、统计学处理
使用SPSS 11.5软件分析处理,采用t检验和Fisher精确概率法检验比较各组间差异,胰岛移植术后对胰岛移植效果进行Kaplan-Meier生存分析和log-rank检验。以P < 0.05为差异有统计学意义。
结 果
一、睾丸支持细胞的鉴定
培养 48h后,倒置相差显微镜下可见 Sertoli 细胞完全贴壁生长,胞体增大呈多角形,大多有3个以上的突起。细胞质中脂滴含量丰富,可见吞噬的小颗粒状物质。细胞核清晰可见,位于胞体中央或稍偏位,呈圆形或椭圆形,其长轴方向与细胞的方向一致(图1,2)。
波形蛋白免疫组化染色结果显示:Sertoli 细胞免疫化学染Vimentin呈阳性反应。Vimentin呈棕黄色分布,由核周的细胞质呈辐射状向四周胞膜伸展,直到细胞膜(图3,4)。
透射电镜下观察可见: Sertoli 细胞胞质为中等密度的基质,含有丰富的线粒体、高尔基体、粗面和滑面内质网以及溶酶体、分泌颗粒、较多的脂肪颗粒和包涵物。胞质中尚有许多微管和微丝,呈束状与细胞长轴平行。Sertoli 细胞的细胞核多呈卵圆形,伴有核膜不规则的皱褶或小凹,核孔在皱褶内,核内常染色质丰富,缺乏同源染色质的周围块。胞核最突出的特征是具有明显的核仁和其周围的卫星核小体(图5)。
二、不同方法分离的睾丸支持细胞的活性比较
3种方法分离的 Sertoli 细胞培养 28 d 的活性变化如图6所示。应用方法A和B分离的
Sertoli 细胞,在体外培养 7 d 时细胞活性最高,以后随培养时间的延长而逐渐下降,B组的细胞活性在体外培养3 d时与A组差异无统计学意义(t=0.26,P=0.80),但是B组的细胞活性在体外培养 7、14、21和28 d时均明显高于A组(t’=2.89,P < 0.05;t=4.02,P=0.00;t=2.77,P=0.01;t=3.09,P=0.00);应用方法C分离的 Sertoli 细胞,在体外培养 14 d时细胞活性最高,而体外培养3和7 d时细胞活性明显低于A组和B组(t=2.97,2.36,P=0.00,0.03;t=3.05,8.89,P=0.00,),但 14、21、28 d时细胞活性与 A组差异无统计学意义(t’=0.52,P > 0.05;t=0.32,P=0.75;t=1.03,P=0.32),但明显低于B组 ( t’=2.88,P < 0.05 ;t=3.05,P=0.00 ;t=3.83,P=0.00)。
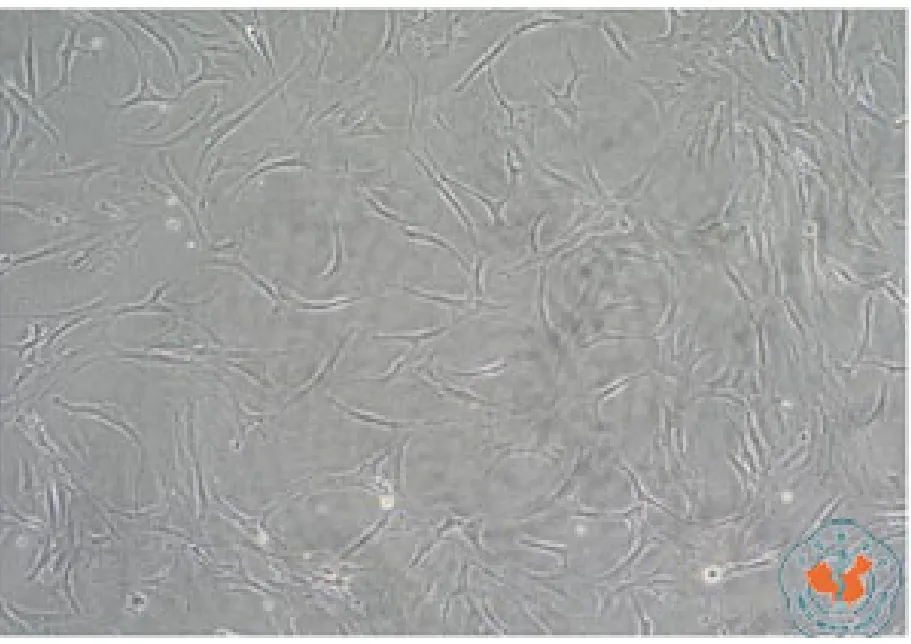
图1 Sertoli 细胞体外培养48h(×100)
图2 Sertoli 细胞体外培养48h(×200)

图3 体外培养的 Sertoli 细胞波形蛋白表达阳性(免疫组化染色×100)

图4 体外培养的 Sertoli 细胞波形蛋白表达阳性(免疫组化染色×400)

图5 透射电镜下的 Sertoli 细胞(免疫组化染色×8000)
三、不同方法分离的睾丸支持细胞的纯度比较
流式细胞仪检测FasL(+)细胞数的结果显示:应用3种不同的方法分离的 Sertoli 细胞的纯度分别为(85.17±1.8)﹪、(92.33±2.5)﹪和(93.12±2.6)﹪,B组和C组的细胞纯度均明显高于A组(t=7.35,P < 0.00;t=7.95,P < 0.00),B组和C组的细胞纯度差异无统计学意义(t=0.69,P=0.50)。
四、移植胰岛的生存分析
对不同组的胰岛移植术后观察 28 d,结果表明D组单独移植的胰岛平均生存时间为(5±0.7)d,A组和C组移植术后胰岛的平均存活时间分别为(11±1.3) d和(19±2.6) d,而B组胰岛移植术后出现截尾值2例(即在观察时间结束时2例终止事件尚未发生)。经log-rank检验,各组平均存活时间差异均有统计学意义(F=165.548,P=0.000, 图7)。
讨 论
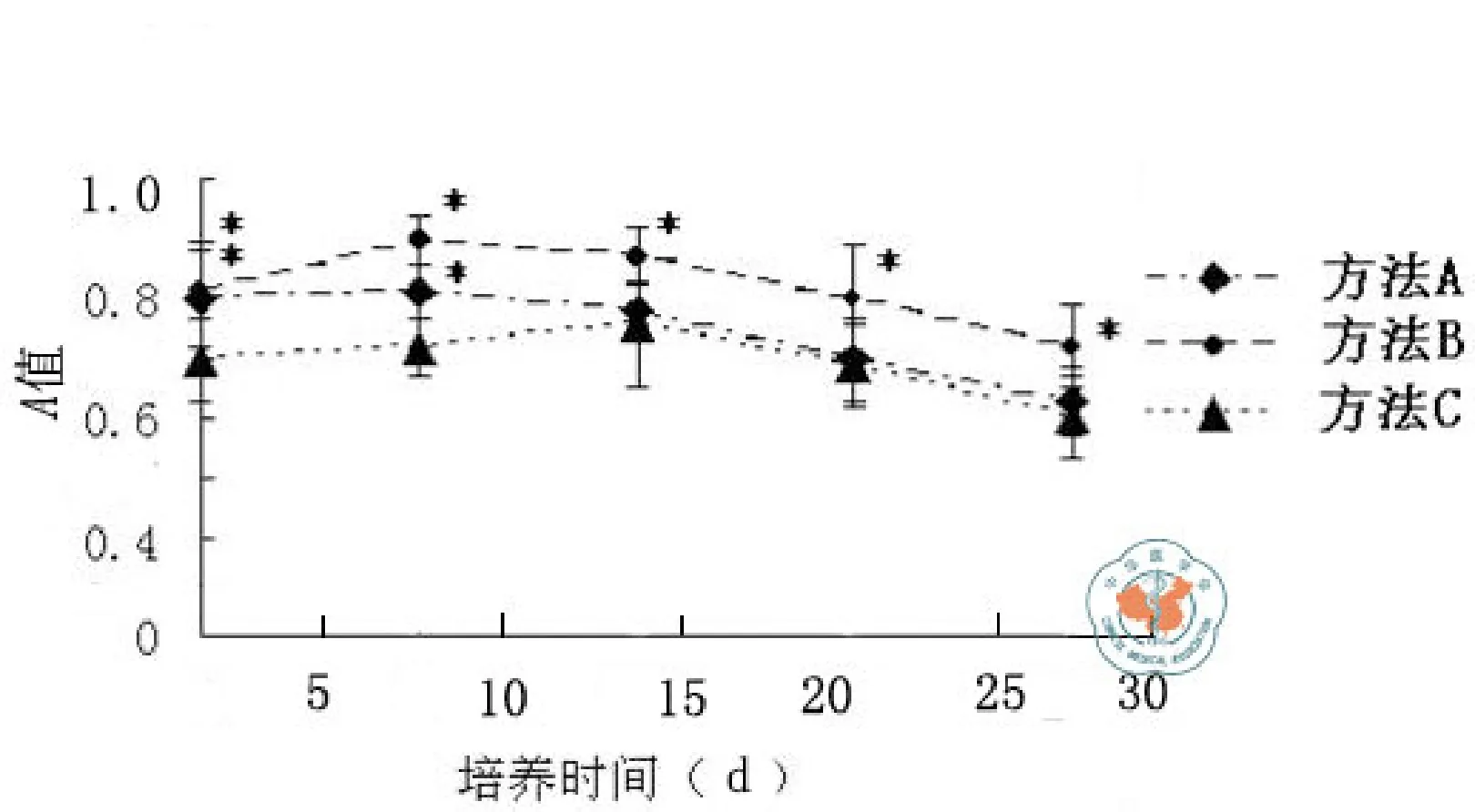
图6 不同方法分离的 Sertoli 细胞的活性比较
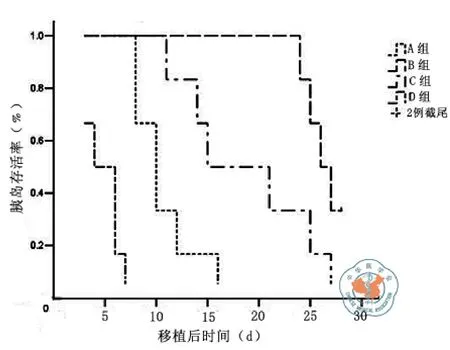
图7 A、B、C、D四组胰岛移植生存分析
研究表明,将表达FasL的 Sertoli 细胞与移植物共移植科显著延长移植物在体内的存活时间[11-12]。构建胰岛移植中免疫豁免环境的关键是分离出高活性和高数量的 Sertoli 细胞与胰岛共移植。目前使用的大多是从睾丸组织中分离出的原代 Sertoli 细胞,由于Sertoli 细胞在青春期发育过程中即停止分裂,细胞数相对较少,成年动物睾丸的结构更为复杂,生精细胞占绝大多数。因此目前研究人员大多采用未成年的个体,再将结果推延至成熟个体[13],而且分离方法均较复杂繁琐,操作步骤多,所需时间长,Sertoli 细胞的纯度也只达到了80﹪[10],而且成熟和未成熟细胞功能之间也存在差异[14]。因此建立一种简单有效Sertoli 细胞分离培养方法迫在眉睫。
目前采用的分离方法,主要是通过使用不同的消化酶对睾丸进行消化,然后对消化产物进行一系列处理而将Sertoli 细胞分离出来。但目前的研究报道对所用酶的浓度及使用的先后顺序、消化的时间等条件没有统一的标准。本研究在参考了国内外有关培养动物支持细胞的基础上,总结选择了最常见3种消化分离的方法进行分离效果的对比,它们的消化酶的种类和浓度均相同,只是消化酶使用的次序有所不同。形态学和免疫组化鉴定结果显示,3种方法分离出的细胞方法均能分离一定的数量和纯度的Sertoli 细胞,但存在一定的差异,且本实验结果显示,不同的分离方法对细胞活性有显著的影响。三步法由于消化的步骤多,细胞受到消化酶较长时间的作用而发生损伤,因此,分离得到的细胞活性较差,需要较长时间的恢复,恢复的程度有限,故活性最低而且峰值延迟。而一步法虽然消化步骤最少,时间最短,但是分离得到的细胞中,除了 Sertoli 细胞外,还有其他许多细胞,如生精细胞等,这些细胞会相互影响,从而降低的他们的活性。而两步法在消化步骤和消化时间上比较适中,先采用胰酶和DNA酶消化细胞间粘蛋白及糖蛋白,使细胞分离,再使用胶原酶和透明脂酸酶去除平滑肌样细胞,并将大部分的曲细精管消化开,获得的Sertoli 细胞纯度也比较高,其他杂质较少,这可能是其活性最高的原因。流式细胞仪对FasL(+)细胞数量检测同样显示,一步法获得的 Sertoli 细胞纯度最低,而两步法和三步法分离出的 Sertoli 细胞纯度相当,但都高于一步法。因此,较低的细胞纯度可能是一步法分离的Sertoli 细胞活性下降的原因,而三步法分离出的 Sertoli 细胞纯度虽然也比较高,但是由于细胞受损伤较严重,活性比较差,而两步消化法分离出的Sertoli 在活性和纯度两方面均能达到较高的水平。
不同的Sertoli 细胞活性和纯度导致其与胰岛共移植至糖尿病鼠后,产生不同的存活情况。两步法分离的Sertoli 细胞活性最好,而且纯度也比较高,与胰岛共移植术后能够快速发挥其免疫豁免和营养支持作用,胰岛移植物的存活时间最长;三步法分离的Sertoli 细胞活性较差,与胰岛共移植以后不能很好的发挥免疫豁免作用;一步法分离的Sertoli 细胞活纯度较低,含有一些具有免疫原性的其它细胞,与胰岛共移植以后,其他的细胞的免疫原性会激活受体的免疫应答。所以这两种方法分离的Sertoli 细胞与胰岛共移植术后,虽然胰岛移植物的的存活时间较单纯的胰岛移植有一定程度的延长,但是都明显短于两步法分离出来的 Sertoli 细胞与胰岛共移植术后的胰岛移植物的存活时间。
总之,体内、体外实验证明,采用胰蛋白酶+DNA酶和胶原酶+透明脂酸酶的两步消化法分离得到的 Sertoli 细胞活性和纯度都较高,这样的细胞与胰岛共移植至糖尿病鼠模型后,对胰岛移植物存活的延长效果更佳。
1 Griswold MD.The central role of Sertoli cells in spermatogenesis[J].Semin Cell Dev Biol,1998,9(4): 411-416.
2 Hutloff A,Dittrich AM,Beier KC,et al.ICOS is an inducible T-cell co-stimulator structurally and functionally related to CD28[J].Nature,1999,397(6716): 263-266.
3 Saporta S,Cameron DF,Borlongan CV,et al.Survival of rat and porcine Sertoli cell transplants in the rat striatum without cyclosporine-A immunosuppression[J].Exp Neurol,1997,146(2): 299-304.
4 Othberg AI,Willing AE,Cameron DF,et al.Trophic effect of porcine Sertoli cells on rat and human ventral mesencephalic cells and hNT neurons in vitro[J].Cell Transplant,1998,7(2):157-164.
5 上官芳芳,史小林.睾丸支持细胞促进体外培养神经元生长的研究[J].解剖学报,2003,34(5):510-513.
6 Boulogne B,Habert R,Levacher C.Regulation of the proliferation of cocultured gonocytes and Sertoli cells by retinoids,triiodothyronine,and intracellular signaling factor: differences between fetal and neonatal cells[J].Mol Reprod Dev,2003,65(2):194-203.
7 Emcridi DF,Sanbcrg PR.Novel means to selectively identify Sertoli cell transplant[J].Cell Transplant,2002,11(6):495-497.
8 Teng Y,Xue WJ,Ding XM,et al.Isolation and culture of adult Sertoli cells and their effects on the function of co-cultured allogeneic islets in vitro[J].Chin Med J,2005,118(22): 1857-1862.
9 蔡世荣,詹文华,马晋平,等.大鼠胰岛与睾丸细胞共移植诱导同种胰岛移植免疫豁免[J].中华内分泌代谢杂志,2001,17 (1): 148-151.
10 滕琰,薛武军,冯新顺,等.成人睾丸支持细胞的分离培养及其免疫豁免机制[J].细胞与分子免疫学杂志,2005,21(5): 643-649.
11 Emerich DF,Hemendinger R,Halberstadt CR.The testicular-derived Sertoli cell: cellular immunoscience to enable transplantation[J].Cell Transplant,2003,12(4):335-349.
12 Halberstadt C,Emerich DF,Gores P.Use of Sertoli cell transplants to provide local immunoprotection for tissue grafts[J].Expert Opin Biol Ther,2004,4(6):813-823
13 Valdes GR,Silva TL,Ramirez GB,et al.Method for evaluating quality of cultured neonatal pig Sertoli cells[J].Xenotransplantation,2005,12(4): 316-323.
14 Anway MD,Folmer J,Wright WW,et al.Isolation of Sertoli cells from adult rat testes: an approach to ex vivo studies of Sertoli cell function[J].Biol Reprod,2003,68(3): 996-1002.
