供体胰腺保存方法的改进
2011-12-06董维平蔡锦全谭建明王煜非王鉴波彭永德
董维平 蔡锦全 谭建明 王煜非 王鉴波 彭永德
糖尿病是严重危害人类健康的三大主要疾病之一,外源性胰岛素替代疗法虽能延缓糖尿病的发展,延长患者的生存期,但不能阻止糖尿病并发症的发生和发展,胰岛细胞移植是一种替代胰腺内分泌功能的生理途径[1]。目前胰岛分离技术尚不成熟,往往需要2个或以上同血型的胰腺才能分离出1次移植所需要的胰岛数量[2],因而造成供体胰腺的严重紧缺。目前的供胰来源常为多器官捐献者,在摘取其他器官时难免会伤及胰腺,由于胰腺组织一旦破损,受损的腺泡细胞会释放胰蛋白酶原及其他消化酶原,对胰岛有明显的破坏作用,这更加剧了供体不足的矛盾。因此,我们尝试在胰腺保存液中添加胰蛋白酶抑制剂,预防胰蛋白酶对胰岛的破坏作用,使破损的胰腺也能用于分离胰岛,从而扩大供胰的来源,提高供体胰腺的质量。
材料与方法
一、材料
(一)胰腺来源
经我院伦理委员会批准、自愿捐献的成人尸体胰腺。
(二)试剂
组织分散酶(Liberase HI,瑞士Roche公司),胰蛋白酶抑制剂(乌司他丁,瑞士Roche公司),威斯康辛大学保存液(UW液,美国Bristol-Myers Squibb公司),全氟萘烷(PFC,美国FluoroMed公司),双硫腙(DTZ,Sigma公司),丫啶橙(AO,Sigma公司),碘丙啶(PI,Sigma公司),胰岛素检测ELISA试剂盒(DSL公司)。
二、方法
(一)供胰摘取及运送
采用腹部大十字切口,开腹后先从腹主动脉下段插入双腔气囊导尿管,插至腹腔动脉上方充气阻断胸主动脉,4℃离体肾保存液( HC-A液)灌注,然后从肠系膜上静脉插管,4℃ HC-A液灌注。开始灌注后迅速从下腔静脉放血,并剪开胸腔阻断肝上下腔静脉。HC-A 液快速灌注排去肝、胰、肾和十二指肠内血液后改为4℃UW 液灌注,同时用无菌盐水碎冰块置于腹腔内加速降温。灌注UW液后迅速将肝、脾、十二指肠和双肾整块切取。胰腺摘取后置4℃UW/PFC双层保养液,于冰浴中保存运输。根据胰腺的情况,分为:对照组(连十二指肠一起摘取)、完整组(原位分离十二指肠和结扎胰管后摘取)和破损组(切除部分胰头组织后摘取胰腺)。完整组与破损组的UW保养液中添加乌司他丁。
(二)胰腺鉴定
取出胰腺后,取保存胰腺的UW液检测淀粉酶浓度,以检验胰腺受损程度。
(三)胰岛分离纯化、计数及活率鉴定
胰岛细胞的分离纯化按我们以前报道的方法进行[3],纯化后用含1﹪(V / V )人血清白蛋白的RPMI 1640离心洗涤2次,取样DTZ染色后进行胰岛计数,并按公式换算为相当于直径150 μm的胰岛当量(islets equivalent quantity,IEQ) ;AO / PI双色荧光染色,鉴定胰岛的活率[4]。
(四)胰岛功能检测
纯化、洗涤后的胰岛用含1﹪人血清白蛋白的1066培养液,37℃,95﹪空气,5﹪CO2培养过夜,收集后用无糖1640培养液洗2次,均分于3支离心管中,离心半径17cm,1000 r/min离心1min后弃上清,加含1﹪人血清白蛋白的低糖1640培养液(2.8mmol/L葡萄糖),37℃培养2h,换1﹪人血清白蛋白的高糖1640培养液(含16.7mmol/L葡萄糖),37℃培养2h,收集培养液测胰岛素含量,计算释放指数(高糖胰岛素含量/低糖胰岛素含量),取3管的均数。
三、统计学处理
应用SPSS 10.5进行统计学处理,淀粉酶含量和胰岛消化分离结果指标及胰岛功能和活力指标以表示,著性检验采用完全随机的F 检验,P < 0.05为差异有统计学意义。
结 果
一、乌司他丁对胰腺的保护作用
保存胰腺的UW液中淀粉酶的含量各组间比较差异无统计学意义(表1)。
二、胰岛得率、纯度和活率
胰腺经Liberase HI消化分离,胰岛纯化后,各组的胰岛得率、纯度和活率的差异均无统计学意义(表1)。
三、胰岛功能和活力检测
各组的低糖、高糖胰岛素含量和释放指数差异均无统计学意义(表2)。
表1 各组淀粉酶含量和胰岛消化分离结果的比较( )
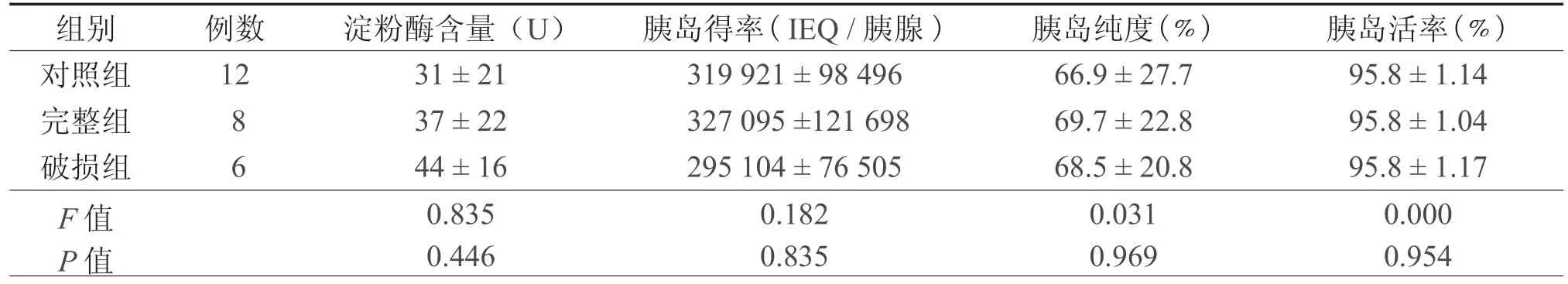
表1 各组淀粉酶含量和胰岛消化分离结果的比较( )
组别 例数 淀粉酶含量(U) 胰岛得率( IEQ / 胰腺 ) 胰岛纯度(﹪) 胰岛活率(﹪)对照组 12 31±21 319921±98496 66.9±27.7 95.8±1.14完整组 8 37±22 327095±121698 69.7±22.8 95.8±1.04破损组 6 44±16 295104±76505 68.5±20.8 95.8±1.17 F 值 0.835 0.182 0.031 0.000 P 值 0.446 0.835 0.969 0.954
表2 各组胰岛功能和活力比较( )
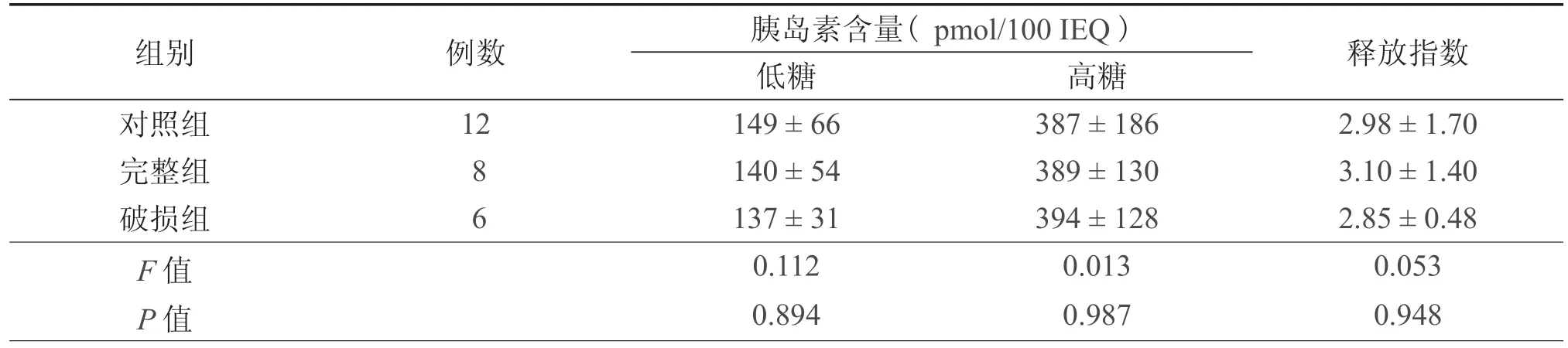
表2 各组胰岛功能和活力比较( )
组别 例数 胰岛素含量( pmol/100 IEQ ) 释放指数低糖 高糖对照组 12 149±66 387±186 2.98±1.70完整组 8 140±54 389±130 3.10±1.40破损组 6 137±31 394±128 2.85±0.48 F 值 0.112 0.013 0.053 P 值 0.894 0.987 0.948
讨 论
消化液的充分灌注是胰岛分离成功的一个关键因素[5]。因此,必须保证灌注前胰腺的完整。最近的证据已经证实,胰岛得率的不一致,与尸体胰内生酶的激活有关[6],大量研究证明内生胰酶的释放对胰岛起伤害作用[7-11]。Krause等[12]的实验亦证明胰蛋白酶有损坏胰岛膜的作用,由于胰岛散在分布于胰腺的腺泡实质中,仅占整个胰腺的1﹪~2﹪,在分离和摘取胰腺过程中,如果伤及胰腺就会引起腺泡细胞的破坏,胰蛋白酶原及其它消化酶原自破坏的腺泡细胞中释放出来。胰蛋白酶原具有激活自身的能力,使胰蛋白酶原转变为有活性的胰蛋白酶,胰蛋白酶又可以迅速地激活其它的胰蛋白酶原和其他的许多酶原,引起一系列酶促反应的“爆发”。胰蛋白酶除直接对胰岛组织有破坏作用外,还可以激活磷脂酶A2,将卵磷脂和脑磷脂转变为具有很强的细胞毒作用的溶血卵磷脂和溶血脑磷脂,使细胞和组织发生坏死。因此,为了保持胰腺的完整和防止因腺泡细胞破坏导致的内生胰酶释放,目前进行胰岛分离的胰腺都采用带十二指肠摘取。由于供体胰腺大多来源于多器官供体的尸体,带十二指肠取胰必须剪断肠管,极易造成供体器官的污染。在分离和摘取其它器官时,也难免碰伤胰腺组织,造成供体器官的浪费。如果在胰岛的分离前加入胰蛋白酶抑制剂,防止受损胰腺胰蛋白酶和磷脂酶被过早过量激活,可大大提高胰腺的质量和利用率。由于添加了胰蛋白酶抑制剂,保存液中检测胰蛋白酶浓度的意义不大。因此,我们用保存液中的淀粉酶浓度来比较各组胰腺的受损程度。
乌司他丁主要通过与胰蛋白酶分子结合后使胰蛋白酶失活,从而抑制已激活的胰蛋白酶的活性,并进而避免大量胰蛋白酶原及其他一些消化酶原被过早激活;该药还能同时独立抑制胰蛋白酶、糜蛋白酶、透明质酸酶、纤溶酶、弹性蛋白酶和羧基肽酶等多种酶的活性,并具有稳定溶酶体膜的功能,从而抑制溶酶体酶的释放,这是防止胰岛组织被裂解破坏的重要保护措施之一。在UW-PFC双层保存方法(two-layer method,TLM)的基础上,在UW液中添加乌司他丁抑制胰蛋白酶的活性,用以保存破损的胰腺。对照组和破损组的各项指标对比,结果对照组、完整组和破损组的UW液中淀粉酶含量的差异比较均没有统计学意义;胰腺消化分离的胰岛得率、纯度和功能与对照组比较亦无统计学意义的差异。表明乌司他丁能有效的抑制受损胰腺释放出的胰蛋白酶,对供体胰腺起到了保护的作用(表1)。
本组资料应用乌司他丁的完整组、破损组与对照组比较,胰岛素释放试验的低糖、高糖和释放指数的差异都没有统计学意义,表明乌司他丁对胰岛的功能没有影响。在目前的研究中Pefabloc [4- (2-氨基乙烷)氟氢氯酸苯] 、STI (大豆胰蛋白酶抑制剂) 等具有抑制胰蛋白酶功能的制剂被应用于胰岛提取中。但Lu等[13]研究数据显示,STI对新鲜或经低温保存的大鼠胰腺的胰岛得率没有影响。Pefabloc 被认为是一种有效的丝氨酸蛋白酶抑制剂,可以减弱胰蛋白酶的活性,保护胰岛细胞[7,14]。Matsumoto等[15]在双层保存液中添加 Pefabloc后,延长了胰腺的保存时间和改进了胰岛活力的恢复。但 Pefabloc 是一种不可逆性的胰蛋白酶抑制剂,至今仍只在实验研究中应用,目前还没有实验证明可用于临床。乌司他丁作为一种成品药已应用于临床,因此有理由相信此方法为一种更为有效的胰腺保存方法。
本组资料结果表明,乌司他丁能有效的抑制低温保存的成人胰腺内生酶的激活,且对胰岛的功能没有影响。Goto等[16]应用颜料溶液(Metyltioninklorid)和组织胶水(Indermil)检测和修补漏洞,使破损胰腺也能用于分离胰岛。如果在此基础上,应用我们改进的胰腺保存方法,将大大提高供体胰腺的利用率。因此,在双层保存液中添加乌司他丁:(1)使受损胰腺也能用于分离胰岛,增加了供胰的来源;(2)可分离十二指肠后取胰,减少供体器官被污染的机会;(3)作为已在临床使用的蛋白酶抑制剂,比Pefabloc更适用于供体胰腺的保存。
1 Ricordi C,Tzakis AG,Carroll PB,et al.Human islet isolation and allotransplantation in 22 consecutive cases[J].Transplantation,1992,53(2):407-414.
2 Shapiro AM,Lakey JR,Ryan EA,et al.Islet transpla- ntation in seven patients with type 1diabetes mellitus using a glucocorticoid-free immunosuppressive regimen[J].N Engl J Med,2000,343(4):230-238.
3 董维平,陈向峰,彭永德,等.降低成人胰岛免疫原性的研究[J].中华器官移植杂志,2006,27(3):145-148.
4 董维平,张洪德,王煜非,等.胰岛移植物质量鉴定方法的研究[J].中华器官移植杂志,1998,19(4):205-207.
5 Lakey JR,Warnock GL,Shapiro AM,et al.Intraductal collagenase delivery into the human pancreas using syringe loading or controlled perfusion[J].Cell Transplant,1999,8(3):285-292.
6 Natisha L.Rose,Monica M.Palcic,Lisa M.H.Helms,et al.Evaluation of pefabloc as a serine protease inhibitor during human-islet isolation[J].Transplantation,2003,75(4):462-466.
7 Heiser A,Ulrichs K,Muller-Ruchholtz W.Prop-hylactic trypsin inhibition during the isolation procedure guarantees reproducible,high porcine islet yields[J].Xenotransplantation,1994,1(1):66-68.
8 Lakey JRT,Helms LMH,Kin T,et al.Serine-protease inhibition during islet isolation increases islet yield from human pancreata with prolonged ischemia[J].Transplantation,2001,72(4):565-570.
9 White S,Djaballah H,Hughes D,et al.A preliminary study of the activation of endogenous pancreatic exocrine enzymes during automated porcine islet isolation[J].Cell Transplant,1999,8(3):265-276.
10 Heiser A,Ulrichs K,Muller-Ruchholtz W.Isolation of porcine pancreatic islets: low trypsin activity during isolation procedure guarantees reproducible high islet yields[J].J Clin Lab Anal,1994,8(6):407-411.
11 Basir I,van der Burg MPM,Scheringa M,et al.Improved outcome of pig islet isolation by Pefabloc inhibition of trypsin[J].Transplant Proc,1997,29(4):1939-1941.
12 Krause U,Puchinger H,Wacker A.Inhibition of glucose-induced insulin secretion in trypsin-treated islets of Langerhans[J].Horm Metab Res,1973,5(5):325-329.
13 Lu WT,Lakey JR,Juang JH,et al.Effect of trypsin inhibitor on islet isolation from fresh and cold preserved rat pancreas[J].Transplantation Proc,2003,35(1):488-489.
14 Benhamou PY,Watt PC,Mullen Y,et al.Human islet isolation in 104 consecutive casea.factors affecting isolation success[J].Transplantation,1994,57(12):1804-1810.
15 Matsumoto S,Rigley TH,Reems JA,et al.Improved islet yields from macaca nemestrina and marginal human pancreata after two-Layer Method Preservation and Endogenous Trypsin Inhibition[J].Am JTransplant,2003,3(1):53-63.
16 Goto M,Eich TM,Stahle M,et al.Technical improvement of human pancreatic islet isolation[J].Transplantation Proceedings,2005,37(2):1313-1314.
