纳豆中SOD的分离纯化及性质的研究
2011-12-04崔明勋姜成哲李太元
崔明勋,姜成哲,李太元
(延边大学农学院,吉林 延吉 133000)
纳豆中SOD的分离纯化及性质的研究
崔明勋,姜成哲,李太元
(延边大学农学院,吉林 延吉 133000)
通过采用不同的溶液、pH和温度处理探讨了对SOD提取物活性的影响,采用硫酸铵沉淀法粗提,葡聚糖凝胶过柱,利用聚丙烯酰胺凝胶电泳法判定纯度。结果表明,提取时纳豆捣碎与否结果没有差异,采用缓冲液效果较好。采用50℃以上的温度处理影响酶活性,硫酸铵饱和度在65%~90%时得到较纯的酶粗提物,pH5.9的条件下有利于分离纯化,得到了分子量为3.86×104u的Fe-SOD型SOD。
纳豆;超氧化物歧化酶(SOD);pH;温度
超氧化物歧化酶(superoxide dismutase,SOD)广泛存在于各种生物体内,微生物、动物和植物都含有SOD[1],按金属辅基的不同分为3种类型,存在于真核生物的Cu-Zn-SOD,存在于真核生物线粒体及少数原核生物中的Mn-SOD,存在于原核生物的Fe-SOD[2]。SOD是生物体分解超氧阴离子的主要金属酶,在防止生物体免受氧自由基损伤,提高人体免疫力,延缓机体衰老等方面起重要作用[3],对类风湿、关节炎等疾病的治疗有显著疗效,在日用化工产品及食品领域的应用也越来越广泛[4]。因此,需要安全可靠易生产的来源以满足需求。
纳豆是日本传统的大豆发酵食品之一,是将大豆用枯草芽孢杆菌或纳豆菌发酵而成的[5],具有较高的营养价值。在纳豆激酶被发现以来,其作为功能性食品更为人们所关注,研究资料表明,其具有溶血栓、控制骨质疏松症的发展[6]、抗氧化、降血压等作用。并且也是较安全、廉价的食品。
本实验对纳豆中SOD的分离纯化条件进行了摸索,寻找最佳方案,对分离得到的SOD的一些性质进行了探讨。
1 材料与方法
1.1 材料、试剂与设备
纳豆:由吉林省延边草仙药业公司提供;邻苯三酚:上海生化试剂所;考马斯亮蓝G-250:上海绿鸟科技发展有限公司;磷酸氢二钾、磷酸二氢钾、磷酸二氢钠、磷酸氢二钠、NaCl:分析纯,天津市化学试剂六厂;牛血清白蛋白:Simga公司;SDS-PAGE低分子量标准蛋白质:上海升正生物技术有限公司;葡聚糖凝胶:上海化学试剂公司分装厂。恒温水浴锅:北京市医疗设备厂;部分收集器、核酸蛋白检测仪:上海青浦沪西仪器厂;722S型分光光度计:天津市普瑞斯仪器有限公司;超纯水系统:Millipore公司;低温冷冻离心机:Hitachi公司;笔型酸度计:上海精密科学仪器有限公司。
1.2 方法
1.2.1 纳豆SOD提取方法的选择
1.2.1.1 不同提取液及处理对纳豆SOD活力的影响
取8份纳豆,每份15g,分成两组,其中一组把纳豆捣碎,一组直接使用,分别加入蒸馏水、0.1 mol/L磷酸钾缓冲液、0.1 mol/L磷酸钠缓冲液、0.9%氯化钠溶液各30 mL,在摇床上振荡1 h,4000 r/min 离心 15 min,取上清液,进行SOD活力和蛋白含量测定。
1.2.1.2 不同温度对纳豆SOD活力的影响
称38 g纳豆,加入76 mL蒸馏水,振荡1 h,离心,取上清液,分成10份,1份4℃保存,剩余的分成3组,分别放入40、55和70 ℃水浴中,在10、25、40 min时各取出1份,迅速放入冰浴中冷却,测定SOD活力和蛋白含量。
1.2.1.3 不同pH对纳豆SOD活力的影响
取纳豆45 g纳豆,加入90 mL蒸馏水,振荡1 h,离心,取上清液,取等量6份,用0.5 mol/L HCl溶液或0.5 mol/L NaOH溶液调整纳豆洗液的pH分别为4.5、5.5、7、8.5、10、11.5。置4 ℃冷藏,过夜后,4000 r/min 离心20 min,取上清液调整pH为7,记录上清液的体积并检测SOD活力和蛋白含量。
1.2.2 纳豆SOD的纯化
1.2.2.1 纳豆SOD的粗提
称取纳豆,加0.05 mol/L的磷酸缓冲液洗涤,收集洗涤液,4800 r/min离心30 min,取上清液边搅拌边加入硫酸铵粉末,使饱和度达到65%~70%之间,4℃冷藏过夜,取出离心,收集上清液,再加入硫酸铵粉末,使饱和度达到90%,过夜,离心,取沉淀加水溶解,放入透析袋中透析24 h。
1.2.2.2 葡聚糖凝胶过柱纯化
取出透析过的溶液,加入0.5 mol/L pH5.9的磷酸缓冲液,检测溶液的pH,达到5.9后,冷藏,过夜,4000 r/min离心20 min,取上清液,用透析袋浓缩,浓缩液离心,上清液用葡聚糖凝胶G-50过柱,洗脱液用0.05 mol/L pH5.9磷酸缓冲液,经核酸蛋白检测仪280 nm处检测,结合SOD活力测定,收集有活力的部分,用透析袋浓缩,浓缩液离心,上清液如上条件,再过葡聚糖凝胶G-150,活性部分浓缩后,离心,上清液冷冻保存。
1.2.2.3 电泳
首先采用7.5%聚丙烯酰胺凝胶电泳,判定蛋白质分离的效果,直到出现一条蛋白带,再使用15%SDS聚丙烯酰胺凝胶电泳,以SDS-PAGE低分子量标准蛋白质作基准,计算SOD的分子量。
1.2.3 纳豆SOD性质
1.2.3.1 纳豆SOD类型
采用氯仿-乙醇溶液和H2O2对SOD活力抑制的方法进行SOD类型的鉴定[7]。
氯仿-乙醇(按体积比2∶3)溶液按0%、10%和40%的比例与20%的酶液混合,在25℃处理10 min,测定酶的活力,并以等量抑制剂做空白对照进行计算。
配制20 mmol/L和10 mmol/L的过氧化氢溶液,与酶液1∶1混合,使其终浓度达到5 mmol/L和10 mmol/L,分别在25℃处理10 min和20 min,以加蒸馏水的酶液作对照,测定酶活力。
1.2.3.2 纳豆SOD温度稳定性
从冰箱中取出酶液,取等量的酶液,分别在20、40、55、70、85℃的温度下保温20 min,加热过的取出后迅速冷却,测定酶活性。
1.2.4 SOD活力的测定
采用修正的联苯三酚自氧化法[8]。
酶活力单位的定义:在一定条件下,在1 mL反应液中,每分钟抑制联苯三酚自氧化速率达50%时的酶量为1个酶活性单位(U)。
1.2.5 蛋白含量的测定
采用考马斯亮蓝法。用牛血清白蛋白做标准蛋白。
2 结果与讨论
2.1 纳豆SOD提取方法的选择
2.1.1 不同提取液及处理对纳豆SOD活力的影响
纳豆使用不同溶液洗涤的结果(见表1),4种不同的溶液洗涤得到的酶液,方差分析结果,SOD比活力之间,用磷酸缓冲液洗涤的与用蒸馏水洗涤的之间差异极显著,与用0.9%NaCl洗涤的之间差异显著。用蒸馏水洗涤的活力最低。而捣碎的纳豆和没有捣碎的纳豆之间,没有显著差异,可以认为该酶是纳豆菌分泌出来的,酶蛋白主要存在于纳豆的表面。从比活力来看,用磷酸缓冲液洗涤的比活力较高。
2.1.2 不同温度对纳豆SOD活力的影响
纳豆用蒸馏水洗涤的粗提液,测定SOD活力和蛋白含量的结果,放到4℃下的活力为(115.3±9.74)U/mL,蛋白含量为(0.52±0.03)mg/mL,比活力为(219.9±7.76)U/mg。40℃下分别处理10、25、40 min的结果表明与4℃下处理的没有差异,而比活力随着温度的提高极显著地降低,经方差检验40℃时与55℃和70℃之间存在着极显著差异。处理时间的延长,活力和蛋白含量都有所降低,比活力之间差异不显著(结果见表2)。
2.1.3 不同pH对纳豆SOD活力的影响
对纳豆水洗液分别经过1 mol/L HCl溶液调整为酸性,用1 mol/L NaOH溶液调整为碱性,4℃过夜等待蛋白质沉淀,取上清液,再把所有的溶液pH调为7,测定蛋白质含量和SOD活力的结果,蛋白质含量pH 4.5和11.5的降低较多,而pH10的含量最多,SOD活力也有类似的变化,其变化从比活力值来看,pH 4.5降低最多,然后是pH 11.5、5.5的,见表3。pH对酶活性的变化规律与Cu,Zn-SOD的变化相似[9],而pH 6时SOD比活力略低于最高值,见图1。
表 1 不同溶液和处理对纳豆SOD活力及比活力结果(x±SD)Table 1 The results of different solution and treatment on specific activity of SOD

表 1 不同溶液和处理对纳豆SOD活力及比活力结果(x±SD)Table 1 The results of different solution and treatment on specific activity of SOD
注:**表示与蒸馏水相比差异极显著;#表示与0.9%NaCl相比差异显著。
表 2 不同温度和时间处理对纳豆SOD活力和比活力结果Table 2 The results of different temperature and time treatment on specific activity of SOD
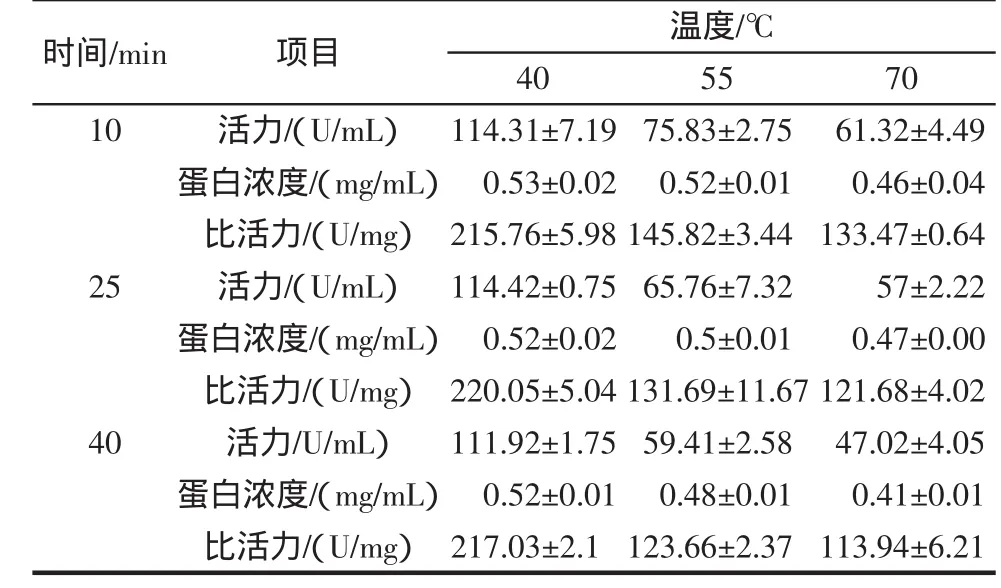
表 2 不同温度和时间处理对纳豆SOD活力和比活力结果Table 2 The results of different temperature and time treatment on specific activity of SOD
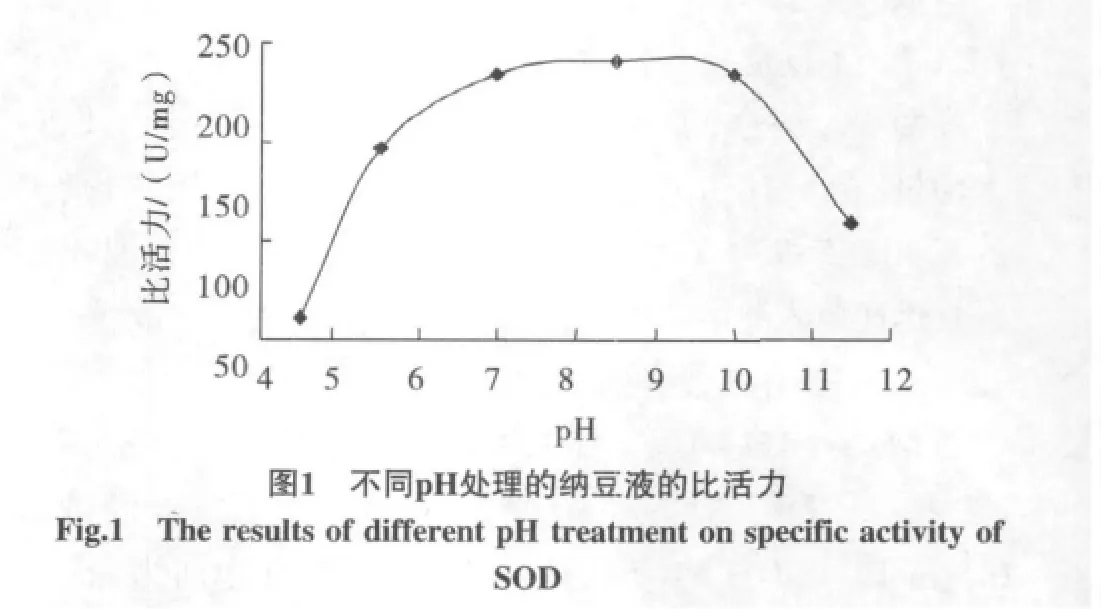
表 3 不同pH处理对纳豆SOD活力的结果Table 3 The results of different pH treatment on specific activity of SOD
表 3 不同pH处理对纳豆SOD活力的结果Table 3 The results of different pH treatment on specific activity of SOD
pH 4.55.578.51011.5蛋白浓度/(mg/mL)3.1±0.13.34±0.23.33±0.153.48±0.063.65±0.252.9±0.03活力/(U/mL)229.68±31.89586.46±38.91734.58±20.1797.9±53.53806.82±40.86381.34±40.8比活力/(U/mg)73.84±7.93176.69±22.26220.85±3.61229.16±11.59221.23±4.02131.51±12.52
2.2 纳豆SOD的纯化结果
2.2.1 纳豆SOD的粗提和过柱
称取100 g纳豆,用200 mL蒸馏水分次洗涤,洗脱液经45%硫酸铵沉淀,出现大量的沉淀物,但其蛋白质含量很低,饱和度达到70%时,沉淀中有蛋白质出现,饱和度达到90%后,沉淀有DOS活性,离心后的上清液黏度降低,并变得透明。
过柱前用0.5 mol/L pH5.9的磷酸缓冲液处理,虽然对SOD活性有一定的影响,可以减少杂蛋白,特别是降低溶液的黏度,有利于过柱分离。过葡聚糖凝胶G-50的洗脱液经过280 nm检测时,得到的吸收峰是一个较宽的单峰,峰的前部分具有SOD活力,而后部分的吸收峰SOD活力低或无活力,收集液能够看到白色的混浊现象。过葡聚糖凝胶G-150后,出现前后两个峰,也没有彻底分开,前峰有活性。经过多次过柱,提纯倍数达到22.2倍,得率为23%。
2.2.2 电泳
采用7.5%聚丙烯酰胺凝胶电泳时,有活性的部分总有一条跑的最快的带,比牛血清白蛋白跑的还快,经多次过柱,得到一条带,所以认定为SOD蛋白带。经15%SDS聚丙烯酰胺凝胶电泳测定蛋白质的分子量,分子量为3.86×104u,与文献[10]中所述相一致。
2.3 纳豆SOD性质
2.3.1 纳豆SOD类型
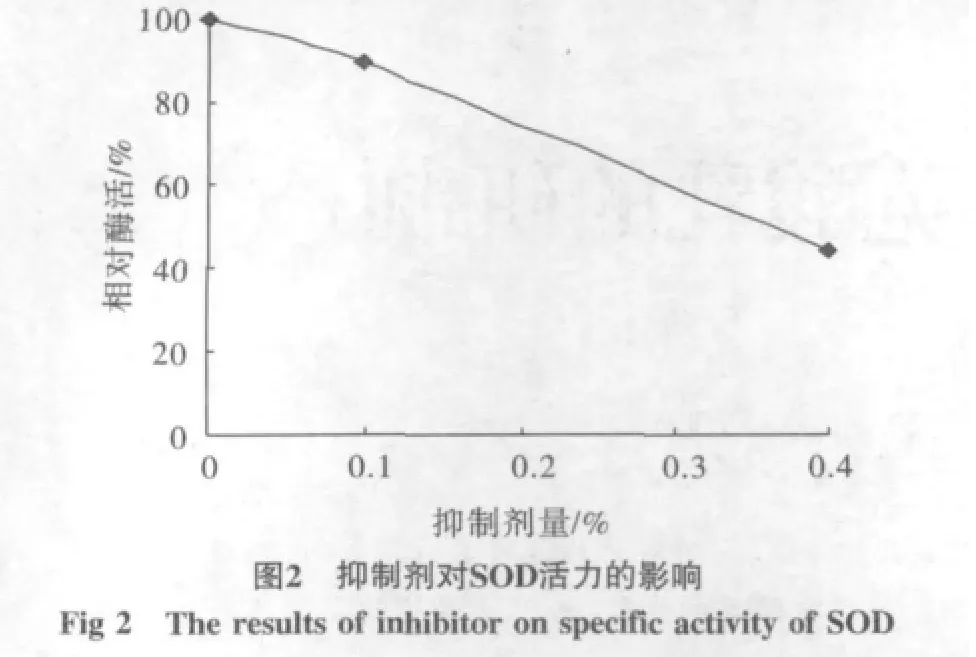
提纯的酶液用氯仿-乙醇溶液处理,以没加氯仿-乙醇溶液为对照,10%的活力为对照的89%,抑制效果较低。而40%的相对活力将为44%。出现明显的抑制作用,见图2。
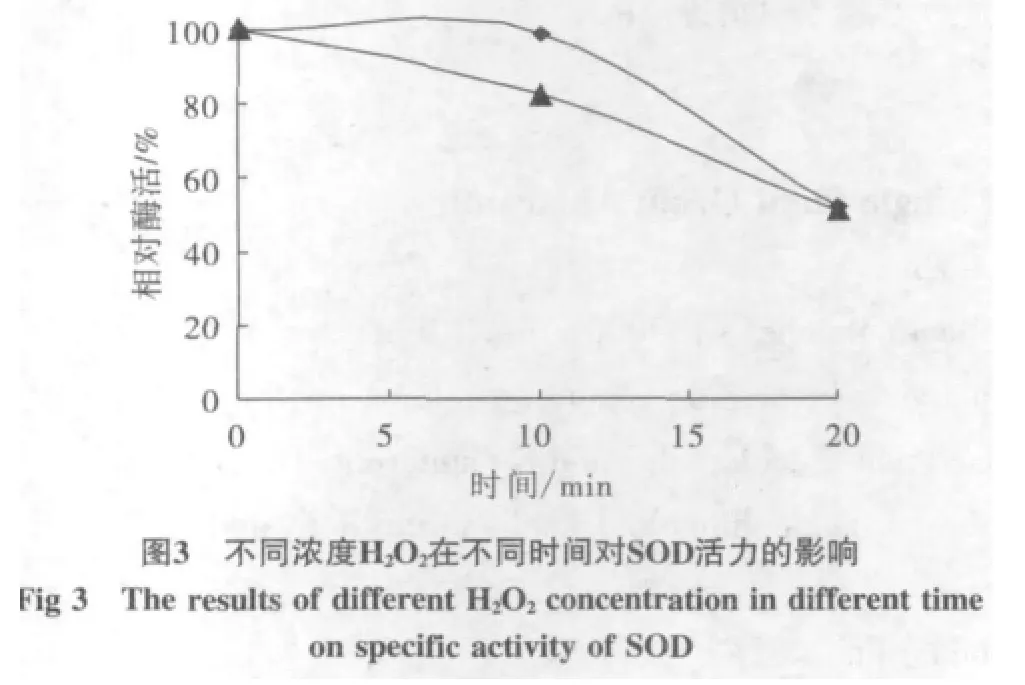
5 mmol/L的H2O2处理10 min时,抑制率为98%,抑制作用很低,10 mmol/L H2O2处理的10 min时已经开始出现抑制作用抑制率为81%,在20 min时,两种浓度下的抑制能力相似,为51%,见图3,说明随着时间的延长,H2O2出现抑制作用。
两种处理对酶的活力都有抑制作用,说明酶的类型应是Fe-SOD。
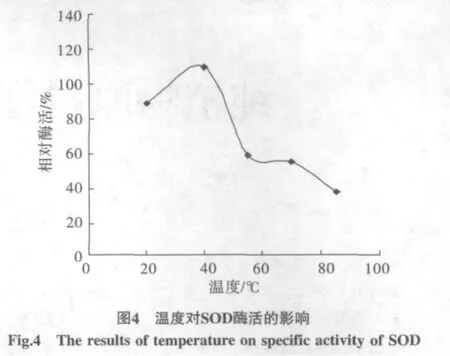
2.3.2 纳豆SOD温度稳定性
酶液经过不同温度处理,活性以放在20℃的为准,得到相对活力,见图4,活性最高是40℃下保温的,相对活性达到123%,而55℃和70℃的,活性已经降到66%和61%,此结果与提纯前的酶活力比较,放置在20℃下的酶活力比40℃处理的低,与提纯前的不同,可能与提纯过程及条件变化有关,其它的结果都相似。在85℃处理的,活性已下降到了41%,比文献[11]中耐高温微生物产的SOD在55℃和75℃时热稳定性较差,比起Cu,Zn-SOD热稳定性在55 ℃时也低[12]。因此,纳豆烹饪时,应该考虑比其它来源SOD需要较低的温度。
3 结论
从纳豆中提取SOD过程来看,最大的障碍是纳豆洗液的黏度,其黏度主要是由于纳豆中存在的大量γ-聚谷氨酸所造成[13],在分离提纯的每一步骤都产生干扰。提取条件来看,使用磷酸缓冲液有利于酶液的提取,不能采用提高温度的方法来达到纯化酶的目的,纯化时采用pH5.9的缓冲液,虽然不是酶的最适pH,对酶的活性有一定的影响,但可以有效降低酶液的黏度,有利于分离提纯。此SOD的类型是Fe-SOD型,分子量约为3.86×104u,并认为是纳豆菌分泌性酶。
参看文献:
[1]梁春梅,袁旭,沈娟,等.正交试验优选淡豆豉中SOD的最佳水提条件[J].安徽医科大学学报,2010,45(5):714-716
[2]杨明琰,张晓琦,沈俭,等.微生物超氧化物歧化酶的研究进展[J].微生物学杂志,2004,24(1):49-51
[3]宫莉,丛娟,王晓俊,等.酵母SOD高产菌的选育及发酵条件[J].长春工业大学学报:自然科学版,2006,27(3):204-207
[4]陈彦斌,詹现璞,张宏盈,等.SOD的保健作用及在乳制品中的应用[J].中国乳业,2007(5):40-44
[5]段智变,江晓,江汉湖,等.纳豆提取物对实验性高脂血症的作用研究[J].食品与发酵工业,2002,28(12)10-13
[6]陈丽娟,沙长青,新伟,等.国外纳豆激酶的开发现状[J].生物技术,2003,13(3):44
[7]刘妮娜,姚忠,叶艳华,等.耐盐节杆菌Arthrobacter pascens DMDC12中Mn-SOD的纯化及性质[J].食品与生物技术学报,2008,27(1):103-108
[8]庞战军,周玫,陈瑗.自由基医学研究方法[M].北京:人民卫生出版社,2000:110
[9]袁勤生,陈浩,姚菊芳,等.牛马血超氧化物歧化酶的制备新工艺[J].生化药物杂志,1991,56(2):20-22
[10]郭中满,苟仕金,殷礼.超氧化物歧化酶研究进展[J].中国兽医科技,1991,21(4):45-47
[11]王忠彦,黄英,胡永松.一株耐高温SOD产生菌的筛选及酶学特性[J].微生物学报,1997,37(4):307-311
[12]袁勤生,陈浩,朱利民.Cu,Zn-SOD理化性质的比较[J].华东化工学院学报,1992,18(3):291-295
[13]张春岭,郭爱玲.纳豆中γ-PGA的分离纯化和鉴定[J].农产品加工学刊,2007,10(115)::78-83
Study on the Extracting and Purification Superoxide Dismutase(SOD)from the Natto
CUI Ming-xun,JIANG Cheng-zhe,LI Tai-yuan
(Agriculture College,Yanbian University,Yanji 133000,Jilin,China)
Through the use of different solutions,pH and temperature process of combining,tested the SOD activity.Crude SOD was extracted by the method of ammonium-sulfate precipitation,the Sephadex gel,the polyacrylamide electrophoresis to decided the purity.There was no different result purity that with or without mash,buffer solution was better.More than 50℃ deal with effects of the enzyme activity and ammonium-sulfate reveal the humidity at 65%-90%had a pure crude enzyme extraction,pH5.9 conditions conducive to the separation,purification,the molecular weight for 3.86×104u Fe-SOD type were obtained.
Natto;superoxide dismutase(SOD);pH;temperature
延边大学科技发展项目(2009第015号)
崔明勋(1966—),男(朝鲜),副教授,博士,主要从事药理学和生物化学研究。
2011-06-11
