微小RNA在胰腺导管腺癌中的研究进展
2011-12-01余春开于双妮卢朝辉
余春开,于双妮,卢朝辉,陈 杰
中国医学科学院 北京协和医学院 北京协和医院病理科, 北京 100730
·综述·
微小RNA在胰腺导管腺癌中的研究进展
余春开,于双妮,卢朝辉,陈 杰
中国医学科学院 北京协和医学院 北京协和医院病理科, 北京 100730
微小RNA (miRNA)是一种内源性非编码RNA分子,长度19~24个核苷酸,作为转录后调节分子发挥作用。多种肿瘤中都存在miRNA表达谱的改变,差异表达的miRNA发挥癌基因或抑癌基因的作用,与肿瘤的发生、发展和预后有着密切的联系。对胰腺导管腺癌miRNA表达谱的研究及其靶基因的探索有助于了解胰腺导管腺癌的发病机制,同时miRNA表达谱是胰腺导管腺癌早期诊断和预后判断潜在的肿瘤标志物。本文总结了近年已知miRNA在胰腺腺癌中的表达情况,并探讨miRNA在胰腺导管腺癌诊断、治疗及预后中的作用。
胰腺导管腺癌;微小RNA;靶基因;生物学标志物
胰腺导管腺癌是一种高度侵袭性的肿瘤,且临床症状出现晚,不易早期发现,是实性肿瘤中预后最差的,5年生存率小于5%。在美国,胰腺导管腺癌在癌症导致的死亡原因中排第4位。在我国发病率逐年上升,且有年轻化的趋势。虽然化疗和放疗等辅助治疗对于延长胰腺导管腺癌患者生存时间发挥了一定作用,但是预后仍然很差,中位生存期小于24个月。目前几乎没有胰腺导管腺癌特异性的生物学标记,也没有满意的胰腺导管腺癌的诊断和治疗方法。胰腺导管腺癌微小RNA(microRNA, miRNA)的研究有助于了解胰腺导管腺癌的发病机制,并可能为胰腺导管腺癌的诊断和治疗提供新线索。
miRNA是一种内源性非编码单链小分子RNA,长度19~24个核苷酸,通过与mRNA 特定区域结合对蛋白质的翻译进行调控。在多种生物学过程中发挥重要作用。目前已报道1000多种人类miRNA,其中一部分miRNA在细胞增殖、凋亡和分化中发挥作用。多种肿瘤中存在miRNA表达谱的改变,miRNA与肿瘤的发生、发展和预后有着密切的联系。近年研究表明,miRNA 在人类胰腺导管腺癌组织中有异常表达,其表达谱可清楚区分癌组织与慢性胰腺炎及正常胰腺组织[1-12]。有研究显示miRNA 在人外周血中稳定表达,提示miRNA 是胰腺导管腺癌早期诊断潜在的肿瘤标记物[1]。另有研究者发现了一些胰腺导管腺癌相关miRNA作用的靶基因,提示miRNA可能是胰腺导管腺癌潜在的治疗靶点。
miRNA的结构和生物合成
miRNA由不同的染色体位点转录而成,编码miRNA的基因约占整个基因组的2%~5%。miRNA的生物合成较为复杂[2-3],首先miRNA基因由RNA 合酶Ⅱ介导转录成初级-miRNA(primary miRNA),其含有帽子结构和poly A 尾。初级-miRNA在核内被核糖核酸酶Ⅲ家族成员Drosha剪切成约70核苷酸 具有发夹状结构的前体-miRNA(precursor miRNA)。与双链RNA 结合蛋白DGCR8结合,前体-miRNA由核输出蛋白-5和RAN 2GTP转运到胞质,被另一种核糖核酸酶Ⅲ家族成员Dicer剪切为长约22核苷酸的双链miRNA。miRNA 双体经过解旋酶的作用解旋,产生成熟miRNA单体,其中具有生物学作用的一条单链成熟miRNA很快和RNA诱导沉默复合物进行组合,而另一条链大部分情况下被降解。在RNA诱导沉默复合物的保护下,miRNA与靶mRNA的3’端非编码区相结合[4]。
miRNA与肿瘤
研究表明miRNA 在人体一系列重要的生命过程中发挥调控作用,包括细胞增殖、细胞凋亡、生长发育、细胞分化和炎症等。人体中20%~30%的蛋白编码基因被miRNA 调控,miRNA与相应的基因和蛋白质一起形成人体复杂而精确的调控网络。研究证实多种肿瘤组织都存在miRNA表达谱的改变,miRNA与肿瘤的发生、发展和预后有着密切的联系。与正常组织相比,肿瘤组织存在差异性表达,有部分miRNA表达上调,部分miRNA表达下调。Volinia等[5]运用含有特异性探针的芯片对54 个样本(包括肺、乳腺、胃、前列腺、结肠和胰腺癌6 种实体瘤组织)的137个miRNA 表达谱进行分析,发现有49个miRNA 差异表达,其中34个miRNA在肿瘤组织中的表达高于其在正常组织中的表达。
与肿瘤相关的微小RNA,被称为致癌微小RNA。miRNA表达的改变可发挥癌基因或抑癌基因的作用。若在肿瘤细胞中高表达,具有类似癌基因的作用;在肿瘤组织中低表达时,则具有类似肿瘤抑制因子的作用。
胰腺导管腺癌中miRNA的表达谱
胰腺导管腺癌是多基因参与的高度恶性肿瘤,且这些多基因改变参与了胰腺导管腺癌从胰腺癌前病变到胰腺导管腺癌的不同发展过程。胰腺癌前病变包括胰腺导管内乳头状黏液性肿瘤、黏液性囊腺瘤及胰腺导管上皮内瘤变(pancreatic intraepithelial neoplasia,PanIN)。胰腺癌前病变可能存在不同的miRNA表达谱[6-8]。Habbe等[6]用qRT-PCR和核酸锁定原位杂交的方法检测15例胰腺导管内乳头状黏液性肿瘤及对应的对照组织发现miR-155表达显著上调。Ryu等[7]分析了miR-21、 miR-155和miR-221在胰腺非浸润性病变(PanIN-1、PanIN-2和 PanIN-3)的表达,结果显示miR-155表达上调出现在PanIN-2,而miR-21表达上调出现在PanIN-3。这些研究结果均提示miR-155表达异常出现在胰腺导管腺癌的较早期阶段,miR-155可作为胰腺癌前病变的生物学标记物。
近几年miRNA芯片和定量PCR技术被应用于miRNA的研究。有学者用这些技术研究胰腺导管腺癌的miRNA表达谱,比较胰腺导管腺癌来源的细胞系或胰腺导管腺癌组织与慢性胰腺炎、正常胰腺组织的miRNA表达情况,结果显示胰腺导管腺癌中有大量的miRNA表达出现异常[9-12]。与正常胰腺组织相比,胰腺导管腺癌细胞系或癌组织中miRNA的表达异常大部分表现为高表达,如miR-21、miR-155、miR-221、miR-210等,小部分为低表达,如miR-148a/-148b;并且发现慢性胰腺炎miRNA的表达谱与正常胰腺组织相似,而胰腺正常组织与胰腺导管腺癌的miRNA表达谱则明显不同[9-12]。
由于肿瘤组织标本中包含了肿瘤细胞、间质、正常腺泡及导管等各种类型细胞,因此由整个肿瘤组织检测到的miRNA不能直接反应肿瘤细胞的miRNA改变。用核酸锁定原位杂交方法可以明确定位哪种细胞出现了miRNA表达改变。研究显示大部分miRNA如miR-21和miR-155的过表达位于肿瘤细胞,而不是间质、正常腺泡或导管[6, 13];另有报道miR-221、 miR-376a及miR-301的表达亦定位于肿瘤细胞,而间质、正常腺泡或导管无表达[9]。
miRNA与靶基因
根据生物信息学预测,一种miRNA 可调控多种靶mRNA的表达,而一个靶mRNA可以接受多个miRNA 的调控。miRNA对靶基因的调控发生在转录后水平,通过对靶基因转录体的切割或对其翻译抑制等两种机制来下调靶基因的表达。这两种机制的选择取决于其与靶基因转录体序列互补的程度。如果miRNA 与靶基因转录体mRNA 充分互补,miRNA 将通过切割方式降解靶基因;如果miRNA与靶基因转录体mRNA未充分互补, 但有多个互补位点,那么miRNA 将对靶基因进行翻译抑制[14]。miRNA对其功能靶点的最低要求是至少7个碱基与5’端互补结合,即可调控其靶基因。
近年陆续有关于胰腺导管腺癌miRNA的功能研究及其靶基因的报道(表1)。但是由于miRNA与靶基因之间的调控网络非常复杂,特别是胰腺导管腺癌发生发展中发挥关键作用的miRNA与靶基因仍需要大量的研究进一步证实。
miRNA与胰腺导管腺癌的诊断
胰腺导管腺癌组织存在miRNA的异常表达,而且miRNA的差异表达有胰腺的组织特异性,因此miRNA可用于胰腺导管腺癌与其他脏器组织来源恶性肿瘤的鉴别诊断[10, 41-42]。Poy等[43]研究显示miR-375和miR-376在鼠胰腺和胰腺细胞系中的表达明显高于鼠的脑、心脏和肝组织。Olson等[44]检测了540例实性肿瘤(包括乳腺、结肠、肺、胰腺、前列腺和胃)的miRNA表达谱,发现不同实性肿瘤及正常细胞的miRNA表达谱有差异,miR-21、miR-191和 miR-17-5p在所有6种类型肿瘤均显著过表达,而miR-218-2在结肠、胃、前列腺和胰腺均低表达,在肺癌和乳腺癌未出现低表达,这些结果表明结肠、胰腺、前列腺和肺具有相似的miRNA表达,而乳腺和肺分别有不同的miRNA表达。胰腺内分泌和外分泌肿瘤的miRNA的表达亦存在差异,如miR-204主要在胰岛素瘤中表达,且与其免疫组化胰岛素的表达有相关性,miRNA可用于鉴别内分泌肿瘤和腺泡来源的肿瘤[45]。
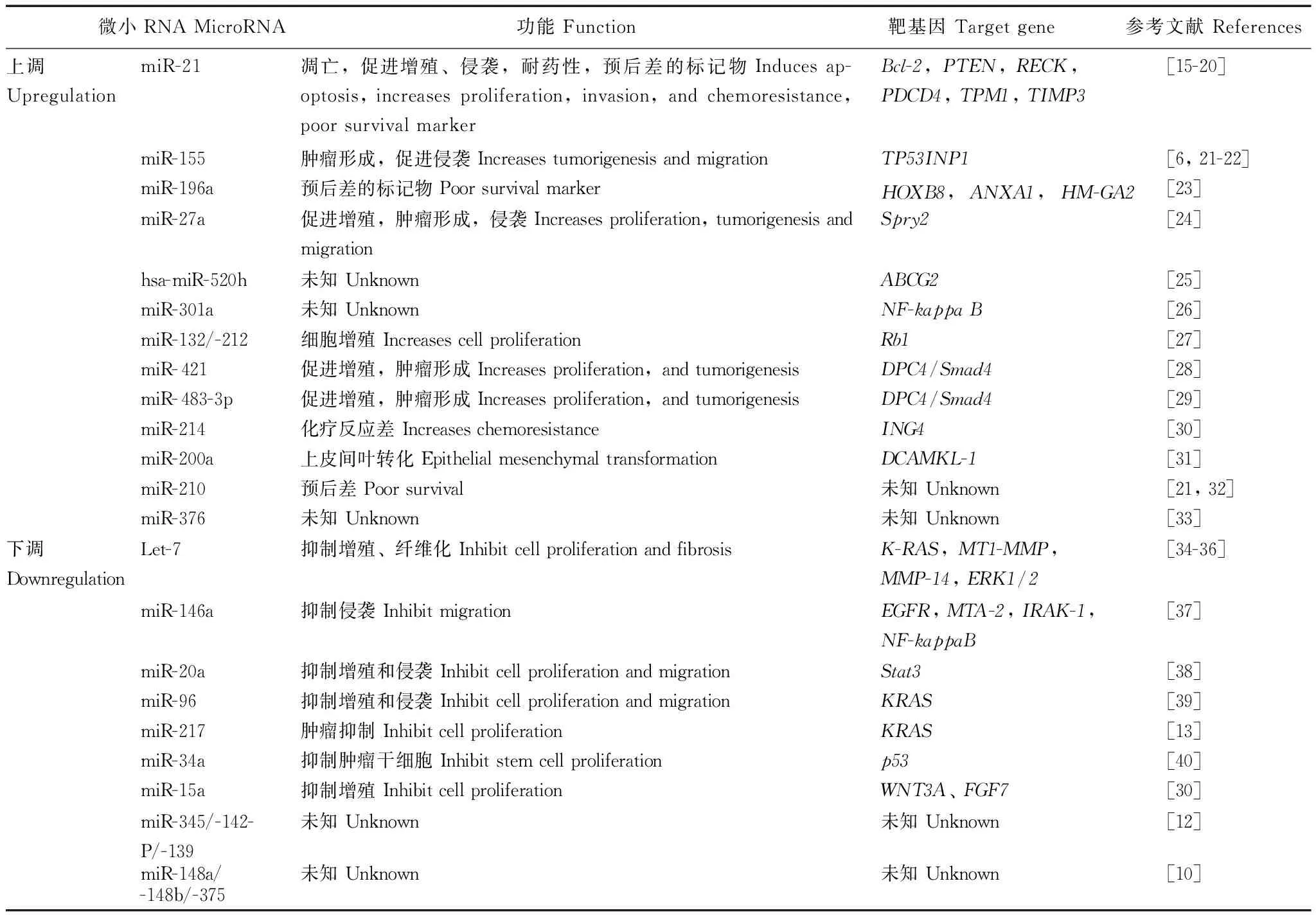
表 1 胰腺导管腺癌相关微小RNA的功能及其靶基因
相对于几万种mRNA和蛋白的表达谱,只有几百种的miRNA表达谱可能是一种更好的鉴别诊断方法[46]。另外miRNA分子比mRNA要短,更能耐受核糖核酸酶的降解,且在福尔马林固定石蜡包埋组织和血浆中能完整的保存,因此石蜡包埋组织和外周血也可用于胰腺导管腺癌miRNA的研究和诊断[10, 46-47]。Ho等[32]对胰腺导管腺癌患者和正常人的外周血miR-210的对照研究显示,miR-210能被有效的检测到并定量,并且发现胰腺导管腺癌患者和正常人的外周血 miR-210 的表达有显著性差异。另外还发现胰腺导管腺癌患者胰液与肿瘤组织中有相似的miRNA表达改变[48]。由此推测miRNA可作为胰腺导管腺癌的诊断性筛查和预后监测。
虽然miRNA用于胰腺导管腺癌的临床诊断还需要大量的研究工作,但是目前的研究结果表明miRNA表达谱是潜在的诊断标记物。
miRNA与胰腺导管腺癌的治疗
miRNA在肿瘤中可以发挥癌基因和抑癌基因的作用,因此产生了两种以miRNA为基础的肿瘤治疗新策略:即恢复肿瘤中低表达的miRNA及阻断肿瘤中过表达的miRNA。关于miRNA功能研究的体外和体内试验证实人工合成miRNA或其反义寡核苷酸可影响癌基因及抑癌基因的表达、肿瘤细胞生长能力和肿瘤的生长速度[13,18,36,38-40]。
合成miRNA、修正miRNA低表达将是一种新的肿瘤治疗方法[37]。let-7在正常胰腺腺泡中高表达而在低分化癌细胞中表达缺失,体外修复胰腺导管腺癌中let-7的表达水平,获取胞浆合成let-7的细胞或转染慢病毒载体,结果在体外和体内对细胞增生、K-ras的表达和有丝分裂蛋白激酶活性有较强的抑制作用[36]。hsa-mir-217在胰腺导管腺癌中表达下调,采用构建的hsa-mir-217表达载体、人工合成前体pre-mir-217和抑制剂anti-mir-217对胰腺导管腺癌细胞进行转染,结果显示升高hsa-mir-217可以显著抑制胰腺导管腺癌细胞系PANC-1及MIA PaCa-2细胞生长及非锚着依赖性生长能力;217-载体体内转染PANC-1细胞裸鼠移植瘤模型结果显示,与对照组相比,217-载体转染组移植瘤的生长速度显著减慢;转染217-抑制剂的MIA PaCa-2细胞内源性hsa-mir-217水平降低而非锚着依赖性生长能力增强[13]。
另外,miRNA的反义寡核苷酸在体内能抑制miRNA的功能。合成肿瘤组织中高表达miRNA或其前体的反义寡核苷酸可以抑制肿瘤细胞增殖和肿瘤生长速度。反义寡核苷酸包括2’-O-甲基、2’-O-甲氧乙基的胆固醇分子偶联的寡聚核苷酸或锁定核苷酸的寡核苷酸。
miRNA与胰腺导管腺癌的预后
miRNA的表达与胰腺导管腺癌的预后是否存在一定的相关性?如果确实有某些miRNA的表达与胰腺导管腺癌的预后有相关性,那么miRNA可以作为一个重要的生物学指标,并确定哪些患者需要进一步的治疗。miR-21是目前研究较多的可能与胰腺导管腺癌预后密切相关的miRNA[15, 17, 49]。Dillhoff等[16]用原位杂交的方法证实miR-21的表达与胰腺肿瘤大小、分化、淋巴结转移情况和临床分期无相关性,但是与miR-21局灶表达或无表达且淋巴结阴性的患者相比,miR-21过表达的患者预后更差。Bloomston等[10]比较了存活超过2年的淋巴结转移的患者和2年内死亡的患者的miRNA表达情况,结果显示淋巴结转移而生存期长的患者有6个miRNA (miR-452、miR-105、miR-127、miR-518a-2、 miR-187、和miR-30a-3p)高表达;另外研究显示miR-196-a2的高表达与预后差存在相关性。Greither等[21]用定量RT-PCR的方法检测56例胰腺癌miRNA表达情况并分析了与预后随访相关性,结果显示miR-155、 miR-203、miR-210和miR-222与预后差存在显著的相关性,与表达下调的患者相比,这4个miRNA表达上调的患者死亡风险增高6.2倍[21]。另外miR-17-5p[50]和hsa-miR-200c[51]也可能与胰腺导管腺癌的预后差有关。
miRNA在外周血中稳定存在,因此,外周血miRNA是胰腺导管腺癌预后随访潜在的生物学标记物。Kong 等[52]用实时定量PCR检测了35例胰腺导管腺癌、15例慢性胰腺炎和15例正常人血清miRNA表达情况,结果显示血清miR-21可以区别胰腺癌患者和正常人,血清miR-155 和 miR-196a可以区别胰腺疾病患者和正常人,而非手术患者的血清miR-196a比手术患者明显高,而且高表达的患者预后明显差。
结 语
miRNA 与肿瘤的发生、发展和预后有着密切的联系。miRNA的功能研究及在胰腺导管腺癌发生、发展、诊断和治疗中的作用,已成为胰腺导管腺癌研究的热点。有研究表明胰腺导管腺癌存在miRNA异常表达,并且部分miRNA可能具有胰腺特异性,但是尚未明确是哪个或哪几个miRNA在胰腺导管腺癌的发生发展中发挥关键作用,且其调控的靶基因及调控机制尚需做大量的研究工作,而其在胰腺导管腺癌诊断、治疗及预后上的研究尚处于初步阶段,还不能广泛地应用于临床。希望胰腺导管腺癌miRNA的研究能进一步剖析胰腺导管腺癌的发病机制,并为胰腺导管腺癌的临床诊断和预后随访提供特异、敏感的分子生物标志物,为胰腺导管腺癌的治疗研究提供新视野。
[1] Ali S, Almhanna K, Chen W, et al. Differentially expressed miRNAs in the plasma may provide a molecular signature for aggressive pancreatic cancer[J]. Am J Transl Res, 2010, 3(1):28-47.
[2] Lagos-Quintana M, Rauhut R, Lendeckel W, et al. Identification of novel genes coding for small expressed RNAs[J]. Science, 2001, 294(5543):853-858.
[3] Kong Y, Han JH. MicroRNA: biological and computational perspective[J]. Genomics Proteomics Bioinformatics, 2005, 3(2):62-72.
[4] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2):281-297.
[5] Volinia S, Calin GA, Liu CG, et al. A microRNA expression signature of human solid tumors defines cancer gene targets[J]. Proc Natl Acad Sci U S A, 2006, 103(7):2257-2261.
[6] Habbe N, Koorstra JB, Mendell JT, et al. MicroRNA miR-155 is a biomarker of early pancreatic neoplasia[J]. Cancer Biol Ther, 2009, 8(4):340-346.
[7] Ryu JK, Hong SM, Karikari CA, et al. Aberrant microRNA-155 expression is an early event in the multistep progression of pancreatic adenocarcinoma[J]. Pancreatology, 2010, 10(1):66-73.
[8] du Rieu MC, Torrisani J, Selves J, et al. MicroRNA-21 is induced early in pancreatic ductal adenocarcinoma precursor lesions[J]. Clin Chem, 2010, 56(4):603-612.
[9] Szafranska AE, Davison TS, John J, et al. MicroRNA expression alterations are linked to tumorigenesis and non-neoplastic processes in pancreatic ductal adenocarcinoma[J]. Oncogene, 2007, 26(30):4442-4452.
[10] Bloomston M, Frankel WL, Petrocca F, et al. MicroRNA expression patterns to differentiate pancreatic adenocarcinoma from normal pancreas and chronic pancreatitis[J]. JAMA, 2007, 297(17):1901-1908.
[11] Zhang Y, Li M, Wang H, et al. Profiling of 95 microRNAs in pancreatic cancer cell lines and surgical specimens by real-time PCR analysis[J]. World J Surg, 2009, 33(4):698-709.
[12] Lee EJ, Gusev Y, Jiang J, et al. Expression profiling identifies microRNA signature in pancreatic cancer[J]. Int J Cancer, 2007, 120(5):1046-1054.
[13] Zhao WG, Yu SN, Lu ZH, et al. The miR-217 microRNA functions as a potential tumor suppressor in pancreatic ductal adenocarcinoma by targeting KRAS[J]. Carcinogenesis, 2010, 31(10):1726-1733.
[14] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2):281-297.
[15] Bhatti I, Lee A, James V, et al. Knockdown of microRNA-21 inhibits proliferation and increases cell death by targeting programmed cell death 4 (PDCD4) in pancreatic ductal adenocarcinoma[J]. J Gastrointest Surg, 2010,15(1):199-208.
[16] Dillhoff M, Liu J, Frankel W, et al. MicroRNA-21 is overexpressed in pancreatic cancer and a potential predictor of survival[J]. J Gastrointest Surg, 2008, 12(12):2171-2176.
[17] Hwang JH, Voortman J, Giovannetti E, et al. Identification of microRNA-21 as a biomarker for chemoresistance and clinical outcome following adjuvant therapy in resectable pancreatic cancer[J]. PLoS One, 2010, 5(5):e10630.
[18] Park JK, Lee EJ, Esau C, et al. Antisense inhibition of microRNA-21 or -221 arrests cell cycle, induces apoptosis, and sensitizes the effects of gemcitabine in pancreatic adenocarcinoma[J]. Pancreas, 2009, 38(7):e190-e199.
[19] Lu Z, Liu M, Stribinskis V, et al. MicroRNA-21 promotes cell transformation by targeting the programmed cell death 4 gene[J]. Oncogene, 2008, 27(31):4373-4379.
[20] Bhatti I, Lee A, James V, et al. Knockdown of microRNA-21 inhibits proliferation and increases cell death by targeting programmed cell death 4 (PDCD4) in pancreatic ductal adenocarcinoma[J]. J Gastrointest Surg, 2011, 15(1):199-208.
[21] Greither T, Grochola LF, Udelnow A, et al. Elevated expression of microRNAs 155, 203, 210 and 222 in pancreatic tumors is associated with poorer survival[J]. Int J Cancer, 2010, 126(1):73-80.
[22] Gironella M, Seux M, Xie MJ, et al. Tumor protein 53-induced nuclear protein 1 expression is repressed by miR-155, and its restoration inhibits pancreatic tumor development[J]. Proc Natl Acad Sci U S A, 2007, 104(41):16170-16175.
[23] Kong X, Du Y, Wang G, et al. Erratum to: detection of differentially expressed microRNAs in serum of pancreatic ductal adenocarcinoma patients: miR-196a could be a potential marker for poor prognosis[J]. Dig Dis Sci, 2010, 56(2):602-609
[24] Ma Y, Yu S, Zhao W, et al. miR-27a regulates the growth, colony formation and migration of pancreatic cancer cells by targeting Sprouty2[J]. Cancer Lett, 2010, 298(2):150-158.
[25] Wang F, Xue X, Wei J, et al. hsa-miR-520h downregulates ABCG2 in pancreatic cancer cells to inhibit migration, invasion, and side populations[J]. Br J Cancer, 2010, 103(4):567-574.
[26] Lu Z, Li Y, Takwi A, et al. miR-301a as an NF-kappaB activator in pancreatic cancer cells[J]. EMBO J, 2011, 30(1):57-67.
[27] Park JK, Henry JC, Jiang J, et al. miR-132 and miR-212 are increased in pancreatic cancer and target the retinoblastoma tumor suppressor[J]. Biochem Biophys Res Commun, 2011, 406(4):518-523
[28] Hao J, Zhang S, Zhou Y, et al. MicroRNA 421 suppresses DPC4/Smad4 in pancreatic cancer[J]. Biochem Biophys Res Commun, 2011, 406(4):552-557.
[29] Hao J, Zhang S, Zhou Y, et al. MicroRNA 483-3p suppresses the expression of DPC4/Smad4 in pancreatic cancer[J]. FEBS Lett, 2011, 585(1):207-213.
[30] Zhang XJ, Ye H, Zeng CW, et al. Dysregulation of miR-15a and miR-214 in human pancreatic cancer[J]. J Hematol Oncol, 2010, 32(3):46.
[31] Sureban SM, May R, Lightfoot SA, et al. DCAMKL-1 regulates epithelial-mesenchymal transition in human pancreatic cells through a miR-200a-dependent mechanism[J]. Cancer Res, 2011, 71(6):2328-2338.
[32] Ho AS, Huang X, Cao H, et al. Circulating miR-210 as a novel hypoxia marker in pancreatic cancer[J]. Transl Oncol, 2010, 3(2):109-113.
[33] Jiang J, Lee EJ, Gusev Y, et al. Real-time expression profiling of microRNA precursors in human cancer cell lines[J]. Nucleic Acids Res, 2005, 33(17):5394-5403.
[34] Johnson SM, Grosshans H, Shingara J, et al. RAS is regulated by the let-7 microRNA family[J]. Cell, 2005, 120(5):635-647.
[35] Dangi-Garimella S, Strouch MJ, Grippo PJ, et al. Collagen regulation of let-7 in pancreatic cancer involves TGF-beta1-mediated membrane type 1-matrix metalloproteinase expression[J]. Oncogene, 2011, 30(8):1002-1008.
[36] Torrisani J, Bournet B, du Rieu MC, et al. let-7 MicroRNA transfer in pancreatic cancer-derived cells inhibitsinvitrocell proliferation but fails to alter tumor progression[J]. Hum Gene Ther, 2009, 20(8):831-844.
[37] Li Y, Vandenboom TN, Wang Z, et al. miR-146a suppresses invasion of pancreatic cancer cells[J]. Cancer Res, 2010, 70(4):1486-1495.
[38] Yan H, Wu J, Liu W, et al. MicroRNA-20a overexpression inhibited proliferation and metastasis of pancreatic carcinoma cells[J]. Hum Gene Ther, 2010, 21(12):1723-1734.
[39] Yu S, Lu Z, Liu C, et al. miRNA-96 suppresses KRAS and functions as a tumor suppressor gene in pancreatic cancer[J]. Cancer Res, 2010, 70(14):6015-6025.
[40] Ji Q, Hao X, Zhang M, et al. MicroRNA miR-34 inhibits human pancreatic cancer tumor-initiating cells[J]. PLoS One, 2009, 4(8):e6816.
[41] Baskerville S, Bartel DP. Microarray profiling of microRNAs reveals frequent coexpression with neighboring miRNAs and host genes[J]. RNA, 2005, 11(3):241-247.
[42] Sood P, Krek A, Zavolan M, et al. Cell-type-specific signatures of microRNAs on target mRNA expression[J]. Proc Natl Acad Sci U S A, 2006, 103(8):2746-2751.
[43] Poy MN, Eliasson L, Krutzfeldt J, et al. A pancreatic islet-specific microRNA regulates insulin secretion[J]. Nature, 2004, 432(7014):226-230.
[44] Olson P, Lu J, Zhang H, et al. MicroRNA dynamics in the stages of tumorigenesis correlate with hallmark capabilities of cancer[J]. Genes Dev, 2009, 23(18):2152-2165.
[45] Roldo C, Missiaglia E, Hagan JP, et al. MicroRNA expression abnormalities in pancreatic endocrine and acinar tumors are associated with distinctive pathologic features and clinical behavior[J]. J Clin Oncol, 2006, 24(29):4677-4684.
[46] Lu J, Getz G, Miska EA, et al. MicroRNA expression profiles classify human cancers[J]. Nature, 2005, 435(7043):834-838.
[47] Albulescu R, Neagu M, Albulescu L, et al. Tissular and soluble miRNAs for diagnostic and therapy improvement in digestive tract cancers[J]. Expert Rev Mol Diagn, 2011, 11(1):101-120.
[48] Sadakari Y, Ohtsuka T, Ohuchida K, et al. MicroRNA expression analyses in preoperative pancreatic juice samples of pancreatic ductal adenocarcinoma[J]. JOP, 2010, 11(6):587-592.
[49] Giovannetti E, Funel N, Peters GJ, et al. MicroRNA-21 in pancreatic cancer: correlation with clinical outcome and pharmacologic aspects underlying its role in the modulation of gemcitabine activity[J]. Cancer Res, 2010, 70(11):4528-4538.
[50] Yu J, Ohuchida K, Mizumoto K, et al. MicroRNA miR-17-5p is overexpressed in pancreatic cancer, associated with a poor prognosis, and involved in cancer cell proliferation and invasion[J]. Cancer Biol Ther, 2010, 10(8):748-757.
[51] Yu J, Ohuchida K, Mizumoto K, et al. MicroRNA, hsa-miR-200c, is an independent prognostic factor in pancreatic cancer and its upregulation inhibits pancreatic cancer invasion but increases cell proliferation[J]. Mol Cancer, 2010, 9:169.
[52] Kong X, Du Y, Wang G, et al. Detection of differentially expressed microRNAs in serum of pancreatic ductal adenocarcinoma patients: miR-196a could be a potential marker for poor prognosis[J]. Dig Dis Sci, 2010, 56(2):602-609.
ResearchAdvancesinMicroRNAinPancreaticDuctalAdenocarcinoma
YU Chun-kai, YU Shuang-ni, LU Zhao-hui, CHEN Jie
Department of Pathology, PUMC Hospital, CAMS and PUMC, Beijing 100730, China
CHEN Jie Tel:010-65295490, E-mail: xhblk@163.com
MicroRNA (miRNA), small non-coding RNA consisted of 19-24 nucleotides, are able to regulate gene expression at the post-transcriptional level. The aberrant expressions of miRNA have been found in various cancers and contribute to carcinogenesis by promoting the expression of proto-oncogenes or by inhibiting the expression of tumor suppressor genes. miRNA are related closely with the oncogenesis, progression, and prognosis of tumors. The discovery of the aberrant expression of miRNA in pancreatic ductal adenocarcinoma (PDA) and its target genes are helpful for the understanding of the pathogenesis of PDA and for the early diagnosis and prediction of this disease. In this paper, we summarize the recent research advances in miRNA expression in PDA and its target genes and discuss the potential role of miRNA in the diagnosis, and treatment of PDA.
pancreatic ductal adenocarcinoma; microRNA;target gene; biomarker
ActaAcadMedSin, 2011,33(5):575-581
陈 杰 电话:010-65295490,电子邮件:xhblk@163.com
R735.9
A
1000-503X(2011)05-0575-07
10.3881/j.issn.1000-503X.2011.05.019
国家自然科学基金(30471970)和国家科技支撑计划(十一五)课题(2006BAI02A14)Supported by the National Nature Sciences Foundation of China(30471970) and the National Key Technology R&D Program in the 11th Five Year Plan of China (2006BAI02A14)
2011-04-06)
