微波法合成烯基膦酸酯类化合物*
2011-11-27李盛男徐兰婷
李盛男,徐兰婷,何 菱
(四川大学 华西药学院 靶向药物与释药系统教育部重点实验室,四川 成都 610041)
近年来,有机磷酸酯类,特别是烯基膦酸酯类化合物的合成研究已引起人们的关注,且应用广泛[1~3]。迄今为止,烯基膦酸酯类化合物主要是通过Homer-Wadsworth-Emmons反应[4]、氧化加成反应[5]、有机金属催化反应[6]等方法合成,这些方法有些需要昂贵的金属催化剂,有些反应条件剧烈、操作烦琐。
本文报道一种烯基膦酸酯类化合物的简易合成方法。以β-硝基芳基乙烯(2a~2f)和亚磷酸三乙酯为原料,二氯甲烷为溶剂,用微波法高产率地合成了一系列烯基膦酸酯类化合物(1a~1f,Scheme 1),其结构经1H NMR,13C NMR和HR-MS确证。研究了催化剂,溶剂等对反应的影响,结果表明,采用微波法合成烯基膦酸酯类化合物具有反应时间短、反应条件温和、产率高等优点,是一种绿色环保和实用的合成方法。
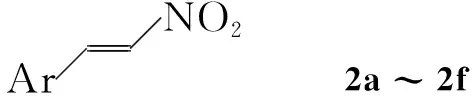
Scheme1
1 实验部分
1.1 仪器与试剂
Inova 400型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker Daltonics Data Analysis 3.2型质谱仪;MCL-Ⅱ型微波反应器。
2a~2e和亚磷酸三乙酯,分析纯,成都科龙试剂有限公司。
1.2 合成(以1a为例)
将β-硝基苯乙烯(2a)74.5 mg(0.5 mmol)和亚磷酸三乙酯249.0 mg(1.5 mmol)溶于CH2Cl2(3 mL)中,搅拌均匀后置微波反应器中,于100 mA回流反应5 min。滴加H2O2直至反应液不再有气泡产生为止。用乙酸乙酯(3×50 mL)萃取,合并有机层,用饱和NaCl溶液洗涤3次,无水Na2SO4干燥,旋蒸除溶后经硅胶柱层析[洗脱剂:V(石油醚)∶V(乙酸乙酯)=5∶1]纯化得苯乙烯基膦酸二乙酯(1a)。
用类似的方法合成1b~1f。
1a: 黄色液体,产率84%;1H NMRδ: 1.28(t,J=7.2 Hz, 6H), 4.07~4.14(m, 4H), 6.16(d,J=45.6 Hz, 1H), 6.34(d,J=22.0 Hz, 1H), 7.35(d,J=6.8 Hz, 3H), 7.53(d,J=6.8 Hz, 2H);13C NMRδ: 16.3, 62.2, 127.7, 128.4, 131.7, 136.7, 138.9, 140.7; HR-MS(ESI)z/m: Calcd for C12H17O3PNa{[M+Na]+} 263.1,found 263.1。
1b: 黄色液体,产率52%;1H NMRδ: 1.29(t,J=6.8 Hz, 6H), 4.08~4.15(m, 4H), 6.15(dd,J=1.2 Hz, 45.4 Hz, 1H), 6.34(dd,J=1.2 Hz,J=22.0 Hz, 1H), 7.33(d,J=8.0 Hz, 2H), 7.48(dd,J=1.2 Hz, 8.6 Hz, 2H);13C NMRδ: 16.3, 62.3, 128.8, 131.8, 134.4, 135.2, 138.1, 139.8; HR-MS(ESI)m/z: Calcd for C12H17O3ClP {[ M+H]+} 275.059 3,found 275.059 0。
1c: 黄色液体,产率50%;1H NMRδ: 1.28(t,J=7.2 Hz, 6H), 2.35(s, 3H), 4.10(q,J=6.8 Hz, 4H), 6.13(dd,J=1.0 Hz, 45.8 Hz, 1H), 6.29(dd,J=1.0 Hz, 21.8 Hz, 1H), 7.16(d,J=8.0 Hz, 2H), 7.42(d,J=7.6 Hz, 2H);13C NMRδ: 15.1, 20.1, 62.6), 126.2, 128.0, 129.9, 132.6, 137.3, 139.2; HR-MS(ESI)m/z: Calcd for C13H20O3P{[M +H]+} 255.115 2,found 255.114 8。
1d: 黄色液体,产率69%;1H NMRδ: 1.30(t,J=7.0 Hz, 6H), 4.08~4.15(m, 4H), 6.08(dd,J=1.4 Hz, 46.2 Hz, 1H), 6.20(dd,J=1.6 Hz, 22.0 Hz, 1H), 6.78(d,J=8.4 Hz, 2H), 7.40(dd,J=1.2 Hz, 8.6 Hz, 2H);13C NMRδ: 16.1, 63.6, 114.3, 127.4, 128.3, 131.6, 136.8, 140.6; HR-MS(ESI)m/z: Calcd for C12H17O4P{[M+H]+} 257.094 1, found 257.093 7。
1e: 黄色液体,产率61%;1H NMRδ: 1.23(t,J=7.2 Hz, 6H), 3.78(s, 3H), 4.00~4.10(m, 4H), 6.07(dd,J=1.2 Hz, 46.0 Hz, 1H), 6.21(dd,J=1.4 Hz, 21.8 Hz, 1H), 6.85(d,J=8.8 Hz, 2H), 7.45(dd,J=1.2 Hz, 8.8 Hz, 2H);13C NMRδ: 16.3, 55.3, 62.2, 113.8, 128.0, 130.1, 138.0, 139.7, 159.7; HR-MS(ESI)m/z: Calcd for C13H19O4P{[M+H]+} 271.110 1, found 271.109 3。
1f: 黄色液体,产率74%;1H NMRδ: 1.30(t,J=7.0 Hz, 6H), 4.08~4.17(m, 4H), 6.33(dd,J=1.4 Hz, 23.0 Hz, 1H), 6.44(dd,J=1.2 Hz, 47.6 Hz, 1H), 7.20(t,J=0.8 Hz, 2H), 7.42(d,J=8.0 Hz, 1H), 7.68(d,J=2.0 Hz, 1H), 7.86(d,J=7.6 Hz, 1H), 8.45(b, 1H);13C NMRδ: 15.2, 61.3, 110.3, 110.6, 118.7, 119.4, 121.4, 124.6, 125.9, 130.1, 131.9, 135.5; HR-MS(ESI)m/z: Calcd for C14H19NO3P{[M+H]+} 280.106 5, found 280.106 3。
2 结果与讨论
2.1 催化剂对反应的影响
以合成1a为模板,考察金属催化剂对产率的影响,结果见表1。由表1可见,在反应中加入金属催化剂时,反应的最高产率达84%。但无催化剂,产率也能达84%(表2),说明不加金属催化剂更好。
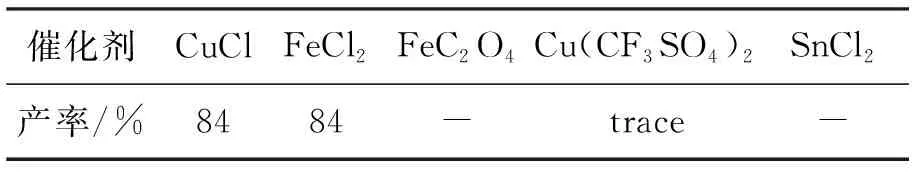
表1 金属催化剂对1a产率的影响*
*CH2Cl2为溶剂,其余反应条件同1.2

表2 溶剂对1a产率的影响*
*溶剂3 mL,反应条件同1.2
2.2 溶剂对反应的影响
不加催化剂,其余反应条件同1.2,考察溶剂对1a产率的影响,结果见表2。由表2可知,极性分子在微波辐射下吸收能量,通过分子的偶极作用体系内部分子运动摩擦产热,使反应速度加快,副产物减少。最佳溶剂为CH2Cl2。
[1] Hideki Inoue, Hiroshi Tsubouchi,Yasu Nagaoka,etal.Synthesis of allenes by double Horner-Wadsworth-Emmons reaction[J].Tetrahedron,2002,58:83-90.
[2] Youngim Na, Soyoung Park, Soo Bong Ha,etal.Ruthenium-catalyzed Heck-type olefination and Suzuki coupling reactions:Studies on the nature of catalytic species[J].J Am Chem Soc,2004,126:250-258.
[3] Yibo Xu, Michael T Flavin, Ze-Qi Xu.Preparation of new Wittig reagents and their application to the synthesis ofα,β-unsaturated phosphonates[J].J Org Chem,1996,61:7697-7701.
[4] Xavier C,Cristina C G,Kathryn H.Mesylate derivatives of .alpha.-hydroxy phosphonates.Formation of carbocations adjacent to the diethyl phosphonate group[J].J Am Chem Soc,1983,105:2851-2858.
[5] Li B H,Masato T.Palladium-catalyzed hydrophosphorylation of alkynes via oxidative addition of HP(O)(OR)2[J].J Am Chem Soc,1996,118:1571-1572.
[6] Ryo T,Yasushi T,Massayuki F,etal.Platinum complex catalyzed carbonylation of organic iodides.Effective carbonylation of organic iodides having .beta.-hydrogens on saturated sp3carbons[J].J Org Chem,1989,54:1831-1836.
