新型8-羟基喹啉铁配合物的合成及其对半胱氨酸和高半胱氨酸的识别性能*
2011-11-27秦明林张灯青金武松
秦明林,张灯青,金武松
(东华大学 化学化工与生物工程学院,上海 201620)
半胱氨酸(Cys)和高半胱氨酸(Hcy)在生命体系中扮演着重要的角色,体内缺乏会引起很多疾病[1],因此,Cys和Hcy的检测引起了人们极大的兴趣。近年来,文献报道的探针主要是利用Cys或Hcy与主体分子间的共价作用来实现对其选择性识别[2~4],基于取代反应原理来设计Cys和Hcy的探针报道较少[5]。另外,由于比度法不用借助于任何昂贵的仪器设备直接用肉眼就能对目标分子进行识别,在近年来也引起了人们的极大兴趣[6]。
8-羟基喹啉衍生物虽然被广泛用于识别金属离子[7,8],但用于识别中性分子如氨基酸的报道相对较少[5,9]。设计并合成基于8-羟基喹啉衍生物且能够实现在中性缓冲水溶液中对氨基酸进行选择性识别的探针仍是一个挑战。为此,本文利用取代反应的原理,设计并合成了一种新型的8-羟基喹啉配合物[FeQ3,HQ=8-羟基-7-(4-甲苯二氮烯基)喹啉-5-磺酸](Scheme 1),其结构经1H NMR,13C NMR和元素分析表征。利用UV-Vis和溶液颜色的变化实现了FeQ3对Cys和Hcy的选择性裸眼识别。

Scheme1
1 实验部分
1.1 仪器与试剂
UV 1102型紫外可见分光光度计;Bruker AV 400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标); Vario EL Ⅲ型O-元素分析仪。
Hcy, Acros;其余所用试剂均为分析纯。
1.2 合成
(1) HQ的合成: 在冰盐浴(0 ℃~5 ℃)冷却的反应瓶中加入4-氨基甲苯1.07 g(10 mmol)和浓盐酸6 mL,搅拌下缓慢滴加20%NaNO2溶液20 mL,滴毕,搅拌反应至悬浮物完全变为清亮的黄色溶液。滴加8-羟基喹啉-5-磺酸2.25 g(10 mmol)的Na2CO3(25 mL,4 mol·L-1)溶液,滴毕,继续反应4 h。用盐酸中和后过滤,滤饼用乙醇重结晶得红色固体HQ 2.7 g,产率78%;1H NMRδ: 2.42(s, 3H, CH3), 7.42(d,J=8.0 Hz, 2H,ArH), 7.71(q,J=12.4 Hz, 1H,ArH), 7.91(d,J=8.4 Hz, 2H,ArH), 8.31(s, 1H, ArH), 8.94(d,J=4.0 Hz, 1H,ArH), 9.14(d,J=8.4 Hz, 1H,ArH);13C NMRδ: 23.83, 118.77, 125.14, 126.05, 129.96, 132.79, 136.27, 137.64, 139.02, 143.36, 143.82, 151.49, 152.39, 157.49; Anal.calcd for C16H13N3O4S: C 55.97, H 3.82, N 12.24; found C 55.80, H 3.96, N 12.38。
(2) FeQ3的合成: 在反应瓶中加入HQ 41 mg(0.12 mmol)的乙醇(25 mL)溶液和FeCl3·6H2O 11 mg(0.04 mmol)的水(3 mL)溶液,搅拌下回流反应3 h。旋蒸除溶,残余物用乙醇(3×3 mL)洗涤,真空干燥得红褐色固体FeQ330 mg,产率70%; Anal.calcd for C48H36N9O12S3Fe: C 53.24, H 3.35, N 11.64; found C 53.01, H 3.57, N 11.32。
2 结果与讨论
2.1 UV-Vis
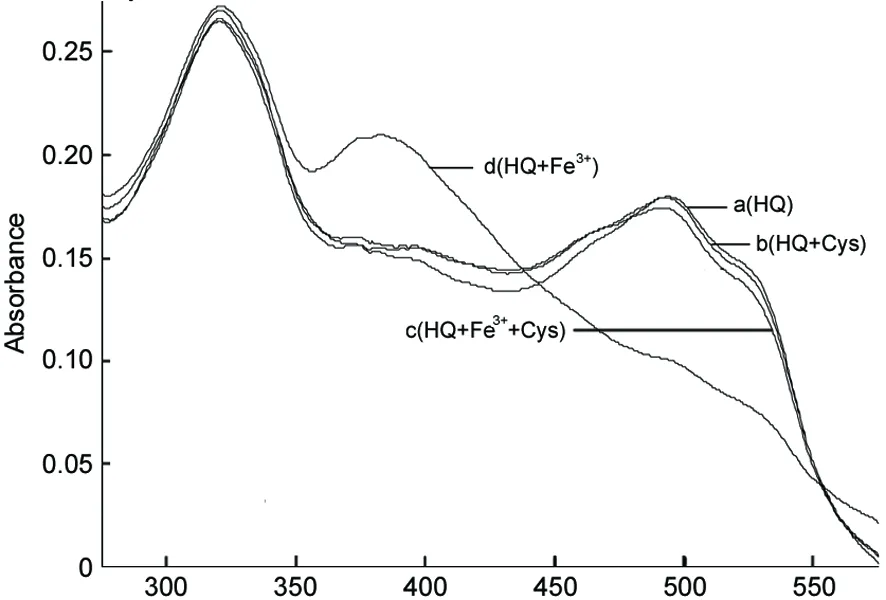
Fe3+和Cys对HQ吸光性能的影响见图1。由图1可见,HQ的λmax=494 nm(lgε=3.95 M-1cm-1),加入FeCl3后,出现了383 nm的新吸收峰,同时494 nm的吸收峰下降。采用Job plot法测得HQ和Fe3+形成3∶1型配合物。向HQ溶液中加入Cys后,UV-Vis吸收光谱几乎没有变化[图1(a)和图1(b)],表明它们之间相互作用力很弱。相反,当同样量的Cys加到HQ和Fe3+的混合溶液中后,383 nm吸收峰明显下降,而494 nm的吸收峰显著增强[图1(c)和图1(d)]。加入Hcy后,HQ的光谱变化情况与加入Cys相似。以上研究结果表明:HQ和Cys或Hcy之间的相互作用高度依赖加入的Fe3+。为了更好的响应Cys和Hcy,我们对所加入的Fe3+浓度做了优化,结果表明:当Fe3+和HQ之比为1∶3时响应最灵敏。因此,下面的滴定实验均是通过加入Cys或Hcy到FeQ3(20 μM)中性缓冲水溶液中进行的。
λ/nm
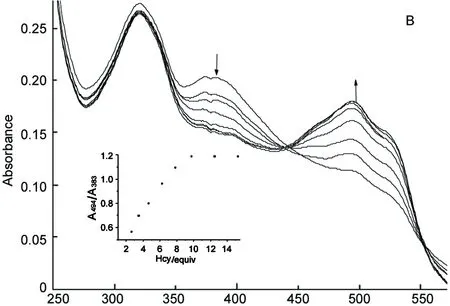
Cys或Hcy对FeQ3吸收光谱的影响见图2。由图2可见,加入Cys后,FeQ3溶液在383 nm的吸收峰逐渐下降,同时在494 nm形成红移吸收峰,相应的溶液颜色由黄色变为红色。达到滴定终点时,该体系的吸收光谱和HQ非常相似,表明Cys和FeQ3发生了取代反应,释放出HQ。加入Hcy后,FeQ3的吸收光谱和溶液颜色变化情况与加入Cys相似[图2(B)]。比度法把两个波长处吸光度的比值作为检测信号能够有效的减少环境的干扰,因此我们把494 nm和383 nm处的吸光度比值(A494/A383)对Cys或Hcy浓度做图(图2插图),从中可见随Cys或Hcy的加入,A494/A383发生明显的增强,当加入Cys或Hcy的量是FeQ3的量10倍时,达到滴定终点,A494/A383不再随Cys或Hcy量的增加而改变。

λ/nm
λ/nm
2.2 FeQ3的选择性识别
为了考察FeQ3作为Cys和Hcy探针的选择性,分别将10倍量的不同氨基酸加入FeQ3(20 μM)溶液中,实验结果显示,除了Cys和Hcy,其余氨基酸的A494/A383比值没有明显的变化,表明FeQ3与这些氨基酸的结合能力较弱,不能发生取代反应;FeQ3只对Cys和Hcy有很好的识别选择性。
对一个探针分子来说,存在可能的背景干扰组分时是否还能够特异性的识别目标物是非常关键的,因此必须做干扰性实验来检测其抗干扰能力。当10倍量的其它天然氨基酸分别与FeQ3共存时,再向其中加入Cys或Hcy,与仅存在Cys或Hcy相比,检测信号A494/A383没有明显的变化(图3)。实验事实进一步表明了FeQ3对Cys和Hcy具有良好的识别选择性。

图 3氨基酸对FeQ3的A494/A383的影响*
2.3 识别机理
根据2.2的实验结果,推测可能的反应机理为:Cys把HQ从FeQ3中置换出来从而导致了吸收光谱的移动。为了验证该反应机理,利用柱色谱法分离提纯了FeQ3和Cys反应产物,其1H NMR谱图与HQ的一致,证明在识别过程中发生了取代反应。
3 结论
基于取代反应原理,本文设计并合成了Fe3+配合物FeQ3。利用UV-Vis考察了FeQ3对天然氨基酸和高半胱氨酸的识别能力。研究结果表明:在中性缓冲水溶液中,Cys和Hcy能够将HQ从FeQ3中置换出来,恢复HQ自由状态,体系最大吸收峰由383 nm红移至494 nm,溶液颜色由黄色变为红色,从而实现对Cys和Hcy的裸眼识别。通过竞争实验表明其它的天然氨基酸不会对半胱氨酸和高半胱氨酸的识别产生干扰。FeQ3为具有潜在应用前景的Cys和Hcy光化学探针。
[1] Shahrokhian S.Lead phthalocyanine as a selective carrier for preparation of a cysteine-selective electrode[J].Anal Chem,2001,73(24):5972-5978.
[2] Wang W H, Rusin O, Xu X Y,etal.Detection of homocysteine and cysteine[J].J Am Chem Soc,2005,127(45):15949-15958.
[3] Lin W Y, Long L L, Yuan L,etal.A ratiometric fluorescent probe for cysteine and homocysteine displaying a large emission shift[J].Org Lett,2008,10(24):5577-5580.
[4] Zhang X J, Ren X S, Xu Q H,etal.One- and two-photon turn-on fluorescent probe for cysteine and homocysteine with large emission shift[J].Org Lett,2009,11(6):1257-1260.
[5] Zhang D Q.Highly selective colorimetric detection of cysteine and homocysteine in water through a direct displacement approach[J].Inorg Chem Commun,2009,12(12):1255-1258.
[6] Chen X Q, Zhou Y, Peng X J,etal.Fluorescent and colorimetric probes for detection of thiols[J].Chem Soc Rev,2010,39(6):2120-2135.
[7] Farruggia G, Lotti S, Prodi L,etal.8-Hydroxyquinoline derivatives as fluorescent sensors for magnesium in living cells[J].J Am Chem Soc,2006,128(1):344-350.
[8] Palacios M A, Wang Z, Montes V A,etal.Hydro xyquinolines with extended fluorophores:Arrays for turn-on and ratiometric sensing of cations[J].Chem Commun,2007,(36):3708-3710.
[9] Wang H, Wang W S, Zhang H S.Spectrofluorimetic determination of cysteine based on the fluorescence inhibition of Cd(Ⅱ)-8-hydroxyquinoline-5-sulphonic acid complex by cysteine[J].Talanta,2001,53(5):1015-1019.
