新型有机二氟化硼配合物的合成及其荧光性能*
2011-11-27马儒政
杨 曦,马儒政,夏 敏
(浙江理工大学 化学系,浙江 杭州 310018)
近年来,有机二氟化硼配合物因其优异的荧光性能和良好的生物相容性在化学与生物学领域应用广泛[1]。根据硼原子与配位齿的结合种类不同,该配合物主要分为三大类:以吡咯甲川母核为配体的N,N-双齿型[2~4];以β-二酮为配体的O,O-双齿型[5~7]。这两类配合物合成、性能及应用研究非常丰富。而作为这两者电子等排体的N,O-双齿型配合物的研究却较少[8~10],其中具有发光性能的配合物更是寥寥无几[11~13]。
本课题组[14]曾报道了两种以杂环性β-烯醇亚胺结构的喹喔啉酮和苯并噁嗪酮衍生物为配体的N,O-双齿型有机二氟化硼配合物,且显示了优异的荧光性能,发出强烈的翠绿和黄绿色荧光。本文在此基础上进一步设计配体结构,以2,4-二羟基苯乙酮(1)为起始原料,经4步反应合成了一种新型的N,O-双齿型二氟化硼配合物:5-甲氧基-2-(2-喹啉基)苯酚二氟化硼(5,Scheme 1),其结构经1H NMR,13C NMR和IR表征。用UV和FL研究了5的荧光性能。

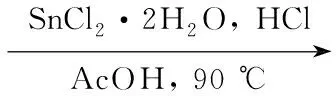
Scheme1
1 实验部分
1.1 仪器与试剂
X4型数字显微熔点仪;岛津UV-2501PC型紫外可见光谱仪;Brucker Avance Ⅱ 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet Avatar 735型傅立叶红外光谱仪(KBr压片);Perkin Elmer LS-45型荧光光谱仪。
所用试剂均为分析纯,使用前经蒸馏或重结晶纯化。
1.2 合成
(1) 2-羟基-4-甲氧基苯乙酮(2)的合成
在反应瓶中加入1 1.52 g(10 mmol)的丙酮(50 mL)溶液,搅拌下加入无水碳酸钾粉末1.38 g(10 mmol),快速搅拌下缓慢滴加硫酸二甲酯1 mL(12 mmol)的丙酮(10 mL)溶液,滴毕,回流反应12 h(TLC跟踪)。冷却至室温,加水100 mL后分液,水相用氯仿(3×15 mL)萃取,合并有机层,用无水硫酸钠干燥,旋蒸除溶后经水蒸气蒸馏得白色固体2,产率72%,m.p.52 ℃~53 ℃;1H NMRδ: 2.56(s, 3H), 3.84(s, 3H), 6.45(dd,J=8.8 Hz, 2.0 Hz, 2H), 7.63(d,J=8.8 Hz, 1H), 12.75(s, 1H); IRν: 3 340, 1 620, 1 369, 1 260, 1 208, 1 140, 1 071, 1 022, 949, 859, 814 cm-1。
(2) 1-(2-羟基-4-甲氧基苯基)-3-(2-硝基苯基)丙烯醛(3)的合成
氮气保护。在反应瓶中加入2 2.49 g(15 mmol)的THF(20 mL)溶液,搅拌下分批缓慢加入氢化钠粉末0.77 g(32 mmol),加毕,反应20 min;缓慢滴加邻硝基苯甲醛4.51 g(30 mmol)的无水THF(20 mL)溶液,滴毕,于室温反应8 h(TLC跟踪)。搅拌下倒入冰水中,用浓盐酸调至pH≈3,有大量黄色沉淀析出。抽滤,滤饼用氯仿(30 mL)溶解后用水洗涤,无水硫酸钠干燥,旋蒸浓缩后用乙醇重结晶得黄色固体3,产率42%,m.p.160 ℃~161 ℃;1H NMRδ: 3.87(s, 3H), 6.49(s, 2H), 7.43(d,J=16.0 Hz, 1H), 7.59(d,J=7.6 Hz, 1H), 7.72(t,J=8.4 Hz, 2H), 7.80(d,J=9.2 Hz, 1H), 8.09(d,J=7.6 Hz, 1H), 8.25(d,J=16.0 Hz, 1H), 13.22(s, 1H); IRν: 3 427, 2 924, 1 637, 1 579, 1 519, 1 363, 1 227, 1 136, 823 cm-1。
(3) 5-甲氧基-2-(2-喹啉基)苯酚(4)的合成
在反应瓶中加入3 1.79 g(6 mmol)的乙酸(60 mL)溶液,搅拌下于室温缓慢加入二水合氯化亚锡5.19 g(23 mmol)的浓盐酸(20 mL)溶液,于90 ℃反应4 h(TLC跟踪)。冷却至室温,缓慢滴加25%NaOH溶液至pH 9。分液,水相用氯仿(3×20 mL)萃取,合并有机层,用无水硫酸钠干燥,浓缩后用乙醇重结晶得白色固体4,产率66%,m.p.120 ℃~121 ℃;1H NMRδ: 3.86(s, 3H), 6.52(d,J=8.8 Hz, 1H), 6.59(s, 1H), 7.49(t,J=7.6 Hz, 1H), 7.70(t,J=8.0 Hz, 1H), 7.76(d,J=7.6 Hz, 1H), 7.82(d,J=8.8 Hz, 1H), 7.89(d,J=8.8 Hz, 1H), 7.96(d,J=8.4 Hz, 1H), 8.18(d,J=8.8 Hz, 1H), 15.70(s br, 1H);13C NMRδ: 55.37, 102.16, 106.64, 116.90, 126.14, 127.08, 127.51, 128.02, 130.38, 137.41, 144.54, 157.84, 162.83, 163.18; IRν: 3 433, 1 606, 1 399, 1 237, 1 120, 835, 799 cm-1。
(4) 5的合成
在反应瓶中加入4 2.51 g(10 mmol)的甲苯(15 mL)溶液,搅拌下于室温滴加三乙胺2.9 mL(21 mmol),反应15 min后滴加三氟化硼乙醚溶液2.8 mL(30 mmol),滴毕,反应45 min。过滤,滤饼用无水乙醚反复洗涤,自然晾干得黄绿色粉末5,收率83%,m.p.243 ℃~244 ℃;1H NMR(DMSO-d6)δ: 3.88(s, 3H), 6.62(m, 2H), 7.61(t,J=7.6 Hz, 1H), 7.84(m, 3H), 8.00(d,J=9.2 Hz, 1H), 8.37(d,J=9.2 Hz, 1H), 8.87(d,J=8.8 Hz, 1H);13C NMR(DMSO-d6)δ: 55.69, 102.51, 110.03, 116.69, 124.29, 124.38, 124.47, 126.98, 127.43, 128.08, 128.35, 132.73, 142.19, 152.65, 158.73, 166.06; IRν: 1 617, 1 557, 1 380, 1 263, 1 224, 1 080, 910, 833 cm-1。
2 结果与讨论
2.1 合成
邻氨基苯甲醛与取代苯乙酮在醇钠作用下发生闭环反应的Friedländer法是制备取代喹啉衍生物重要和经典的方法之一[15]。然而由于在苯乙酮乙酰基的邻对位存在两个强的斥电子基团使得羰基的反应性大大降低,碱性条件下的闭环反应难以实现。本文改用酸性条件下由相应的查尔酮衍生物3进行还原闭环的方法[16]。首先由邻硝基苯甲醛与2在碱性条件下进行缩合,得到的硝基查尔酮在酸性条件下被氯化亚锡还原为氨基查尔酮,继而发生缩合闭环反应得取代喹啉化合物4。配位前后相应化合物的熔点产生了近120 ℃的大幅升高,这间接说明了配合物分子中产生了较为明显的电荷特征,它以氮原子呈四价正电荷而硼原子呈四价负电荷的内盐形式存在。
2.2 表征
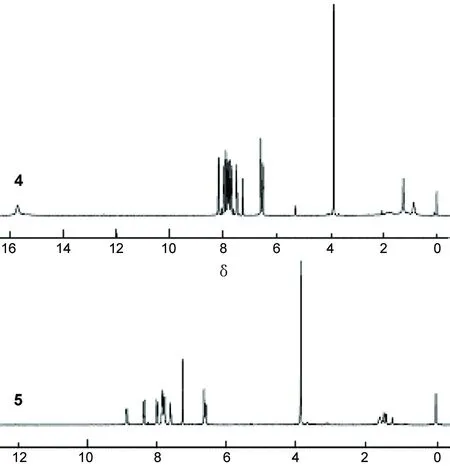
在4和5的IR谱中,最明显的变化是5在1 000 cm-1~1 100 cm-1出现了一个新的强吸收峰,归属于四配位B-O键的特征伸缩振动,说明配体已成功与硼结合。在4和5的1H NMR谱(图1)中,配位前后谱峰的最大变化是酚羟基质子信号的消失以及芳香性质子信号的化学位移大幅向低场方向移动。配体4上酚羟基质子因与喹啉氮原子形成分子内氢键,该质子的信号出现在15~16的极低场。当4以酚氧负离子的形式与硼原子络合后该质子在5的氢谱中消失。此外,喹啉氮原子在与硼原子络合后成四价正电荷形式,受其强烈的吸电子作用,与之相连的芳香性质子产生了强烈的去屏蔽效应,相应的氢谱信号明显向低场位移,同时也使得4氢谱中十分密集的质子信号在5中得到了舒展。
δ
2.3 5的荧光性能
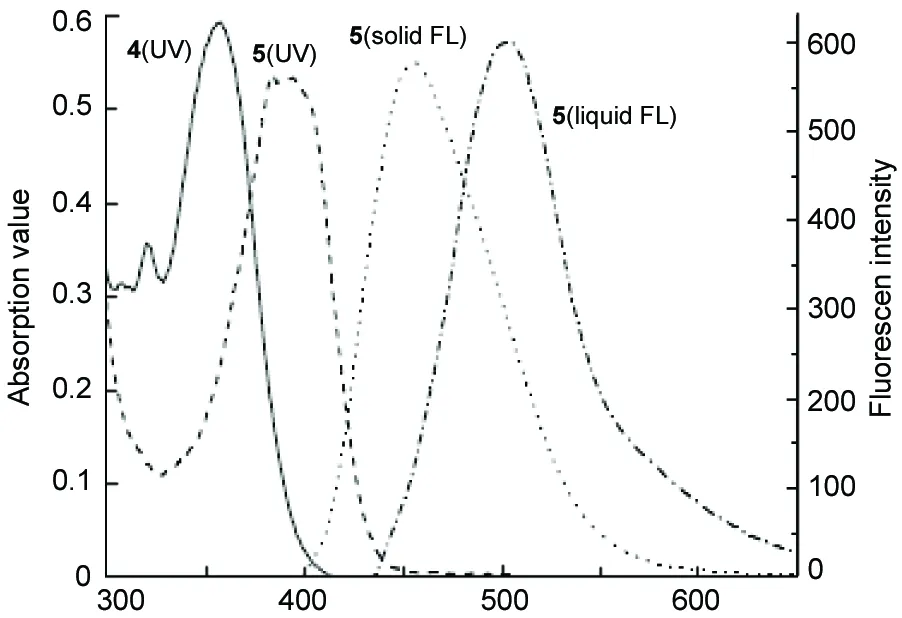
4和5的UV曲线及5的液体荧光发射曲线和固体荧光发射曲线见图2。由图2可见,配位前后相应化合物的紫外最大吸收波长向长波方向红移了约30 nm,5的摩尔吸光系数达到4.44 M-1cm-1。由于络合作用消除了喹啉环与酚环间σC-C键的自由转动,分子整体的平面性增强,π电子的离域范围扩大,从而降低了π*轨道的能量,使得π-π*跃迁能差减少,同时有更多的π电子能够受到激发,跃迁几率大大提高,因而显示出很大的吸光系数和吸收波长的红移。
λ/nm
从图2还可看出,5的液体荧光发射波长已处于可见光区,在紫外灯照射下呈现明亮而炫目的靛蓝色。以硫酸奎宁为标准(Φ=0.55,0.5 mM硫酸水溶液),采用稀溶液比较法测定5的荧光量子产物高达0.96,紫外吸收曲线与荧光发射曲线呈良好的镜像关系,说明激发态的化学性质非常稳定,没有发生光化学反应产生光解产物。Stock’s位移的幅度较大(约60 nm),说明分子骨架的刚性还不足够强,激发态能量因振动弛豫而耗散,回落到基态时以光辐射形式释放的能量减少。此外,由于在酚环上引入甲氧基增大了空间位阻,使得分子间无法产生致密堆积,减小了诸如π-π吸引等分子间相互作用,再加上较大幅度的Stock’s位移而消除了自淬灭作用,因此导致5产生强烈的固体荧光发射。与溶液荧光相比,固体荧光发射再次向长波方向红移了约50 nm,5的粉末在紫外灯照射下呈现极为明亮的黄绿色。
3 结论
以5-甲氧基-2-(2-喹啉基)苯酚为配体与三氟化硼乙醚在碱性条件下络合合成了一种结构新颖且在可见光区产生明亮的固体和溶液荧光的新型有机二氟化硼配合物5。 5具有化学性质稳定、热稳定性强、荧光量子产率高、摩尔吸光系数高、Stock’s位移大等特显;制备反应的条件温和、反应时间短、产物收率高,分离纯化快速简便。此类荧光化合物及其合成方法特别适用于发光材料、荧光探针、荧光示踪剂、信息存储介质、激光染料及光动力学癌症治疗光敏剂等的研制与开发。
[1] Yamada K, Nomura Y, Citterio D,etal.Highly sodium-selective fluoroionophore based on conformational restriction of oligoethyleneglycolbridged biaryl boron-dipyrromethene[J].J Am Chem Soc,2005,127:6956-6957.
[2] Loudet A,Burgess K.BODIPY dyes and their derivatives:Syntheses and spectroscopic properties[J].Chem Rev,2007,107:4891-4932.
[3] Ulrich G, Ziessel R, Harriman A.The chemistry of fluorescent bodipy dyes:Versatility unsurpassed[J].Angew Chem Int Ed,2008,47:1184-1201.
[4] Ziessel R, Ulrich G, Harriman A.The chemistry of bodipy:A new El dorado for fluorescence tools[J].New J Chem,2007,31:496-501.
[5] Chow Y L, Johansson C I, Zhang Y H,etal.Spectroscopic and electrochemical properties of 1,3-diketonatoboron derivatives[J].J Phys Org Chem,1996,9:7-16.
[6] Zhang G Q, Chen J B, Payne S J,etal.Multi-emissive difluoro-boron dibenzoyl-methane polylactide exhibiting intense fluorescence and oxygen-sensitive room temperature phosphorescence[J].J Am Chem Soc,2007,129:8942-8943.
[7] Ono K, Yoshikawa K, Tsuji Y,etal.Synthesis and photoluminescence properties of BF2complexes with 1,3-diketone ligands[J].Tetrahedron,2007,63:9354-9358.
[8] Itoh K, Okazaki K, Toyotomi Y.Photodimerization of enaminoketonatoboron difluorides[J].New J Chem,2002,26:1070-1075.
[9] Itoh K, Okazaki K, Chow Y L.Photocycloaddition of some difluoro(aminoenonato)boron complexes with arylalkenes[J].Helvet Chim Acta,2004,87:292-302.
[10] Macedo F P, Gwengo C, Lindeman S V,etal.β-Diketonate,β-ketoiminate,andβ-diiminate complexes of difluoroboron[J].Eur J Inorg Chem,2008:3200-3211.
[11] Hou Q F, Zhao L Y, Zhang H Y,etal.Synthesis and luminescent properties of two Schiff-base boron complexes[J].J Luminescence,2007,126:447-451.
[12] Zhou Y, Xiao Y, Chi S M,etal.Isomeric boron-fluorine complexes with donor-acceptor architecture:Strong solid/liquid fluorescence and large stokes shift[J].Org Lett,2008,10:633-636.
[13] Feng J Q, Liang B L, Wang D L,etal.Novel fluorescent dyes with fused perylene tetracarboxlic diimide and BODIPY analogue structures[J].Org Lett,2008,10:4437-4440.
[14] Xia M, Wu B, Xiang G F.Synthesis,structure and spectral study of two types of novel fluorescent BF2complexes with heterocyclic 1,3-enaminoketone ligands[J].J Fluorine Chem,2008,129:402-408.
[15] Jack L J.有机人名反应及机理[M].荣国斌译:上海华东理工大学出版社,2007.
[16] Barrosl A I R N A, Diasl A F R, Silva A M S.Reductive coupling reactions of 2-nitrochalcones and theirb-hydroxyanalogues:New syntheses of 2-arylquinoline and 2-aryl-4-hydroxyquinoline derivatives[J].Monatshfur Chem,2007,138:585-594.
