二茂铁功能化的水溶性金纳米粒子的合成与表征*
2011-11-27郑朝晖丁小斌彭宇行
左 芳,安 鹏,郑朝晖,丁小斌,彭宇行
(1.西南民族大学 化学与环境保护学院,四川 成都 610041; 2.中国科学院 成都有机化学研究所,四川 成都 610041)
金纳米粒子有许多优点:金是一种惰性元素,在纳米尺度范围内是最稳定的贵金属;金和硫元素之间可以形成稳定的化学键,这有利于在其表面自组装带有各种官能团的单分子层[1,2]。金纳米粒子的这些性质再结合其优异的导电性和生物相容性,独特的光电、催化特性,使其在量子物理、信息存储、生物医学和传感器领域都有着巨大的应用前景,引起了人们广泛的兴趣[3]。
二茂铁(FcH)及其衍生物作为优良的电子媒介体,其氧化还原形式能稳定存在,且具有快速可逆的电极反应动力学,它还能定量的参与某些特定物质的氧化还原反应,因此被广泛应用于电化学合成、电分析、电催化和生物传感研究领域[4,5]。FcH及其大多数衍生物的疏水特性在一定上限制了其在生物传感器领域的应用。

Scheme1
油溶性二茂铁功能化金纳米粒子的合成已有文献[6,7]报道,但水溶性的二茂铁功能化纳米粒子的相关研究还未见文献报道。为此,本文以聚乙二醇(PEG)为原料,经4步反应合成了一种端基为二茂铁的PEG硫醇配体(Fc-PEG-SH,Scheme 1);采用两相法制备了油胺(OAm)保护的金纳米粒子(OAm/nanoAu);采用配体交换法合成了一种二茂铁功能化的水溶性金纳米粒子(Fc-PEG/nanoAu),其结构和性能经UV-Vis,1H NMR,IR,TGA,XPS,TEM及循环伏安法表征和分析。
1 实验部分
1.1 仪器与试剂
Shimadzu UV-2401 PC UV-Visible型紫外光谱仪(200 nm~800 nm); Bruker AMX-300型核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet 200SXV-1型FT-IR红外光谱仪(KBr压片); TA Instrument Q50型热重分析仪(TGA,N2,0 ℃~800 ℃,升温速度10 ℃·min-1; XSAM800型多功能表面分析仪(XPS, MgKα靶,起飞角20°); Hitachi HU-11B型透射电镜仪(TEM,加速电压100 kV); HDV-7C晶体管恒电位仪和HD-1A信号发生器连用,ITO玻璃为工作电极,有效面积0.5 cm2,对电极为铂丝电极,饱和甘汞电极为参比电极,实验用溶液都经过除氧处理,且在N2保护下进行。
氯化金(HAuCl4·4H2O),硫代乙酸钾和油胺,分析纯,国药集团;硼氢化钠和PEG(M=950~1 050),分析纯,成都科龙化工试剂厂;对甲苯磺酰氯(TsCl),分析纯,中国医药集团上海化学试剂公司,用前经石油醚(60 ℃~90 ℃)重结晶;二环己基碳二亚胺(DCC),分析纯,上海佘山化学试剂厂,分析纯;4-二甲氨基吡啶(DMAP),纯度99%,成都埃斯特公司;其余所用试剂均为分析纯;所用水均为一次蒸馏水。
1.2 合成
(1) Ts-PEG-OH的合成[8]
在反应瓶中加入PEG 10.0 g(10.0 mmol)的干燥CH2Cl2(180 mL)溶液,搅拌下加入新制备的Ag2O 3.476 g(1.50 eq., 15.0 mmol)和KI 664 mg(0.40 eq., 4.0 mmol),于0 ℃搅拌30 min。迅速加入TsCl 2.0 g(1.05 eq., 10.05 mmol)的干燥CH2Cl2(20 mL)溶液,于0 ℃反应2 h。过滤(74 μm~79μm硅胶),滤液浓缩至约70 mL,在丙酮/干冰浴中,用乙醚500 mL沉淀(反复两次)得白色固体Ts-PEG-OH,产率85%;1H NMRδ: 7.76(d, 2H,ArH), 7.31(d, 2H,Ar), 4.15(t, 2H,CH2OTs), 3.86~3.39[m, (CH2OCH2)n], 3.12(t, 2H, CH2), 2.83(t, 2H, CH2), 2.63(br s, 1H,OH), 2.42(s, 3H,CH3); FT-IRν: 1 594, 1 451, 1 349, 817 cm-1。
(2) KS-PEG-OH的合成
在反应瓶中加入Ts-PEG-OH 11.7 g(10 mmol),硫代乙酸钾2.85 g(25 mmol)和DMF 50 mL,搅拌使其溶解后于室温反应7 h。蒸除溶剂至约10 mL,加水100 mL后用CH2Cl2萃取,合并萃取液,用无水硫酸钠干燥;蒸出溶剂,残余物于50 ℃干燥24 h得红棕色固体KS-PEG-OH,产率91.5%;1H NMRδ: 3.64~3.49[m, (CH2O CH2)n], 3.10(t, 2H, CH2CH2S), 3.02(t, 2H, SCH2), 2.25(s, 3H, COCH3)。
(3) Fc-PEG-KS的合成
在反应瓶中加入KS-PEG-OH 5.37 g(5 mmol),二茂铁甲酸(FCO)1.26 g(5.5 mmol), DMAP 60 mg(0.5 mmol)及CH2Cl215 mL,搅拌使其完全溶解;于室温滴加DCC 1.25 g(6.0 mmol)的CH2Cl2(15 mL)溶液,滴毕,于室温反应48 h。过滤,滤液依次用1 mol·L-1HCl溶液、饱和NaCl溶液洗涤,无水NaSO4干燥,旋蒸除剂至约10 mL,倒入200 mL冷的正己烷中沉淀,过滤,滤饼用CH2Cl2洗涤两次得红棕色固体Fc-PEG-KS,产率84%。
(4) Fc-PEG-SH的合成
在反应瓶中加入Fc-PEG-KS 514 mg(0.4 mmol)的甲醇(50 mL,经脱气除氧)溶液,通N2除氧30 min。加入甲醇钠224 mg(4.0 mmol)的甲醇(8 mL,同上)溶液,N2保护下于室温反应12 h。加入饱和NH4Cl溶液终止反应,用CH2Cl2(3×120 mL)萃取,合并萃取液,用饱和NaCl溶液洗涤,无水Na2SO4干燥;旋蒸除溶后于40 ℃真空干燥24 h后得深黄色固体Fc-PEG-SH,产率91%;1H NMRδ: 3.61[m, (H2OCH2)n], 4.17(s, 5H,η-C5H5), 4.35(s, 2H,η-C5H5CO), 4.76(s, 2H,η-C5H5CO); FT-IRν: 1 711,1 098 cm-1。
(5) OAm/nanoAu的合成
将OAm 5.0 mL溶于甲苯(45 mL)中得OAm溶液,加入HAuCl41.0 g,搅拌使其溶解得溶液A。取A 5 mL加入甲苯55 mL,搅拌下缓慢滴加新配制的NaBH4120 mg的水(12 mL)溶液(10 min);于室温剧烈搅拌2 h。分液,有机层用水洗涤两次,用甲醇沉淀、离心分离(重复两次),取上层清液得OAm/nanoAu甲苯溶液60 mL。
(6) Fc-PEG/nanoAu的合成
在反应瓶中加入OAm/nanoAu甲苯溶液10 mL,强烈搅拌下加入Fc-PEG-SH 40 mg的甲苯(10 mL)溶液,于室温反应30 min后加水20 mL,继续搅拌30 min。分液,透析4 d得Fc-PEG/nanoAu水溶液(为测试方便可将水旋蒸除去得黑色固体,用于测试)。
2 结果与讨论
2.1 合成
为了避免Fc-PEG-SH中二茂铁基团被氯金酸氧化,采用两步法合成Fc-PEG-SH稳定的金纳米粒子Fc-PEG/nanoAu。首先采用甲苯/水两相法制备OAm/nanoAu,然后采用配体交换法制备Fc-PEG/nanoA。 OAm作为nanoAu的保护剂有以下好处:用OAm稳定的nanoAu甲苯溶液经甲醇沉淀后得到的粒子即使干燥后放置数天仍可以很好的分散在甲苯、二氯甲烷等有机溶剂中。另外OAm与nanoAu之间的作用较弱,很容易被硫醇配体交换下来[9,10]。在实验中当Fc-PEG-SH加入到OAm/nanoAu甲苯溶液中搅拌5 min后nanoAu即可全部转移到水层。
2.2 表征
(1) IR和1H NMR
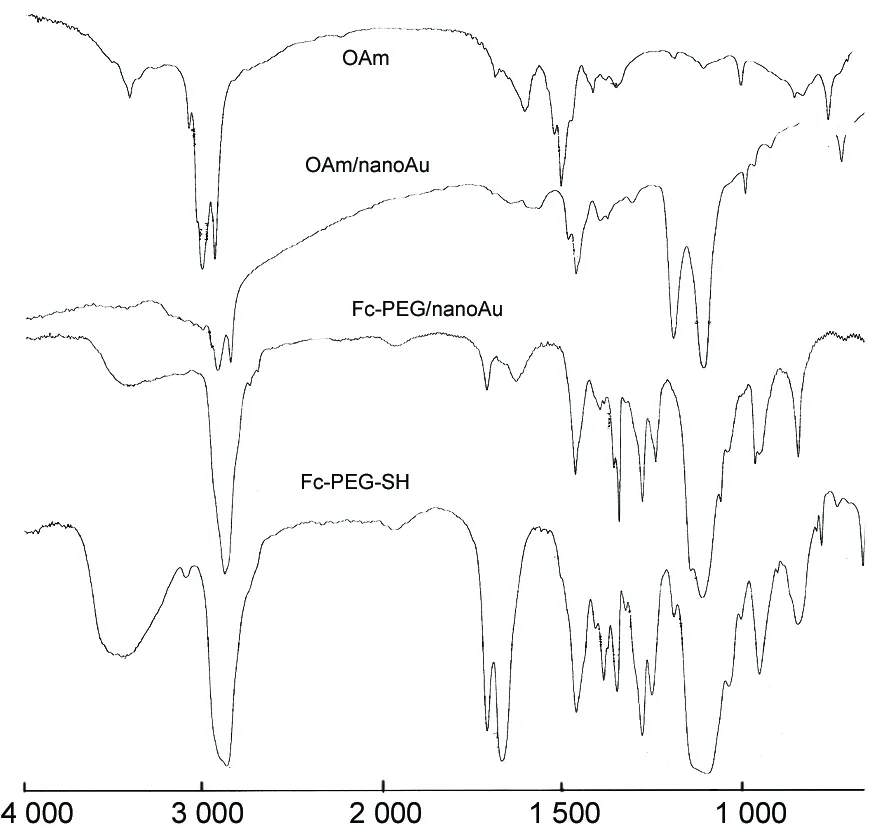
OAm, OAm/nanoAu, Fc-PEG/nanoAu及Fc-PEG-SH的IR谱图见图1。
ν/cm-1
对比Fc-PEG/nanoAu和OAm/nanoAu的IR谱图可知,3 002 cm-1,1 642 cm-1和1 567 cm-1处OAm特征峰消失,而在1 708 cm-1和1 111 cm-1处分别出现了羰基和醚键吸收峰,且它们与Fc-PEG-SH的羰基和醚键吸收峰一致。说明Fc-PEG-SH将OAm全部置换掉,并成功接枝到nanoAu表面。其次,Fc-PEG/nanoAu与Fc-PEG-SH的1H NMR谱图(图2)比较,Fc-PEG/nanoAu谱图上与Fc-PEG-SH相对应的位置出现了质子信号,但是由于分子之间互相靠近,Fc-PEG/nanoAu的氢谱变得钝而宽,进一步说明二茂铁基团成功地引入到nanoAu表面。
(2) TGA和XPS
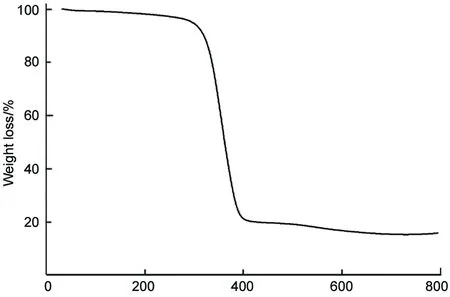
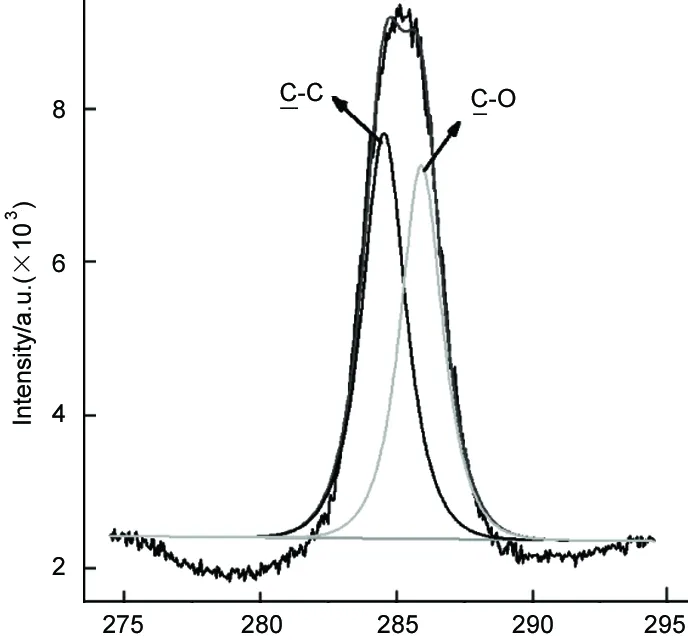
图3为Fc-PEG/nanoAu的TGA曲线。由图3可知,Fc-PEG/nanoAu表面有机物含量将近75%,测试前Fc-PEG/nanoAu溶液经过透析处理,物理吸附的配体基本上通过透析方法除去,表明Fc-PEG/nanoAu表面的有机层比较厚。采用XPS对Fc-PEG/nanoAu中的元素组成进行了分析(图4)。从图4可以看出,全谱中出现O 1s(533 eV),C 1s(287 eV),S 2p(163.5 eV,二硫化物),Au 4f(86 eV)这四种元素的特征信号,但是相对C和O元素而言,Au的信号较弱,与TGA结果一致也说明了Fc-PEG/nanoAu表面有机层较厚,从而使得Au元素不易被检测到,并且C单谱中出现了C-O的特征信号,证实Fc-PEG/nanoAu表面PEG的存在。

δ
Temperature/℃
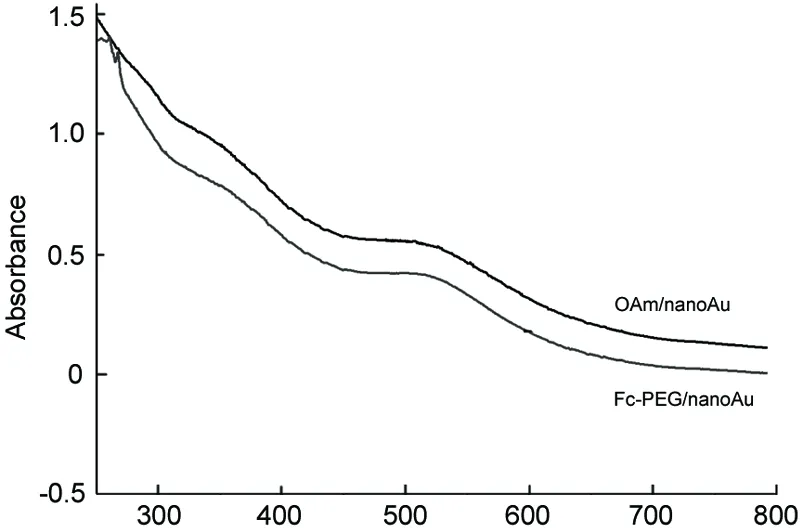
(3) UV-Vis和TEM
用UV-Vis和TEM对OAm/nanoAu和Fc-PEG/nanoAu的粒径及其分散状态进行了考察(图5和图6)。从图5可见,OAm/nanoAu在甲苯溶液中的SPR最大吸收波长在512 nm,而Fc-PEG/nanoAu在515 nm,基本没有变化,并且峰形一致,说明配体交换前后nanoAu的粒径及分散状态没有改变,这也可以从两种nanoAu都具有相同的酒红色加以证明。由图6可知,经过配体交换后,Fc-PEG/nanoAu粒子尺寸和形状基本保持不变,粒子分散均匀,粒径均一,粒径在4 nm左右;粒子形状接近球形,无团聚发生,分散性很好。

B.E./eV
B.E./eV
λ/nm

OAm/nanoAu Fc-PEG/nanoAu
2.3 电化学分析
图7是Fc-PEG/nanoAu和Fc-PEG-SH的循环伏安曲线。由图7可见,固载于金纳米粒子表面的二茂铁基团的氧化电位较之Fc-PEG-SH中的氧化电位降低,氧化电位降低可能由于纳米金颗粒小尺寸效应的影响,使其发生漂移。表明纳米金颗粒促进了二茂铁的氧化还原反应,降低了活化能,促进了内电荷向电极表面的转移,使反应需要较小的电势[11,12]。

E/mV vs.SCE
3 结论
采用配体交换法成功的合成了一种水溶性的二茂铁功能化的金纳米粒子,透射电镜分析结果显示,这种纳米粒子的粒径在4 nm左右,且分散良好。循环伏安实验结果表明二茂铁组装到金纳米粒子表面后,其氧化电位降低,这是因为金纳米粒子可以提高体系中的电子转移速率。这种具有氧化还原活性的金纳米粒子可以作为标记物应用于生物免疫传感器中。此外PEG包覆的金纳米粒子在医学、生物传感等领域有应用前景。因此,该二茂铁功能化的水溶性金纳米粒子的制备是一项很有意义的工作。
[1] Brust M, Walker M, Bethell D,etal.Synthesis of thiol derivatised gold nanoparticles in a two-phase liquid-liquid system[J].J Chem Soc,Chem Commun,1994,7:810-811.
[2] Brust M, Fink J, Bethell D,etal.Synthesis and reactions of functionalised gold nanoparticles[J].J Chem Soc,Chem Commun,1995,(16):1655-1656.
[3] Daniel D C, Astruc D. Gold nanoparticles:Assembly, supramolecular chemistry,quantum-size-related properties,and applications toward biology,catalysis,and nanotechnology[J].Chem Rev,2004,104(1):293-346.
[4] Huang X, Im H S, Lee D H,etal.Ferrocene functionalized single-walled carbon nanotube bundles hybrid interdigited construction film for L-glutamate detection[J].J Phys Chem C,2007,111(3):1200-1206.
[5] Qiu J, Peng H, Liang R.Ferrocene-modified Fe3O4@SiO2magnetic nanoparticles as building block for construction of reagentless enzyme-based biosensors[J].Electrochem Commun,2007,9:2734-2738.
[6] Li D, Li J.Self-assembly of 4-ferrocene thiophenol ca pped electroactive gold nanoparticles onto gold electrode[J].Surface Science,2003,522(1-3):105-111.
[7] Chen S.Electrochemical studies of langmuir-blodgett thin films of electroactive nanoparticles[J].Langmuir,2001,17(21):6664-6668.
[8] Shenoy I, Fu W, Li J,etal.Surface functionalization of gold nanoparticles using heterro-bifunctional poly(ethylene glycol) spacer for intracellular tracking and dellivery[J].Int J Nanomedicine,2006,1(1):51-57.
[9] Hiramatsu H, Osterloh F E.A simple large-scale synthesis of nearly monodisperse gold and silver nanaoparticles with adjustable sizes and with exchangeable surfactants[J].Chem Mater,2004,16(13):2509-2511.
[10] Chen M, Feng Y G, Wang X,etal.Silver nanoparticles capped by oleylamine:Formation,growth,and self-organization[J].Langmuir,2007,23(10):5296-5304.
[11] Horibe T, Zhang J, Oyama M.Effects of capping reagents on the electron transfer reactions on gold nanoparticle-attached indium tin oxide electrodes[J].Electroanalysis,2007,19(7-8):847-852.
[12] Cheng W, Dong S, Wang E.Gold nanoparticles as fine tuners of electrochemical properties of the electrode/solution interface[J].Langmuir,2002,18(25):9947-9952.
