青藤碱A环衍生物的合成
2011-11-26郑兴良张宏志蒋宁飞陈淑君欧阳玲玲
郑兴良,张宏志,蒋宁飞,陈淑君,欧阳玲玲
(1.长沙理工大学化学与生物工程学院,中国 长沙 410114;2.玉林师范学院化学系, 中国 玉林 53700)
青藤碱(sinomenine)是从植物青风藤中分离得到的异喹啉类生物碱,长期的临床药效试验证明其具有抗炎、免疫、镇痛、降压、抗心律失常等多种生理活性[1].近年来还有用于治疗慢性肾炎[2]、抗氧化[3]、抗肿瘤[4]、戒毒[5]的报道.青藤碱药物制剂在临床上用于治疗类风湿性关节炎及心律失常,且取得良好疗效.青藤碱凝胶制剂在动物透皮吸收及药效试验研究中的结果表明青藤碱对局部前列腺素(GP)的合成和释放有密切关系[6-7].青藤碱还具有选择性抑制环氧化酶2(COX-2)的作用[8],这可能是其具有抗炎镇痛作用强而副作用相对较小的主要机制之一.研究表明青藤碱主要通过调节细胞炎症介质和控制细胞因子合成发挥抗炎、抗风湿作用[9-12],但是,青藤碱在临床上其用药剂量偏大,具有明显的组胺释放作用,从而引起过敏性副作用,因此,对青藤碱的结构进行修饰与优化,以寻求高效低毒的新一代青藤碱衍生物具有重要意义.
近几年来,有关青藤碱的结构修饰报道越来越多,Yukio等[13]报道,以青藤碱为先导化合物,通过结构修饰合成了具有抗肿瘤活性的吗啡喃衍生物,罗烈[14]等报道,在青藤碱A环4-位引入甲氧基和乙氧基,或将酚羟基进行酰化,得到的新化合物具有较好的药效,而且过敏作用比青藤碱有所降低,但是合成醚化物的产率很低,由于青藤碱A环4-位酚羟基也可能是对过敏性反应起作用的因素之一,而且游离酚羟基很容易被氧化,在人体服用后更容易被代谢氧化分解,这会增大用药量,而大剂量用药会引起更重的过敏性副作用,所以,我们想探索更好的合成A环4-位醚化物方法,合成一些新的醚化衍生物,为寻求新的青藤碱药物奠定基础.这里我们报道一种高选择性的合成青藤碱A环醚化衍生物的方法,参照Mitsunobu方法[15],将青藤碱与对应的脂肪醇或苄醇反应,将A环4-位上酚羟基高选择性地进行醚化反应,合成了7个青藤碱A环衍生物,并对合成的化合物进行了结构表征,有关生物活性正在研究过程中,合成路线见图1.
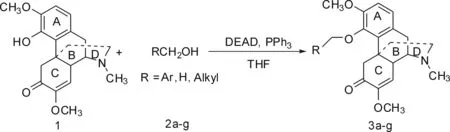
图1 青藤碱A环衍生物的合成
1 实验部分
1.1 试剂与仪器
试剂:盐酸青藤碱由湖南正清制药集团股份有限公司提供,纯度为化学纯,其他所用的试剂均为市售分析纯或化学纯试剂.
仪器:熔点用 SGW X-4 型熔点仪测定,温度计未经校正;1H NMR 用 Varian Merucry 300型 300 MHz 核磁共振仪测定;13C NMR 用 Varian Merucry 300 型核磁共振仪测定;均采用CDCl3作溶剂,TMS作内标;MS使用HP 5989A型和Bruker Daltonics ESI-BioTOFQ 型质谱仪测定;元素分析采用PE CHNS/O 2400 II元素分析仪测定.
1.2 青藤碱A环衍生物的合成
氮气保护下,在25 mL干燥的三口烧瓶中,加入0.68 g青藤碱(2.06 mmol)和1.63 g三苯基磷(6.20 mmol),加入10 mL无水THF溶解,将其放在冰浴中冷却到0 ℃以下,将预先配置好的2 mL醇反应物(6.18 mmol)和偶氮二甲酸二乙酯(0.97 mL, 6.16 mmol)四氢呋喃溶液在10~15 min内滴加到反应瓶中,然后使其自然回到室温,TLC跟踪反应,反应4.5~8 h后,蒸去THF,残渣直接用硅胶柱层析分离,先用(vCH3COOEt∶vCH2Cl2=1∶3)展开剂将三苯基氧磷分离出来,然后换用(vMeOH∶vCH2Cl2=1∶10)展开剂分离,蒸去溶剂后得到化合物(3a~3g).
3a: 产率94%, m.p. 96~97 ℃.1H NMR (CDCl3, 300 MHz): δ 7.61~7.56 (q,J1=6.0 ,J2=9.0 Hz, 2H), 7.11~7.05 (t,J=7.7 Hz, 2H), 6.79~6.76 (d,J=8.7 Hz, 1H), 6.75~6.72 (d,J=8.7 Hz, 1H), 5.52~5.51 (d,J=2.1 Hz, 1H), 5.26~5.22 (d,J=11.5 Hz, 1H), 5.03~4.99 (d,J=11.5 Hz, 1H), 4.14~4.08 (d,J=15.9 Hz, 1H), 3.80 (s, 3H), 3.51 (s, 3H), 3.16~3.14 (t,J= 6.2 Hz, 1H), 3.04~2.95 (m, 2H), 2.78~2.70(dd,J1= 4.8,J2=17.7 Hz, 1H), 2.40 (s, 1H), 2.45~2.43 (m, 1H), 2.40 (s, 3H), 1.97~1.90(m, 1H); 1.83~1.79(m, 2H);19F NMR (CDCl3, 300 MHz): δ 115.31~115.37 (p, 1F);13C NMR (CDCl3, 300 MHz): δ 194.1, 152.4, 151.4, 147.2, 134.1, 134.0, 130.1, 129.9, 129.8, 122.99, 115.5, 115.2, 114.9, 111.0, 72.3, 56.3, 55.5, 54.7, 49.7, 46.9, 46.0, 42.6, 40.8, 37.0, 24.5; MS-EI(m/z): 437 ([M]+); C26H28FNO4元素分析: C, 71.37; H, 6.45; F, 4.34; N, 3.20. 实测值: C, 71.22; H, 6.17; F, 3.99; N, 3.11.
3b: 产率86%, m.p. 109~111 ℃.1H NMR (CDCl3, 300 MHz): δ 7.53~7.50 (d,J=8.8 Hz, 2H), 7.36~7.33 (d,J=10.2 Hz, 2H), 6.77~6.73 (d,J=12.3 Hz, 1H), 6.73~6.70 (d,J=12.3 Hz, 1H), 5.49 (s, 1H), 5.25~5.21 (d,J=11.4 Hz, 1H), 5.01~4.98 (d,J=11.4 Hz, 1H), 4.07~4.02 (d,J=15.9 Hz, 1H), 3.77 (s, 3H), 3.49 (s, 3H), 3.15 (s, 1H), 3.02~2.96 (d,J=17.7 Hz, 2H), 2.77~2.69(dd,J1= 4.8,J2=12.9 Hz, 1H), 2.49~2.40 (m, 2H), 2.39 (s, 3H), 1.97~1.90(m, 1H); 1.83~1.80(m, 2H);13C NMR (CDCl3, 300 MHz): δ 194.0, 152.4, 151.4, 147.1, 136.8, 133.1, 129.9, 129.2, 128.3, 122.9, 115.3, 111.0, 93.5, 72.2, 56.3, 55.5, 54.7, 49.7, 46.8, 45.8, 42.5, 40.8, 36.9, 24.4; MS-EI(m/z): 453 ([M]+); C26H28ClNO4元素分析: C, 68.79; H, 6.22; Cl, 7.80; N, 3.08. 实测值: C, 68.62; H, 6.07; Cl, 7.59; N, 3.13.
3c: 产率 85%, m.p. 108~110 ℃.1H NMR (CDCl3, 300 MHz): δ 7.53~7.50 (d,J=8.4 Hz, 2H), 7.48~7.45 (d,J=8.4 Hz, 2H), 6.78~6.76 (d,J=8.4 Hz, 1H), 6.74~6.71 (d,J=8.4 Hz, 1H), 5.49 (s, 1H), 5.25~5.21 (d,J=11.4 Hz, 1H), 5.01~4.97 (d,J=11.4 Hz, 1H), 4.07~4.02 (d,J=15.6 Hz, 1H), 3.77 (s, 3H), 3.50 (s, 3H), 3.14~3.16 (dd,J1= 5.2,J2= 4.1 Hz, 1H), 3.03~2.96 (d,J= 17.7 Hz, 2H,), 2.79~2.71(dd,J1= 5.4,J2=18.1 Hz, 1H), 2.51~2.42 (m, 2H), 2.41 (s, 3H), 1.99~1.81(m, 3H);13C NMR (CDCl3, 300 MHz): δ 194.1, 152.5, 151.5, 147.2, 137.4, 131.4, 130.0, 129.9, 129.7, 123.1, 121.4, 115.3, 111.3, 72.3, 56.5, 55.6, 54.8, 49.8, 46.9, 45.9, 42.6, 40.8, 37.0, 24.6; MS-EI(m/z): 499 ([M]++1). C26H28BrNO4元素分析: C, 62.65; H, 5.66; Br, 16.03; N, 2.81. 实测值: C, 62.61; H, 5.79; Br, 16.01; N, 2.62.
3d: 产率78%, m.p. 137~139 ℃.1H NMR (CDCl3, 300 MHz): δ 7.72~7.69 (d,J=11.4 Hz, 2H), 7.36~7.33 (d,J=8.4 Hz, 2H), 6.77~6.75 (d,J=8.4 Hz, 1H), 6.73~6.70 (d,J=8.4 Hz, 1H), 5.49 (s, 1H), 5.23~5.19 (d,J=11.4 Hz, 1H), 4.99~4.96 (d,J=11.4 Hz, 1H), 4.06~4.01 (d,J=16.5 Hz, 1H), 3.76 (s, 3H), 3.49 (s, 3H), 3.14~3.13 (d,J=4.2 Hz, 1H), 3.02~2.96 (d,J=18.0 Hz, 2H), 2.77~2.69(dd,J1= 4.8,J2=13.2 Hz, 1H), 2.50~2.45 (m, 2H), 2.40 (s, 3H), 1.97~1.91 (m, 1H); 1.83~1.80(m, 2H);13C NMR (CDCl3, 300 MHz): δ 194.0, 152.4, 151.4, 147.1, 138.1, 137.3, 137.2, 130.1, 129.8, 123.1, 115.4, 111.1, 93.0, 72.3, 56.4, 55.5, 54.7, 49.7, 46.9, 45.9, 42.5, 40.9, 37.0, 24.4; MS-ESI(m/z): 546 ([M]++1). C26H28INO4元素分析: C, 57.25; H, 5.17; I, 23.26; N, 2.56. 实测值: C, 57.12; H, 4.98; I, 23.03; N, 2.45.
3e: 产率90%, m.p. 127~129 ℃.1H NMR (CDCl3, 300 MHz): δ 7.60~7.57 (d,J=7.8 Hz, 2H), 7.41~7.25 (m, 3H), 6.77~6.75 (d,J=8.1 Hz, 1H), 6.74~6.71 (d,J=8.1 Hz, 1H), 5.49 (s, 1H), 5.28~5.24 (d,J=14.4 Hz, 1H), 5.09~5.05 (d,J=14.4 Hz, 1H), 4.17~4.11 (d,J=16.2 Hz, 1H), 3.78 (s, 3H), 3.49 (s, 3H), 3.15~3.13 (d,J=4.2 Hz, 1H), 3.02~2.96 (d,J=18.0 Hz, 2H), 2.78~2.70(dd,J1= 4.8,J2=13.2 Hz, 1H), 2.48~2.44 (m, 2H), 2.40 (s, 3H), 1.97~1.91 (m, 1H); 1.83~1.80(m, 2H);13C NMR (CDCl3, 300 MHz): δ 194.0, 152.4, 151.5, 147.4, 138.3, 130.1, 130.0, 128.2, 128.0, 127.5, 122.8, 115.3, 111.2, 73.1, 56.4, 55.6, 54.7, 49.7, 47.0, 45.9, 42.5, 40.8, 37.0, 24.5; MS-EI(m/z): 419 ([M]+). C26H29NO4元素分析: C, 74.44; H, 6.96; N, 3.34. 实测值: C, 74.14; H, 6.77; N, 3.33.
3f: 产率88%, m.p. 112~114 ℃(111~113 ℃)[11].
3g: 产率83%, m.p. 119~121 ℃(119~121 ℃)[11].
2 结果与讨论
2.1 Williamson醚合成法合成青藤碱A环羟基衍生物
青藤碱分子中有4个环,称之为A、B、C、D环,A环是1个芳香环,环上有1个甲氧基和1个酚羟基基团,由于酚羟基容易被空气氧化,所以,将酚羟基酰化或者醚化可以减缓其被氧化的速度.对于酚的醚化,常用的方法是Williamson醚合成法,为此,我们对该方法进行了尝试,实验中以无水碳酸钾作为碱,加入相应的卤代烃,在溶剂中反应,反应表示如图 2,实验结果如表1所示.
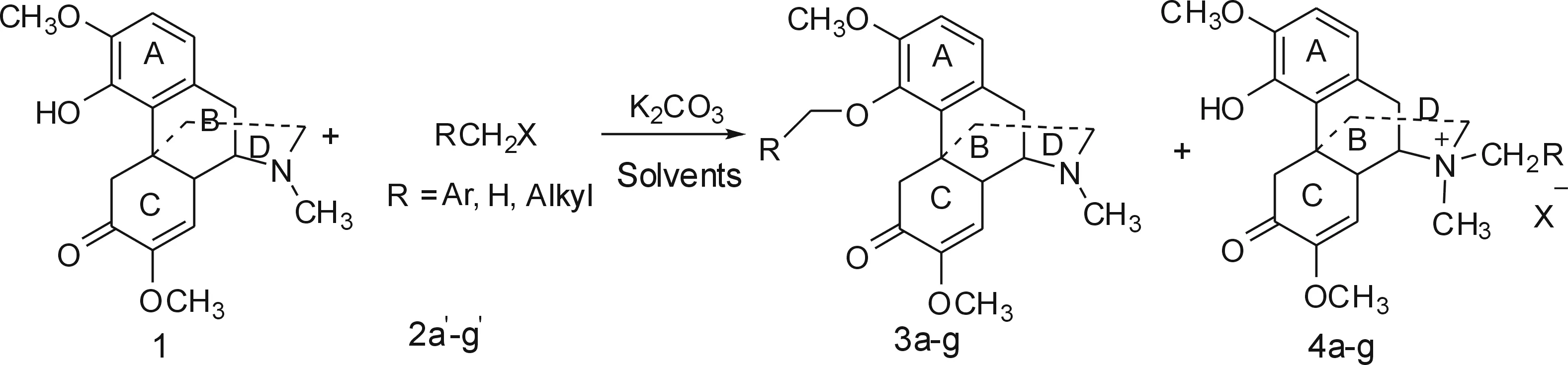
图2 Williamson法合成青藤碱A环羟基衍生物
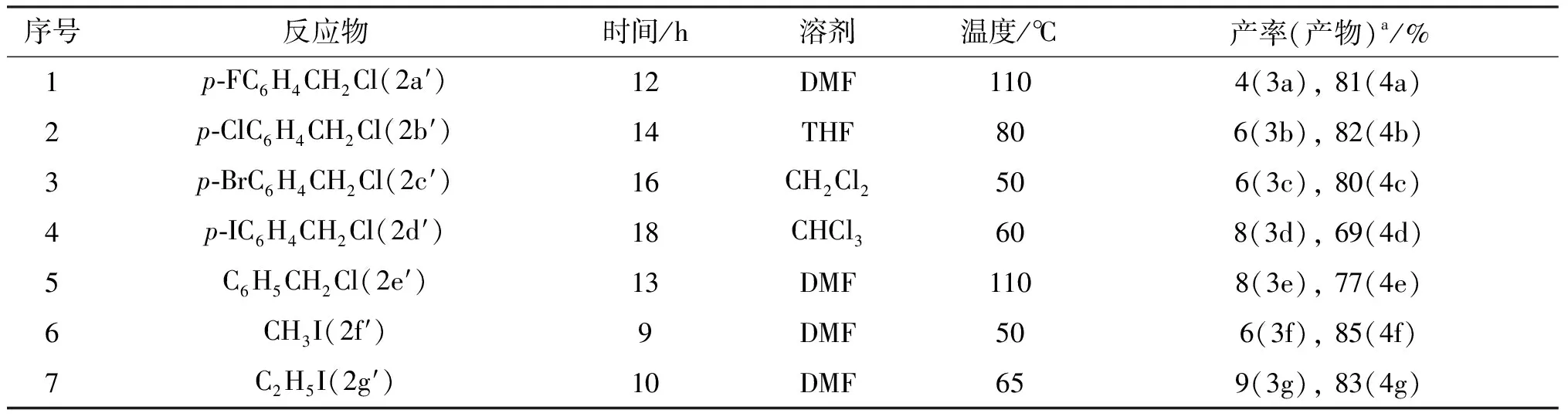
序号反应物时间/h溶剂温度/℃产率(产物)a/%1p-FC6H4CH2Cl(2a′)12DMF 1104(3a), 81(4a)2p-ClC6H4CH2Cl(2b′)14THF 806(3b), 82(4b)3p-BrC6H4CH2Cl(2c′)16CH2Cl2 506(3c), 80(4c)4p-IC6H4CH2Cl(2d′)18CHCl3 608(3d), 69(4d)5C6H5CH2Cl(2e′)13DMF 1108(3e), 77(4e)6CH3I(2f′)9DMF 506(3f), 85(4f)7C2H5I(2g′)10DMF 659(3g), 83(4g)
a产物产率均是经柱层析分离后获得.
实验结果表明,无论是延长反应时间还是提高反应温度,或者改变溶剂,所得到的醚化产物的收率都很低,经过分析,反应主要发生在17-位的氮原子上,大部分产物是季铵盐.
2.2 Mitsunobu方法合成青藤碱A环羟基衍生物
参照Mitsunobu方法,对青藤碱A环4-位酚羟基进行醚化反应,反应是在三苯基磷和偶氮二甲酸二乙酯促进下完成的,为了优化反应条件,我们选择了一种底物(2a)作为研究对象,探索了温度、溶剂、反应时间对反应的影响,实验结果如表2所示.
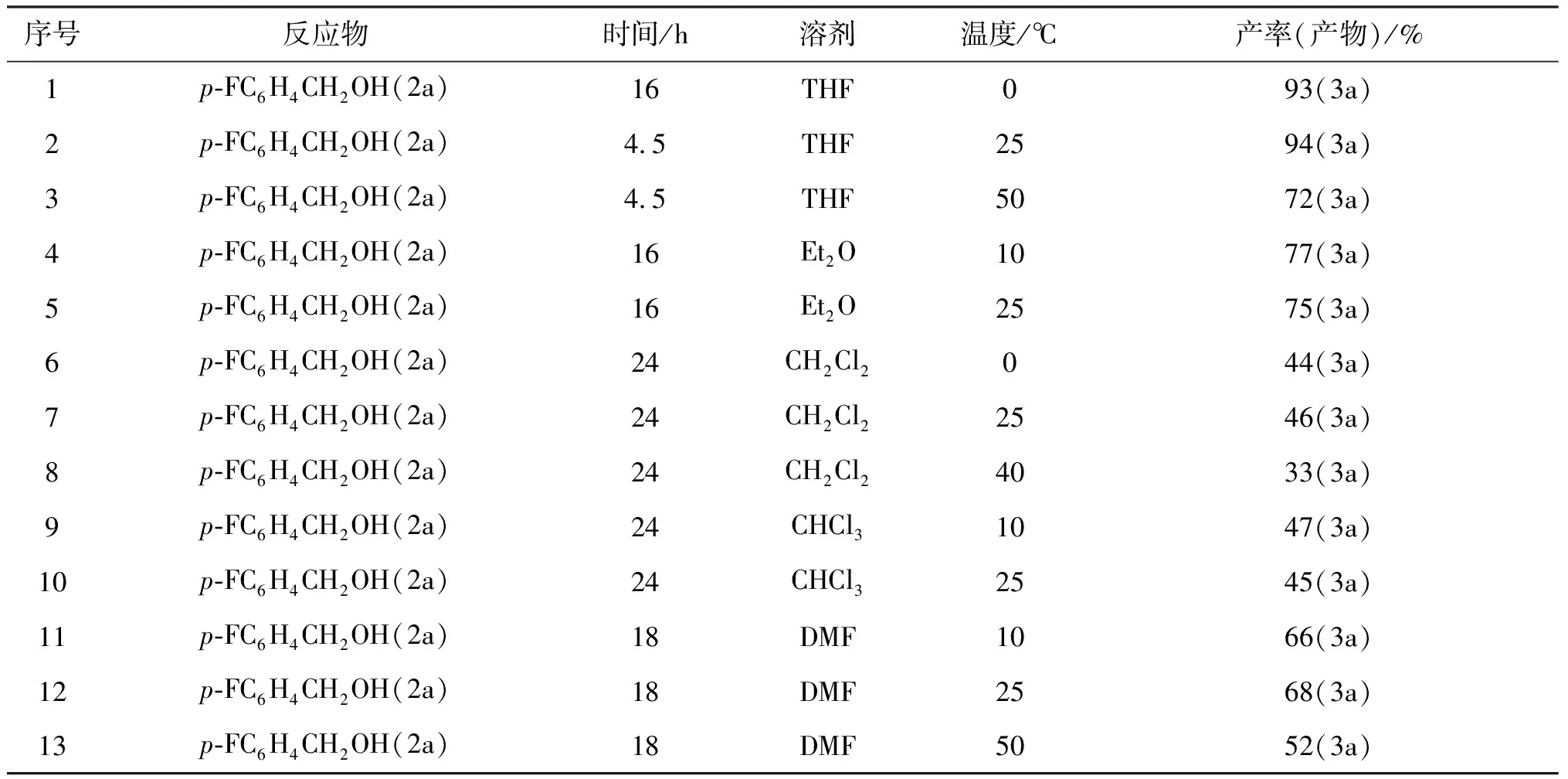
表2 在Mitsunobu方法中反应条件对反应结果的影响
实验结果表明,反应在THF溶剂中进行效果是最好的,收率高,副反应少,温度对反应有影响,超过室温反应产率反而有所下降,所以,我们确定反应的最佳条件是以THF为溶剂,在室温下反应.以不同的脂肪醇或芳香醇作为底物与青藤碱反应,在这种反应条件下,反应具有很好的选择性,反应只发生在A环4-位酚羟基上,并没有检测到有季铵化产物,以良好的收率得到醚化产物,实验结果如表 3所示.
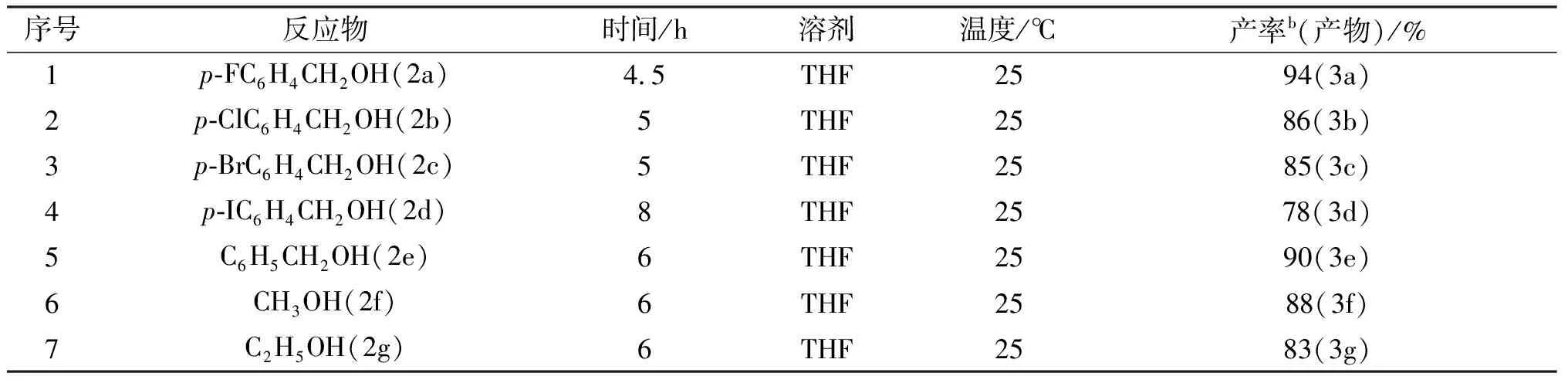
表3 在Mitsunobu方法中青藤碱与不同醇反应的结果
b产物产率是经柱层析分离后获得.
3 结论
参照Mitsunobu方法,以THF为溶剂,三苯基磷和偶氮二甲酸二乙酯做脱水剂,在室温下反应,高选择性,高收率获得了青藤碱的系列醚化产物,无论是脂肪醇还是芳香醇都能够顺利地与青藤碱发生醚化反应,这种醚合成方法在多官能团天然产的结构修饰中有很好的使用价值和应用前景.
参考文献:
[1] 刘 强,周莉玲,李 锐.青藤碱的研究概况[J].中草药,1997,28(4): 247-249.
[2] 仇 萍,邱赛红. 青藤碱在制备治疗慢性肾炎药剂中的应用: CN, 1142946[P]. 1997-02-09.
[3] 孙旭光,黄宇明,仇 萍. 青藤碱的新用途: CN, 1216701[P]. 1999-05-19.
[4] 庞志功,汪宝琪.治癌药剂: CN, 1153171[P]. 1997-07-02.
[5] 陈 冲,许海芹,周 佳. 青藤碱的医药新用途: CN, 1149456[P]. 1997-05-14.
[6] 张先洲,潘细贵,罗顺德.青藤碱凝胶的制备及质量控制[J].中国药方,2003,14(5): 275-278.
[7] 霍海如,车锡平,青藤碱镇痛和抗炎作用机理的研究[J].西安医科大学学报,1989,10(4): 346-349.
[8] 王文君,王培训.青藤碱对环氧化酶2活性的选择性抑制作用[J].广州中医药大学学报,2002,19(1): 46-48.
[9] 涂胜豪,胡永红,陆付耳.青藤碱对人淋巴细胞产生 IL-2,IL-2R 和 IL-6 的影响[J].中国实验临床免疫学杂志,1998,10(5): 268-270.
[10] 刘 良,李晓娟,王培训,等.青藤碱对人外周血单个核细胞 IL-1β 和 IL-8 细胞因子基因表达的影响[J].中国免疫学杂志,2002, 18(4): 241-244.
[11] 李晓娟,王培训,刘 良,等.青藤碱抗炎抗风湿作用机理研究[J].广州中医药大学学报,2004,21(1): 34-35.
[12] 李晓娟,王培训,刘 良,等.青藤碱对T淋巴细胞活化及 HT1 类细胞内细胞因子表达的影响[J]. 中国免疫学杂志,2004,20(4): 249-254.
[13] HITOTSUYANAGI Y, NISHIMURA K, IKUTA H,etal. Syntheses of antitumor morphinane alkaloids, sinococuline and 6-epi-, 7-epi-, and 6-epi-7-epi-sinococuline from sinomenine[J]. J Org Chem, 1995, 60(8): 4549-4558.
[14] 罗 列. 青藤碱衍生物的合成及镇痛抗炎作用的定量构效关系研究[D].武汉:武汉大学,2005.
[15] MITSUNOBU O. The use of diethyl azodicarboxylate and triphenylphosphine in synthesis and transformation of natural products[J]. Synthesis, 1981, 1981(1): 1-28.
