联二萘酚衍生手性二胺催化的不对称Aldol反应*
2011-11-26张义斌倪承燕刘全忠
张义斌, 倪承燕, 刘全忠
(西华师范大学 化学化工学院,四川 南充 637002)
Aldol反应是形成碳-碳键的重要反应[1],在有机合成中占有非常重要的地位。自从List等[2]发现脯氨酸催化的Aldol反应以来,有机小分子催化的不对Aldol反应以原子经济和条件温和而受到广泛关注,并取得了令人瞩目的进展[3]。2007年程津培等[4]发现具有一级-三级胺结构的手性胺能有效催化醛与酮之间的Aldol反应;2008年冯小明等[5]发展了一类新的手性二胺催化剂,在催化Aldol种具有非常好的反应活性和立体选择性。在此基础了,我们[6]以联二萘酚为原料合成了一类性能优良的手性二胺催化剂。
Aldol反应尽管取得了极大的成功,但其底物仅限于丙酮等脂肪酮,芳酮如苯乙酮作为Aldol反应的底物仍然少见报道,因此研究Aldol反应使其具有良好的底物使用范围仍然具有重要的意义。我们设想手性二胺催化剂也许能催化苯乙酮的不对称Aldol反应。
有机化合物中氟原子取代后其物理化学性质有明显变化,往往具有独特的生物活性[7,8]。本文以手性胺2a~2j(Chart 1)和手性磷酸3a~3i(Chart 2)为催化剂,考察芳基甲基酮(1a~1f)与三氟甲基酮酸酯的不对称Aldol反应(Scheme 1)。
1 实验部分
1.1 仪器与试剂
PolAAr 3000型自动旋光仪;Bruker ADVANCE-400型核磁共振仪(CDCl3为溶剂,TMS为内标); Shimadzu SPD-20A型高效液相色谱仪[检测波长254 nm, 手性柱AD-H柱和OJ-H 柱, 流动相:V(正己烷)∶V(异丙醇)=8∶2,流速1.0 mL·min-1]。
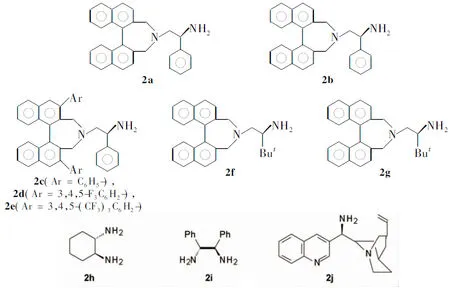
Chart 1
2a~2g[6], 3a~3i[9]按文献方法制备;三氟丙酮酸脂,Alfa公司;1a~1f,成都科龙化工;其余试剂均为分析纯。
1.2 4的合成(以4a)为例
在干燥试管中加入1a0.2 mmol和三氟丙酮酸脂0.1 mmol,搅拌下加入2 0.01 mmol和3 0.01 mmol; N2气保护,注入纯化的CH2Cl21 mL,冰水浴冷却下反应96 h。经柱层析[洗脱剂:V(石油醚)∶V(乙酸乙酯)=20∶1]分离得白色固体4a。
用类似方法合成白色固体4b~4f。
4a:1HNMRδ: 3.72(d,J=17.6 Hz, 1H), 3.78(d,J=17.6 Hz, 1H), 3.92(m, 3H), 7.50(t,J=8.0 Hz, 2H), 7.61~7.65(m, 1H), 7.94(d,J=8.4 Hz, 2H);13C NMRδ: 40.65, 54.10, 75.28(q,J=29.3 Hz), 123.10(q,J=284 Hz), 127.39, 128.35, 133.99, 135.70, 169.35, 194.78; tmajor=12.07 min, tminor=19.32 min。
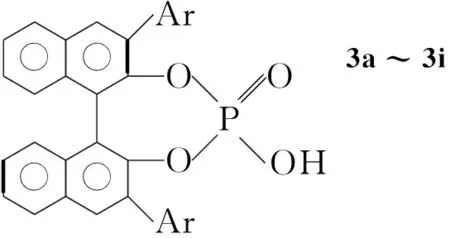
Chart2

Scheme1
4b:1H NMRδ: 3.66(d,J=17.6 Hz, 1H), 3.72(d,J=17.6 Hz, 1H), 3.89(s, 3H), 3.91(s, 3H), 6.95(d,J=8.8 Hz, 2H), 7.92(d,J=8.8 Hz, 2H);13C NMRδ: 40.25,54.01, 55.45, 75.39(q,J=29.3 Hz), 113.89, 123.10(q,J=284 Hz), 127.44, 130.47, 164.20, 169.42, 193.32; tmajor=20.10 min, tminor=34.39 min。
4c:1H NMRδ: 3.73(d,J=17.6 Hz, 1H), 3.82(d,J=17.6 Hz, 1H) 3.94(s, 3 H), 8.11(d,J=9.2 Hz, 2H), 8.35(d,J=9.2 Hz, 2H);13C NMRδ: 41.04, 54.32, 74.97(q,J=29.3 Hz), 123.20(q,J=284 Hz), 123.96, 129.17, 140.03, 150.76, 168.95, 193.17; tmajor=13.29 min, tminor=19.65 min。
4d:1H NMRδ: 3.66(d,J=17.6 Hz, 1H), 3.73(d,J=17.6 Hz, 1H), 3.92(s, 3H), 7.64(d,J=8.8 Hz, 2H), 7.80(d,J=8.8 Hz, 2H);13C NMRδ: 40.55, 54.17(q,J=29.3 Hz), 75.15, 123.00(q,J=284 Hz), 129.37, 129.52, 132.10, 134.44, 169.20, 193.73; tmajor=13.56 min, tminor=24.60 min。
4e:1H NMRδ: 3.67(d,J=17.6 Hz, 1H), 3.74(d,J=17.6 Hz, 1H), 3.91(s, 3H), 7.15~7.20(m, 2H), 7.96~8.00(m, 2H);13C NMRδ: 40.53, 54.10(q,J=29.3 Hz), 74.90, 116.40, 123.00(q,J=284 Hz), 130.82, 133.20, 166.19, 160.24, 193.16; tmajor=12.00 min, tminor=17.50 min。
4f:1H NMRδ: 3.66(d,J=17.6 Hz, 1H), 3.74(d,J=17.6 Hz, 1H), 3.92(s, 3H), 7.47(d,J=8.8 Hz, 2H) 7.88(d,J=8.8 Hz, 2H);13C NMRδ: 40.57, 54.17(q,J=29.3 Hz), 75.10, 123.00(q,J=284 Hz), 129.10, 129.46, 134.04, 140.61, 169.20, 193.53; tmajor=12.60 min, tminor=19.33 min。
2 结果与讨论
2.1 催化剂的催化活性
(1) 2的催化活性
在25 ℃反应,其余反应条件同1.2,考察2在三氟乙酸(TFA)存在下催化1a与三氟丙酮酸酯的Aldol反应,结果见表1。由表1可以看出,2a的催化活性最高,说明S-构型联二萘酚衍生出来的催化剂两个手性中心更匹配;但当联二萘酚上有取代基(2c~2e)时,产物的ee值降低,说明空间位阻太大,阻碍了反应的进行。

表1 手性胺2的催化活性*
*以苯乙酮为溶剂,于25 ℃反应96 h, 2和TFA用量均为10 mol%,其余反应条件同1.2;ee值由HPLC测定
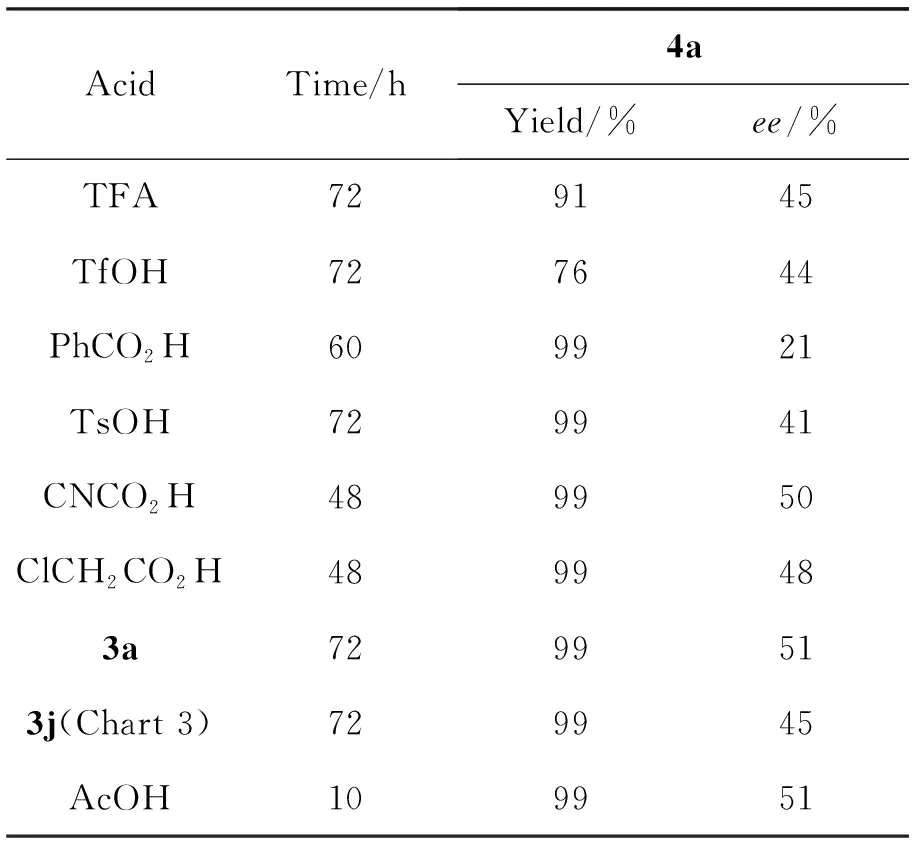
表2 酸的催化活性*
*2a和3用量均为10 mol%,其余同表1
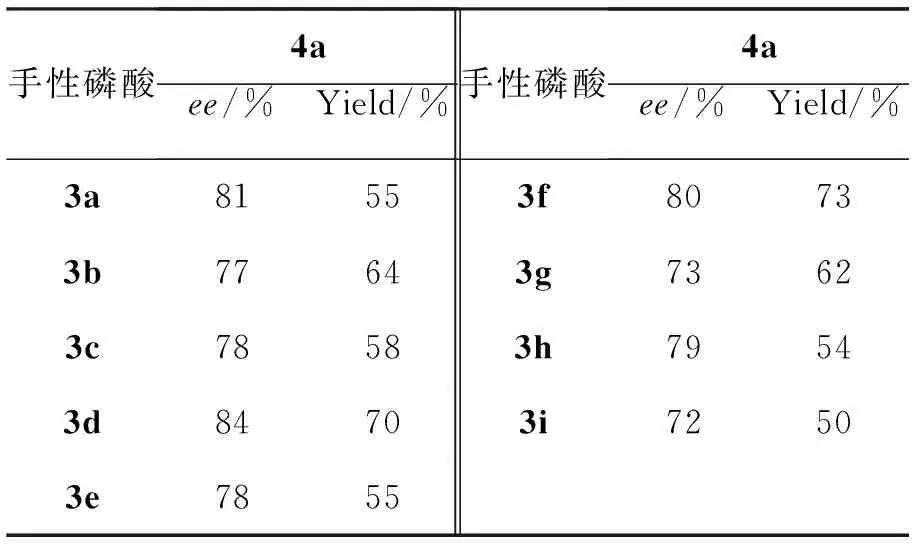
表3 手性磷酸3的催化活性*
*以二氯甲烷为溶剂,于0 ℃反应96 h,其余同表1
(2) 3的催化活性
以2a为手性胺,25 ℃反应,其余反应条件同1.2,考察有机酸和3催化1与三氟丙酮酸甲酯的Aldol反应,结果分别见表2和表3。从表2可见,R-构型的联二萘酚衍生的手性磷酸3比其余有机酸能取得比较好的催化效果。从表3可见,酸的空间位阻对反应有较大的影响,以3f为酸催化剂可以有效提高产物的ee值;用空间位阻较大的3h为酸催化剂,则产物的ee值降低。
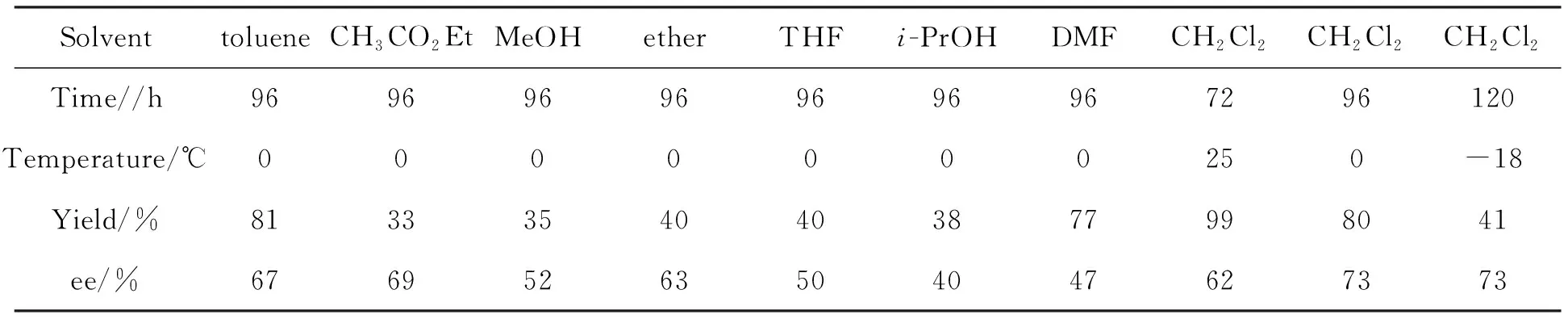
表4 溶剂和反应温度对Aldol反应的影响*
*2a和3f用量均为10 mol%,其余同表1
2.2 溶剂和反应温度对反应的影响
以2a和3f为催化剂,其余反应条件同1.2,考察溶剂和反应温度对Aldol反应的影响,结果见表4。由表4可见,溶剂对反应的产率和对应选择性有很大的影响。在0 ℃和二氯甲烷条件下反应最佳。由于反应物在甲醇、乙醚、四氢呋喃等溶剂中的溶解性欠佳,致使产物的产率和ee值都大大降低。温度的降低对反应的ee值没有明显变化,但延长反应时间产率则明显降低。
2.3 催化剂的用量对反应的影响

表5 手性胺和手性磷酸用量对Aldol反应的影响*
*二氯甲烷为溶剂,于0 ℃反应96 h,其余同表1
二氯甲烷为溶剂,于0 ℃反应96 h,其余反应条件同1.2,考察2a和3f用量对Aldol反应的影响,结果见表5。由表5可见,3f用量的改变不能有效的提高产物的ee值,当其用量从5 mol%提高至10 mol%时,对映选择性从62%提高到73%;进一步提高至20%时,ee值没有改变。增加2a用量对反应的影响也不大。
综上所述,Aldol的最佳条件为:以二氯甲烷为溶剂,3f10 mol%,2a10mol%,于0 ℃反应96 h。
2.4 最佳反应条件下的扩展试验
在最佳条件下考察了不同取代基的苯乙酮(1a~1g)与三氟丙酮酸甲酯的反应,结果见表6。 由表6可见,取代基为供电子效应基团(1b)时,反应的产率和收率都降低;取代基为羟基(1g)时, 反应没有能够发生;当取代基为吸电子基团的时候,反应产物的对应选择性和产率都比较相近,没有发生很大的改变。
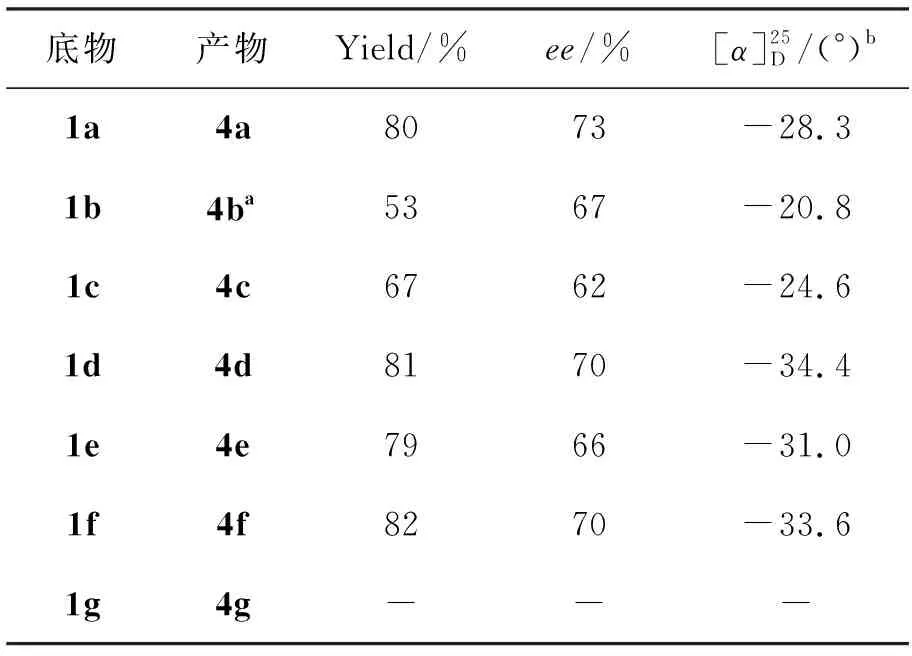
表6 扩展实验结果*
*二氯甲烷为溶剂,3f10 mol%,2a10mol%,于0 ℃反应96 h;a为AS柱,其余为OJ-H柱;bc0.5, CHCl3
3 结论
以手性二胺和手性磷酸成功的催化了苯乙酮和三氟丙酮酸甲酯的反应,并合成了一系列的衍生产物,取得了比较理想的结果,为制备具有光学活性的芳香族含氟化合物提供了一个较好的方法。
[1] Giovanni Casiraghi, Franca Zanardi. The vinylogous Aldol reaction:A valuable,yet understated carbon-carbon bond-forming maneuver[J].Chem Rev,2000,100:1929-1972.
[2] List B, Lerner R A, Barbas C F. Proline-catalyzed direct asymmetric Aldol reactions[J].J Am Chem Soc,2000,122:2395.
[3] Dalko P I, Moisan L. In the golden age of organocatalysis[J].Angew Chem Int Ed,2004,43:5138-5175.
[4] Sanzhong Luo, Hui Xu, Jiuyuan Li,etal. A simple primary-tertiary diamine-bronsted acid catalyst for asymmertic direct Aldol reactions of linear aliphatic ketones[J].J Am Chem Soc,2007,129(11):3074-3075.
[5] Jie Liu, Zhiqang Yang, Fei Wang,etal. Asymmetric direct Aldol reaction of functionalized ketones catalyzed by amine organocatalysts based on bispidine[J].J Am Chem Soc,2008,130(17):5654-5655.
[6] Quanzhong Liu, Xuelian Wang, Shiwei Luo,etal. Facile preparation of optically pure diamines and their application in asymmetric Aldol reactions[J].Tetrahedron Lett,2008,49:7434-7437.
[7] 李光熙,朱文平. 含氟新农药的展望[J].农药译丛,1985,7(4):2-129.
[8] Ron Dagant. Exchanging fluorines on highly fluorinated heteroaromatics is a useful strategy for making other highly substituted heterocycles[J].Chem En News,2001,79(9):40-43.
[9] Akiyama T, Morita H, Itoh J Fuchibe,etal. Chiral Brnsted acid catalyzed enantioselective hydrophosphonylation of imines:Asymmetric synthesis ofα-amino phosphonates[J].Org Lett,2005,7(13):2583-2585.
